中药挥发油的粉末化技术研究进展
2022-12-03江晓霞刘红宁姚子恒李哲明良山
江晓霞 刘红宁 姚子恒李哲 明良山
(江西中医药大学高等研究院, 中医基础理论分化发展研究中心, 现代中药制剂教育部重点实验室, 江西南昌330004)
挥发油又称精油,是一类具有挥发性、可随水蒸气蒸馏出来的液体,广泛分布于中药材中。挥发油由植物器官经次生代谢产生,储存于分泌细胞、腔、管、表皮细胞或腺毛状体中。研究表明,挥发油具有开窍、引药上行等功效,在抗肿瘤、抗菌、心脑血管等方面有重要作用[1]。
中药挥发油作为一种特殊的有效成分,以液态形式存在,具有不溶于水,刺激性大、挥发性强、稳定性差等缺点,易受光、氧、热等环境因素影响,使其在口服制剂及临床应用等方面的发展受到限制。2020 年版《中国药典》一部收载的常用中药固体制剂中,近20%成方制剂含有中药单体挥发油[2]。目前,挥发油的固体制剂是将其直接喷入半成品颗粒,混匀后置容器中密闭24 h,再分装、压片,或是加入适当增溶剂制备成各种剂型[1],该方法虽简单易行,但挥发油极易损失或发生变化。
挥发油粉末化作为中间剂型,不仅可以根据需要制成颗粒剂、片剂、胶囊剂等,还可以提高在制剂过程中的稳定性。挥发油粉末化方法有多孔吸附、环糊精包合、Pickering 原理乳化、脂质体包封、固体分散体及微囊包埋等[3]。本文从形成过程、常用材料、制备方法、影响因素、干燥方面对挥发油粉末化技术进行综述,以期实现中药挥发油的稳定及后续制剂产品的开发。
1 多孔材料吸附粉末化
1.1 多孔吸附过程 吸附材料有多孔、蜂窝状孔洞,其特点包括比表面积较大、空隙率大等,较强的吸附能力将挥发油吸附于颗粒中,从而达到固化的过程。过程分为3 个阶段,分别为吸附质通过围绕吸附质颗粒的液膜到达吸附剂的外表面(液膜扩散阶段),吸附质从吸附剂的外表扩散到孔隙中(颗粒内扩散阶段),吸附物瞬间在微孔内表面发生吸附[4]。多孔吸附的速率快慢受到液膜扩散和颗粒扩散的控制,且液膜的扩散速率高于颗粒的扩散速率。多孔材料用于吸附挥发油过程见图1。
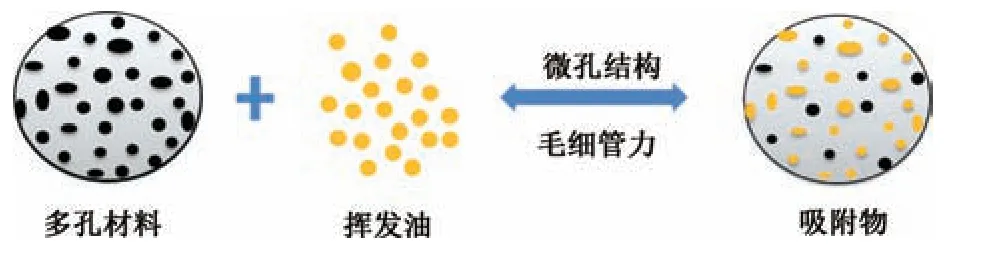
图1 多孔材料吸附挥发油过程
1.2 吸附的常用材料及影响因素 目前,常用的吸附材料有多孔淀粉、交联聚维酮、介孔碳、介孔二氧化硅、氧化石墨烯和羟基磷灰石等。影响吸附效率的主要因素包括多孔材料的性质、吸附工艺等,如颗粒比表面积、孔径、非晶态或晶体结构,都会影响所负载挥发油的释放[4]。多孔淀粉微孔直径约1 μm,比表面积为3.456 m2/g,可吸附自身质量70%~80%的挥发油而成固体粉末状[5]。吸附行为还受温度和时间的影响,葡聚糖链与薄荷酮在不同的温度下络合,随着温度的升高,薄荷酮最大包封率为86.6%[6]。
挥发油与吸附材料间的比例也会影响吸附率及溶出速度。多孔淀粉与肉桂挥发油质量比为2∶1时,桂皮醛的收率92.6%,溶出度大于98%[5]。柴翘挥发油与介孔二氧化硅间的质量比为1∶4~1∶1时,制得粉末分散较为均匀,表面无粘连现象[7]。氧化石墨烯固化挥发油时,当载体用量与挥发油质量比例相等(1∶1),即有较好的固化效果[8]。表1 列举了常用的吸附材料的固化方式及影响条件。
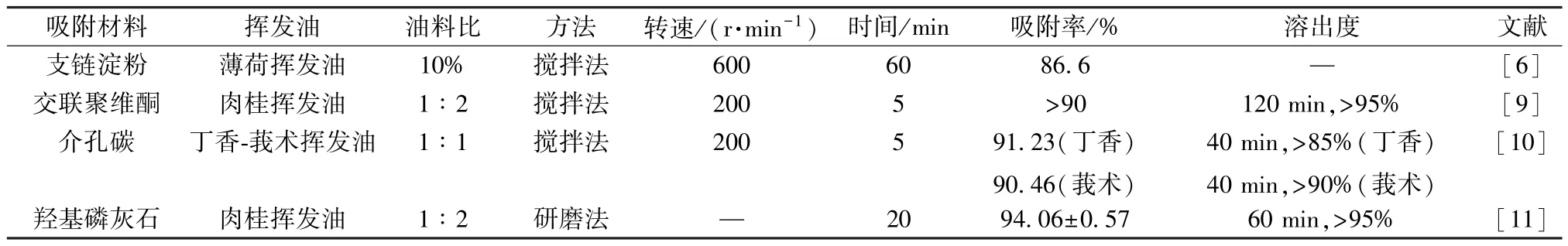
表1 常用吸附的多孔材料及影响条件
2 环糊精包合粉末化
2.1 包合物的形成过程 环糊精是一种从淀粉中提取的环寡糖,具“空穴结构”。吸附挥发油的原理是在范德华力(如色散力和偶极力)、氢键及荷迁移力等物理作用下,将挥发油分子包埋于“空穴结构”,从而形成包合物的过程[12]。包合是一种物理过程,客体分子部分或全部嵌入主体内部从而形成所需包合物。包合过程处于动态平衡,结合强弱可用包合常数反映。包合材料包合挥发油的过程见图2。
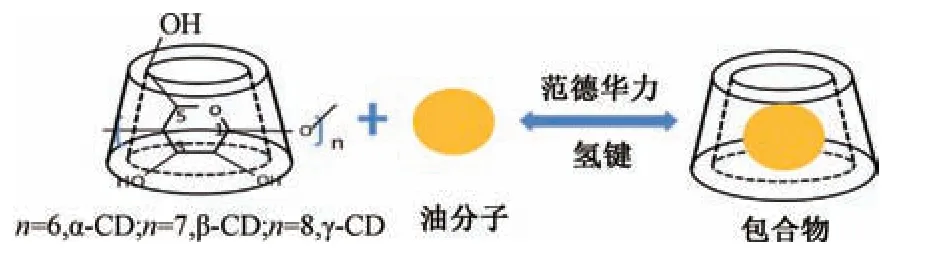
图2 环糊精包合挥发油过程
2.2 包合的常用材料及影响因素 目前,常见的环糊精有α⁃环糊精、β⁃环糊精、γ⁃环糊精,分别通过α⁃(1,4)键连接形成的低聚、大环状分子化合物,空腔大小分别为0.174、0.262、0.427 nm3[13]。β⁃环糊精能够包覆某些维生素及小分子芳香物等。挥发油的包合受环糊精的种类影响较大,β⁃环糊精为最常用的宿主分子。经近红外光谱及化学计量学分析得到,月桂烯在β⁃环糊精中包封效果较好[14⁃15]。然而,β⁃环糊精的水溶性较差(约2%),限制了其应用,为增加水溶性而开发的羟丙基⁃β⁃环糊精,具有高水溶性(60%)[14]。
此外,挥发油与辅料之间的比例会影响挥发油的包封率。当肉桂挥发油添加量为10.77%时,β⁃环糊精载油率最高,达到12%[16]。柠檬油与不同比例β⁃环糊精进行包合,当β⁃环糊精与柠檬油比例为6∶94时,柠檬油的挥发成分保留率最高。当包合物中柠檬油含量为9.68%时,包合容量达到最大[17]。表2 列举了β⁃环糊精及羟丙基⁃β⁃环糊精的固化方式及影响条件。

表2 常用环糊精包合的材料及条件
2.3 包合物的制备及干燥 包合物的制备技术也影响着挥发油的形态特征及性能。常用的制备技术有饱和水溶液法、研磨法、捏合法、冷冻干燥法、超临界技术等。通过比较饱和水溶液法与研磨法包合陈皮、枳壳挥发油发现,饱和水溶液法所得的包合物包合率和收率均更高[21]。此外,经捏合法与超临界技术法制备的香芹酚、芳樟醇包合物,捏合法中的β⁃环糊精包封效果更好[22]。
包合物多在40 ℃以下干燥以除去水分,常用方法有热风、真空、冷冻干燥、喷雾干燥等。柠檬挥发油包合物经喷雾干燥和真空干燥后,两者效果相似,但喷雾干燥更为简单及快捷[17]。
3 Pickering 乳粉末化原理
3.1 Pickering 乳化过程 Pickering 乳化技术是一种以固体颗粒为稳定剂,通过颗粒增加液滴间的相互斥力及空间位阻,防止聚集的过程。固体颗粒因具有较强的吸附能,吸附和解吸附慢,不可逆地吸附在油水界面上而形成致密的三维屏障膜。稳定乳液的机理主要包括脱附能理论、最大毛细力理论、机械阻隔理论、三维黏弹粒子网络理论[23]。该技术是一种高效稳定挥发油的方法,且未使用表面活性剂,减少其刺激性。Pickering 乳固化挥发油过程的见图3。

图3 Pickering 乳稳定挥发油过程
3.2 Pickering 乳的常用粒子及影响因素 Pickering 乳常用的固体颗粒有无机、有机等微粒。无机颗粒有二氧化硅、碳酸钙及自然矿物等。有机粒子有3类,分别为多糖基颗粒,如纤维素、壳聚糖、淀粉纳米晶体等;蛋白基颗粒,如乳清蛋白等;多糖⁃蛋白质复合物。蛋白基颗粒或蛋白⁃多糖复合物由于表面性质的两亲性,所以乳化性能更好[24]。
Pickering 乳的主要性能为稳定性及黏度。稳定性受众多因素影响,如固体颗粒类型、表面润湿性、粒径等,水相pH、电解质、温度等,其他因素如油相性质、油水比、乳液液滴大小等[23]。这些因素通过乳液的亲水/油性、界面能及黏度等方面来影响乳液稳定性。纤维素纳米晶体在固化牛至叶挥发油时,高油水比(1∶19)液滴的直径大于低油水比(1∶49),为(1.2±0.2)μm[25]。另外,钠蒙脱石颗粒在适当的大小(小于2 μm)及pH 值(低pH 值)下形成的乳液,黏度高达100 mPa·s,可保存7 个月[26]。表3 列举了常用Pickering 乳固化的材料及影响条件。

表3 常用Pickering 乳固化的材料及条件
3.3 Pickering 乳的制备及干燥 乳液的制备方法有高速均质、高压均质、超声等。高速均质是物料随着转齿的线速度,受到强烈地剪切、冲击和碰撞而被粉碎,从而达到均质乳化效果。高压均质是物料经高压、高速流过狭窄的缝隙时,受到强大撞击力及剪切力,进而加工成非常细微、稳定的乳浊液或悬浮液。葛根素纳米晶体与川芎挥发油先经高速剪切2 min后,在80 MPa 高压均质机中处理3 min,稳定后的乳剂能增加葛根素的口服生物利用度[30]。
Pickering 乳常用的干燥方法有真空干燥、真空冷冻干燥、喷雾干燥等。经肉桂酰氯改性的纤维素纳米晶体作为颗粒稳定剂,用于松节挥发油的包封,真空干燥后,可作为农药防治害虫[31]。乳清分离蛋白与马郁兰挥发油混合制备Pickering乳,真空冷冻干燥48 h后,可用于果胶膜的制备[32]。经Pickering 乳液模板法制备的二氧化硅⁃聚三聚氰胺甲醛复合壳可用于肉桂油的负载,在含有五氧化二磷密封处干燥48 h后,具有抗菌、控释的性能[33]。
4 脂质体包封粉末化
4.1 脂质体的分类及特点 脂质体通过具有磷脂双分子层结构实现对挥发油的包封,从而优化挥发油的稳定性及体内的吸收、分布。亲水性、疏水性及两亲性药物经脂质体携载,可直接输送至靶组织而发挥药效。脂质体由一个或多个双分子层自装组成的囊泡,分为多层、单片层、单片层。一般来说,脂质体的粒径在50~300 nm 之间是封装一定数量挥发油的合适载体[34]。脂质体包封挥发油的过程见图4。因脂质体稳定性较高、生物相容性良好,是一种适合体内降解,且无毒性、无免疫原性的定向药物载体。
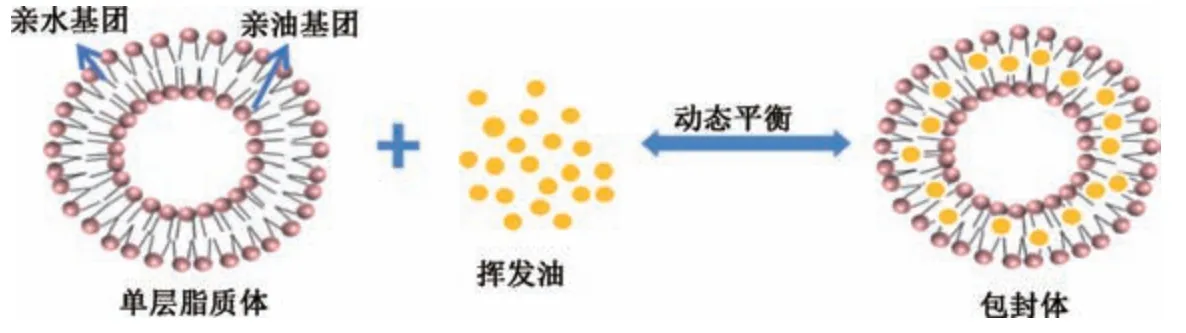
图4 脂质体包封挥发油过程
4.2 脂质体常用的材料及影响因素 制备脂质体常用的材料有天然磷脂(如磷脂酰胆碱)、合成磷脂(如二棕榈酰胆碱、二硬脂酰胆碱鞘磷脂等)、正电荷脂质(如硬脂酰胺、胆固醇衍生物等)、负电荷磷脂(如磷脂酸、磷脂酰甘油等)、胆固醇等。以卵磷脂及胆固醇制备的脂质体用于苍耳子挥发油的包封,包封率达68.0%[35]。非氢化磷脂酰胆碱脂质体对丁香酚的包封率最高达86.6%[36]。
脂质体包封主要受磷脂浓度、种类及工艺搅拌速率等影响。肉桂醛与蛋黄卵磷脂形成的脂质体,高比例下更容易聚集[37]。解郁安神方中挥发油与卵磷脂的质量比5∶1,卵磷脂质量浓度为7 g/L,搅拌速度为330 r/min时,制备的脂质体具有粒径小,分布均匀等特点[38]。为解决脂质体载药量低、易快速释放等缺点,挥发油可以包合物形式存在脂质体的水相中,或是高分子聚合物聚集在脂质体的表面。经壳聚糖和果胶与表面聚集、改性制备的菊花挥发油三层脂质体,在磷脂氧化、释放率、贮存稳定性等方面具有优异的性能[39]。表4 列举了常用脂质体包载的固化材料及影响条件。

表4 常用脂质体的固化材料及条件
4.3 脂质体的包封及干燥 脂质体包封挥发油的方法有薄膜蒸发法、乙醇注入法、乙醚注入法、逆相蒸发法等。柠檬桉树挥发油经薄膜分散法封装在固体纳米脂质体中,可提高挥发油的稳定性和延长货架期[34]。经乙醇注入⁃超声法制备姜黄挥发油脂质体,相比姜黄乳浊液更具稳定性且抗黄曲霉菌有效率升高[43]。
脂质体受温度、水分的影响较大,因此干燥方法一般为冷冻干燥。超临界快速膨胀技术制备的白术挥发油脂质体,经冻干后呈双层胶体球状,包封率为82.18%[44]。为防止冷冻干燥中脂质体的破坏,往往需要加入保护剂,如乳糖、甘露糖、海藻糖、环糊精等。迷迭香挥发油温敏脂质体在冷冻干燥中,以乳糖为保护剂,温度范围控制在39~42 ℃之间[42]。以β⁃环糊精作冷冻保护剂,其与脂质比例为6∶1时,制备的百里香挥发油固体脂质体,在冷冻干燥过程中不受低温和压力的影响[45]。
5 固体分散体粉末化
5.1 固体分散体的形成 固体分散体是指药物以分子态、微晶态、无定形态等高度分散于惰性的固体载体中,形成一种以固体形式存在的分散系统。药物与载体依据性质以及两者间的比例在载体中形成药物的固体溶液或固体悬浮液[46]。水溶性差的药物通过亲水性载体获得的固体分散体,实现溶解度及生物利用度的增加。因此,将中药挥发油制备成固体分散体,不仅能够增加溶解度、稳定性,而且还利于挥发油的粉末化。
5.2 固体分散体的常用材料及影响因素 固体分散体所用的载体依据结构可分为3类,一是亲水性载体,如尿素、甘露醇、糖类及其衍生物等;二是聚合物载体及合成聚合物,如聚维酮、聚乙二醇(PEG4000、6000 等)、聚乙烯吡咯烷酮等,还有天然聚合物,如羟丙基纤维素、乙基纤维素等;三是表面活性剂或其他亲水载体,如十二烷基硫酸钠等[46]。疏水物质因表面活性剂吸附于表面,使得表面张力降低,从而增加其在固体分散体中的溶解度。
载体的特性影响着固体分散体的稳定性,聚合物为最常用的固体分散体材料,其活性成分、浓度、比例对分散体的制备有重要影响。分散体的浓度决定溶液的黏度与溶解度关系。细辛挥发油在质量比1∶10 时与PEG(4000、6000、12000、20000)及PEG6000⁃PEG12000(1∶1)混合,经喷雾干燥后显示,以PEG 作为水溶性载体的固体分散体,均具有良好的分散度与溶出度,其中PEG6000、PEG12000 的溶出效果较好[47]。表5 列举了常用固体分散体的材料及制备条件。

表5 常用固体分散体材料及制备条件
5.3 固体分散体的制备及干燥 固体分散体的制备方法有溶剂蒸发法、熔融法、熔融溶剂法、研磨法等。比较熔融⁃溶剂法与研磨法所制备究川芎挥发油的固体分散体,结果显示,2 种方法均可提高川芎有效成分的口服生物利用度1.3~3.6 倍[52]。
固体分散体的干燥方法有蒸发、喷雾干燥、冷冻干燥等。在溶剂蒸发法中,将挥发油与聚合物载体先溶解在常见的低沸点有机溶剂中,溶剂蒸发后形成固体粉末。喷雾干燥是分散体在干燥室连续雾化的过程。乳清分离蛋白与麦芽糖糊精结合形成糖络合物后,经喷雾干燥技术制备的丁香酚固体分散体,其丁香酚的收率可达82.7%[53]。
6 微囊粉末化
6.1 微囊的形成及分类 微囊是指以天然或合成的高分子材料作为囊膜的壁壳,将固态或液态药物包裹而成的微型胶囊。一般微囊的粒径范围在1~1 000 μm 之间,厚度为0.2~10 μm 之间,其形状分为粒状、球型、椭圆形、块状或者不规则状,其中大多为球型,结构可分为单核、双核和多核。微囊将挥发油类药物进行微单元分隔和保护,在掩盖不良气味或降低刺激性的同时,不仅能使挥发油类药物粉末化,还可达到控释和缓释的效果。
6.2 微囊的包埋材料及影响因素 微囊所用的分子材料有明胶、阿拉伯胶、壳聚糖、淀粉、海藻酸盐等,不同的制备材料影响着微囊结构和性质。夏香草挥发油、水、3 种生物聚合物(苹果果胶、明胶、阿拉伯胶⁃明胶)、2 种交联剂(谷氨酰胺转胺酶、柠檬酸)通过复合凝聚方法制成的微囊,控释性能良好[54]。香茅挥发油与经明胶、阿拉伯胶复合形成的聚合壁包埋制备得到微囊,其释放速度随着壁材交联量的增加而降低。
微囊的粒径大小取决于囊材质量、制备参数(如匀化速度及时间)、其他辅料的性质(如稳定剂的种类及加入量)。囊材量固定时,微囊的粒径随着油量与囊材量比值增加而增大,当油量增大到一定量时,会形成油性粉末。乳化时间为20 min,反应pH 值为2,质量比为6∶1时,所制备的蕲艾挥发油胶囊粒径均匀(4.5 μm),含油率为85.71%[53]。表6 列举了常用微 囊的材料及制 备条件。

表6 常用微囊材料及制备条件
6.3 微囊的制备方法及干燥 微囊的制备方法有单凝聚法、复凝聚法、界面聚合法、喷雾干燥法等,其中喷雾干燥法是使用最广泛、最适宜于工业化生产微囊的方法。喷雾干燥不仅可以制备微囊,同时也可以实现微囊的干燥。薄荷挥发油以阿拉伯树胶和改性淀粉为囊材,采用喷雾干燥法制得的微囊稳定性好,薄荷醇的保留率达90%[53]。以阿拉伯胶和明胶为壁材,采用简单凝聚法和复合凝聚法对香茅挥发油进行微囊化,结果表明,2 种方法均能提供较好的包封工艺,包封率约为94%[59]。
微囊的干燥方法有喷雾干燥、低温干燥、冷冻干燥等。在喷雾干燥的过程中,挥发性成分易丢失。甜橙挥发油与麦芽糊精、明胶在不同比例下,经冻干法制备及干燥的微囊,产率高,抗氧化、抗菌性能稳定,且保存时间长[60]。
7 结论与展望
中药挥发油具有抗炎、抗过敏、抗氧化、抗微生物及抗癌等作用,但因其易挥发、稳定性差等缺点,在加工、利用及存储过程中,易分解变质。本文对挥发油常用的固化方法进行总结,通过多孔吸附、环糊精包合、Pickering乳化、脂质体包封、固体分散体、微囊等途径,再经过不同的干燥方法(真空、冻干和喷雾等)以实现挥发油的粉末化,从而提高挥发油的稳定性。
在粉末化的过程中,挥发油易出现包封率与载药量低等现象。因此,挥发油在选定何种粉末化方式时,应考虑辅料类型的筛选、制备工艺的特点等,从而选用适宜的制备技术。随着药物新载体、新技术的逐渐成熟,中药挥发油粉末化技术将更加成熟,能更好地将挥发油相关药品、产品应用于制药、食品、农业、护肤品等行业。
