红芪多糖对脂多糖诱导小鼠脓毒症心肌病的保护作用
2022-12-03玲孙媛高春华隋海娟于海英杨育红
张 玲孙媛 高春华 隋海娟 于海英 杨育红∗
(1.锦州医科大学基础医学院, 辽宁 锦州121001; 2.锦州医科大学附属第一医院, 辽宁 锦州121001;3.锦州医科大学药学院, 辽宁 锦州121001; 4.锦州医科大学基础医学实验教学中心, 辽宁 锦州121001)
脓毒症是一种由感染导致的宿主反应失调,可引起危及生命的器官功能障碍的全身炎症反应综合征[1],约50%脓毒症患者会出现不同程度的心肌损伤。脓毒症心肌病作为脓毒症的常见并发症,可使患者死亡率达80%左右[2⁃3]。积极探索脓毒症心肌病的有效治疗方案是医学界关注的重点。红芪多糖作为红芪的主要活性成分,是从红芪干燥根中提取的多糖。现代药理学研究发现,红芪多糖具有抗炎、免疫调节、抗氧化、抗衰老、降血糖、抗肿瘤等作用[4⁃6],具有保护糖尿病心肌病小鼠和急性心肌梗死大鼠心肌损伤的作用[7⁃8],但对脓毒症心肌病是否存在影响未见报道。本研究运用脂多糖(lipopolysaccharide,LPS)建立小鼠脓毒症心肌病模型,探讨红芪多糖对模型小鼠心肌损伤的保护作用及对TLR4 信号通路的影响,以期为脓毒症心肌病的治疗提供理论参考。
1 材料
1.1 动物 50 只雄性C57BL/6N 小鼠,体质量(20±2)g,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号SCXK(京)2021⁃0006。所有小鼠饲养于锦州医科大学SPF 级实验动物中心,温度(21±1)℃,相对湿度(55±5)%,实验动物使用许可证号SYXK(辽)2019⁃0007。所有实验操作均符合锦州医科大学动物伦理委员会要求(审查号2020041)。
1.2 试剂与药物 红芪多糖(纯度90%),甘肃益生祥生物技术有限公司,用时以生理盐水稀释。LPS,美国Sigma 公司;ELISA 试剂盒,南京建成生物工程研究所有限公司;TLR4 一抗,美国Santa Cruz 公司;IκBα、NF⁃κB 一抗,美国Cell Signaling公司;β⁃actin,北京中杉金桥生物技术有限公司。
1.3 仪器 ACUSON 彩色多普勒超声诊断仪,德国Siemens 公司;iMark 酶标检测仪、电泳仪,美国Bio⁃Rad公司;BX51 型荧光显微镜,日 本Olympus 公司;ChampGel 3000 型凝胶成像系统,北京赛智创业科技有限公司。
2 方法
2.1 分组及造模 参照文献[9] 报道方法建立脓毒症心肌病模型,50 只小鼠适应性饲养1 周后,按随机数字表法分为空白组、LPS 组及红芪多糖低、中、高剂量组(50、100、200 mg/kg),每组10 只。红芪多糖组灌胃相应剂量红芪多糖,空白组和LPS 组灌胃等量蒸馏水,连续给药14 d后,LPS 组和红芪多糖组均一次性腹腔注射10 mg/kg LPS 建立脓毒症心肌病小鼠模型,空白组则腹腔注射蒸馏水。
2.2 小鼠心功能检测 小鼠腹腔注射LPS 8 h后,用七氟醚对其进行麻醉,超声诊断仪检测左心室射血分数(LVEF)、左心室缩短分数(LVFS)、左心室舒张末期内径(LVEDD)、左心室收缩末期内径(LVESD)等指标。
2.3 ELISA 法检测血清炎症因子水平 小鼠心功能检测完毕后,心脏取血,4 ℃、3 000 r/min 离心10 min,取上层血清,分装后于-20 ℃冰箱保存备用。按ELISA 试剂盒说明书检测小鼠血清中肿瘤坏死因子⁃α(TNF⁃α)、白细胞介素⁃1β(IL⁃1β)和白细胞介素⁃6(IL⁃6)水平。
2.4 小鼠心肌组织HE 染色 小鼠取血后,按0.5 mL/100 g 腹腔注射20% 乌拉坦麻醉,开胸取出心脏,剪去心脏周围多余的组织,在生理盐水中洗净并用滤纸吸干水分,一部分于-80 ℃冰箱保存,用于RT⁃qPCR 和Western blot 检测;另一部分于4%多聚甲醛溶液中固定24 h,浸蜡,包埋,制备4 μm石蜡切片,进行常规HE 染色,二甲苯透明,梯度乙醇脱水,苏木精染色,盐酸分化,伊红染色,乙醇脱水透明,树脂封片,200 倍显微镜下观察心肌组织形态。
2.5 RT⁃qPCR 法检测心肌组织中TLR4、IκBα、NF⁃κBmRNA 表达 剪取各组小鼠心肌组织,经过裂解、抽提、RNA 沉淀和清洗,提取心肌总RNA,用第一链cDNA 合成试剂盒逆转录成单链cDNA(哈尔滨新海基因检测有限公司)。从GenBank 中查询小鼠TLR4、IκBα和NF⁃κB的基因序列,应用Primer 5.0 引物设计软件设计引物,由生工生物工程(上海)股份有限公司合成,引物序列见表1。使用SYBR Premix Ex Taq Ⅱ试剂盒进行RT⁃qPCR反应,所得数据采用2-ΔΔCT法计算小鼠心肌组织中TLR4、IκBα、NF⁃κBmRNA 相对表达。

表1 引物序列Tab.1 Primer sequences
2.6 Western blot 法检测TLR4、IκBα、NF⁃κB 蛋白表达 取60 mg 冻存的心肌组织,加入胞浆蛋白抽提试剂充分匀浆,按总蛋白提取试剂盒说明书提取总蛋白,BCA 试剂盒检测蛋白浓度。制胶,SDS⁃聚丙烯酰胺凝胶电泳,转膜,封闭液封闭后,加入稀释的TLR4、IκBα、磷酸化IκBα(p⁃IκBα)、NF⁃κB、磷酸化NF⁃κB(p⁃NF⁃κB)和β⁃actin 一抗,4 ℃杂交孵育过夜,次日洗膜后加二抗25 ℃孵育1 h,ECL 法显影,Image J 软件分析条带灰度值,以β⁃actin 为内参,计算目的蛋白相对表达。
2.7 统计学分析 通过SPSS 21.0 软件进行处理,计量资料以()表示,2 组间比较采用t检验,多组间均数比较采用单因素方差分析和LSD 检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 红芪多糖对小鼠心功能的影响 由表2 可知,与空白组比较,LPS 组小鼠LVEF、LVFS、LVEDD、LVESD 降低了44.09%、60.86%、29.67%、40.47%(P<0.01),说明造模成功,小鼠心功能受损;与LPS 组比较,红芪多糖各剂量组小鼠心功能指标均升高(P<0.05,P<0.01),并与药物剂量呈正相关。
表2 各组小鼠心功能比较(,n=5)Tab.2 Comparison of mouse cardiac functions of each group(,n=5)

表2 各组小鼠心功能比较(,n=5)Tab.2 Comparison of mouse cardiac functions of each group(,n=5)
注:与空白组比较,∗∗P<0.01;与LPS 组比较,#P<0.05,##P<0.01。
3.2 红芪多糖对小鼠心肌形态的影响 如图1 所示,空白组小鼠心肌的形态及排列无异常,未见炎性细胞浸润,组织间隙无异常变化;与空白组比较,LPS 组小鼠心肌细胞呈现异常变形,心肌组织间有炎性细胞浸润,部分心肌细胞有空泡状改变;与LPS 组比较,红芪多糖各剂量组小鼠心肌细胞的形态随药物剂量增加而逐渐趋向正常,细胞空泡和炎性细胞浸润情况减轻,说明红芪多糖可改善脓毒症心肌病的病理变化。

图1 各组小鼠的心肌组织形态(HE,×200)Fig.1 Pathological morphology of mouse myocardium of each group(HE,×200)
3.3 红芪多糖对小鼠血清炎症因子水平的影响如图2 所示,与空白组比较,LPS 组小鼠血清TNF⁃α、IL⁃1β、IL⁃6 水平均升高(P<0.01);与LPS 组比较,红芪多糖各剂量组小鼠血清TNF⁃α、IL⁃1β、IL⁃6 水平均降低(P<0.05,P<0.01),并呈剂量依赖性。

图2 各组小鼠血清TNF⁃α、IL⁃1、IL⁃6 水平比较(,n=5)Fig.2 Comparison of mouse serum TNF⁃α,IL⁃1 and IL⁃6 levels of each group(,n=5)
3.4 红芪多糖对小鼠心肌组织TLR4、IκBα、NF⁃κBmRNA 表达的影响 如图3 所示,与空白组比较,LPS 组小鼠心肌组织TLR4、NF⁃κBmRNA 表达升高(P<0.01);与LPS 组比较,红芪多糖各剂量组小鼠心肌组织TLR4、NF⁃κBmRNA 表达均降低(P<0.01),并呈剂量依赖性;各组小鼠心肌组织中IκBαmRNA 表达无明显差 异(P>0.05)。
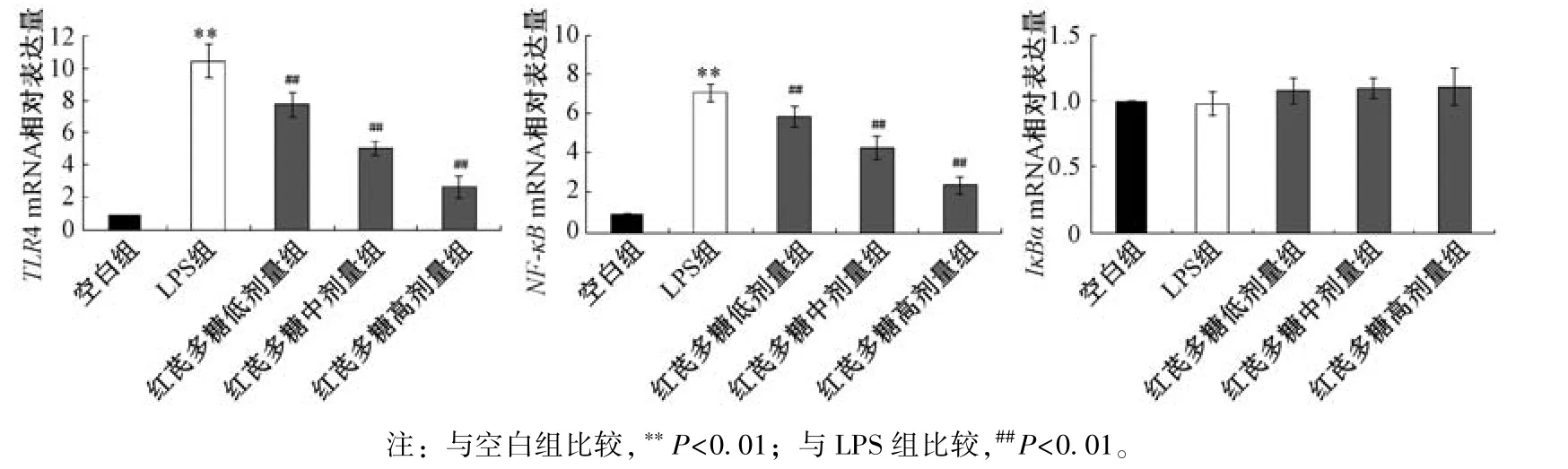
图3 各组小鼠心肌组织TLR4、 IκBα、 NF⁃κB mRNA 表达比较(,n=3)Fig.3 Comparison of TLR4,IκBα and NF⁃κB mRNA expressions in mouse myocardial tissue of each group(,n=3)
3.5 红芪多糖对小鼠心肌组织TLR4/IκBα/NF⁃κB 信号通路相关蛋白表达的影响 如图4 所示,与空白组比较,LPS 组小鼠心肌组织TLR4、p⁃IκBα/IκBα、p⁃NF⁃κB/NF⁃κB 蛋白表达升高(P<0.01);与LPS 组比较,红芪多糖各剂量组小鼠心肌组织TLR4、p⁃IκBα/IκBα 和p⁃NF⁃κB/NF⁃κB 蛋白表达均降低(P<0.01),并呈剂量依赖性。
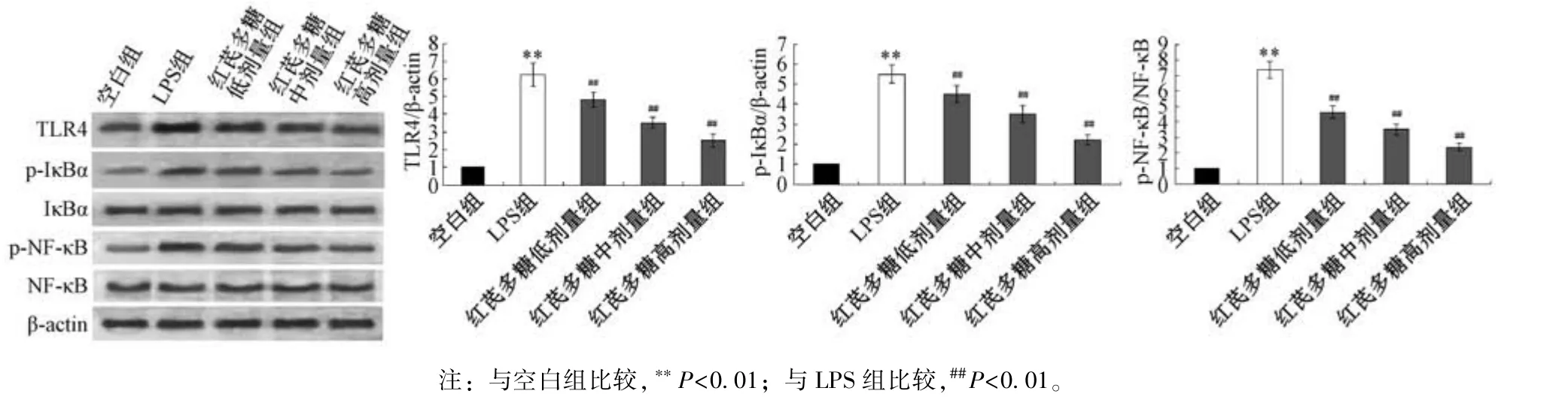
图4 各组小鼠心肌组织TLR4、IκBα、NF⁃κB 蛋白表达比较(,n=3)Fig.4 Comparison of TLR4,IκBα and NF⁃κB protein expressions in mouse myocardial tissue of each group(,n=3)
4 讨论
中医认为脓毒症的病机主要为正气不足、毒热内蕴、络脉癖滞,气血失运,脏腑失于濡养。心脏便是受累的脏腑之一。虽然很多研究探寻脓毒症心肌病的发病机制[10⁃12],但目前该病仍以支持治疗为主,尚缺乏针对性治疗药物。红芪系豆科植物多序岩黄芪Hedysarum polybotrys的干燥根,2020 年版《中国药典》记载红芪的功能有“补气升阳、固表止汗、利水消肿、生津养血、行滞通痹、托毒排脓、敛疮生肌”[13]。红芪多糖作为红芪的主要活性成分,可通过补气、益气使得血脉行、痰浊化、经络濡养[7]。由上述中医理论推测,红芪多糖对脓毒症心肌病可能存在保护作用。
临床研究显示,脓毒症心肌病的典型表现是心功能障碍[14],且心脏结构会发生病理性改变[15]。借鉴张胜等[16]的评定标准,可通过检测心功能和观察心肌组织形态学改变评价该病模型是否成功。本实验发现,LPS 组小鼠各项心功能指标均较空白组下降,组织切片可见心肌细胞受损和炎性细胞浸润,由此可判定脓毒症心肌病模型制备成功。红芪多糖干预后,脓毒症小鼠心功能指标有显著改善,心肌细胞受损程度和炎症细胞浸润情况减轻,提示红芪多糖对LPS 诱导小鼠的脓毒症心肌病具有保护作用。
有研究表明TLR4 信号通路是引起脓毒症的主要通路[17]。TLR4 是Toll 样受体家族中重要的成员之一,表达于心肌细胞、免疫细胞和上皮细胞等表面,能识别LPS 和器官损伤后释放的内源性配体[18]。TLR4 被LPS 激活后可使IκBα 磷酸化,作为NF⁃κB 蛋白的主要抑制剂,IκBα 缺乏或活性改变可导致NF⁃κB 活性失调,介导发生各种感染性疾病、免疫性疾病、肿瘤等[19]。发生磷酸化的IκBα 降解,进而使NF⁃κB 活化,启动炎性细胞因子转录,释放TNF⁃α、IL⁃1β、IL⁃6 等促炎因子,引起一系列脓毒症的病理结果,包括血管外渗、组织损伤、多脏器功能衰竭甚至死亡[20]。本实验结果显示,经红芪多糖干预后,LPS 诱导的小鼠血清炎症因子水平降低,心肌组织中TLR4、NF⁃κB mRNA和蛋白表达降低,p⁃IκBα/IκBα 比值降低。以上结果表明,红芪多糖可通过调控TLR4/IκBα/NF⁃κB 信号通路抑制促炎因子TNF⁃α、IL⁃1β 和IL⁃6 的释放,改善小鼠心功能,抑制心肌组织的病理改变。
综上所述,本研究证实红芪多糖对LPS 诱导小鼠的脓毒症心肌病具有保护作用,其机制可能与调控TLR4/IκBα/NF⁃κB 信号通路有关。
