扶正化纤方水煎液对博来霉素诱导小鼠肺纤维化及肺组织CFTR 表达的影响
2022-12-03文王俊王凤婵陆学超胡海波赵国静
姜 文王俊 王凤婵 陆学超 胡海波 赵国静∗
(1.青岛市中医医院呼吸与危重症医学科, 山东 青岛266033; 2.青岛市中医医院急诊科, 山东 青岛266033)
特发性肺纤维化是以寻常间质性肺炎为病理特征的一种间质性肺疾病,死亡率高,通常发生于中老年人群[1],由于其发病机制不明,诊断困难,缺乏有效的干预方法[2]。因此,积极探讨特发性肺纤维化的病因,寻找有效的治疗手段是目前研究的重点。扶正化纤方由三七粉、地龙、红景天、黄芪、麦冬、五味子等多种中药组成,具有通补肺络的功效,能明显改善特发性肺纤维化患者的症状,提高生存质量,延缓病情的进展[3],但其机制并不明确。
研究报道,环磷酸腺苷(cyclic adenosine monophosphate,cAMP)在心、肺、肝等纤维化模型中的表达均降低,其表达上调能够抑制炎症反应,减轻细胞外基质的沉积,具有抗纤维化的作用[4]。囊性纤维化跨膜转导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)是一种cAMP 依赖的氯离子通道蛋白,广泛表达在与分泌和吸收有关的上皮组织(如小肠、气道、胰腺等)中,与多种疾病的发生发展密切相关[5⁃6]。研究发现,CFTR 在气道黏液细胞中有表达,其缺乏会影响黏液细胞的液体分泌及气道表层液体的水化,导致腺体内黏液严重堵塞[7⁃8]。因此,CFTR 对保持肺部的无菌环境,防止病原体和有害物质进入血液循环有重要作用,且以CFTR 为靶点的调节剂被证明可显著改善肺功能,减少肺部病变[9],而CFTR 在特发性肺纤维化中所起到的作用少有报道。因此,本研究对CFTR 在特发性肺纤维化中的表达及扶正化纤方对其调控作用进行了探讨。
1 材料与方法
1.1 动物 SPF 级C57BL/6 雄性小鼠84只,体质量(20~22)g,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号SCXK(京)2019⁃0009。小鼠饲养环境为12 h/12 h 明暗交替,温度(20±2)℃,相对湿度为45%~60%,自由获取食物和水。本实验均经青岛市中医医院动物伦理委员会审核并批准,并按3R 原则给予人道关怀。
1.2 药物 扶正化纤方由三七粉6 g、地龙24 g、红景天30 g、黄芪30 g、麦冬24 g、补骨脂12 g、五味子15 g、山萸肉15 g、太子参18 g、茯苓24 g、炒杏仁9 g、薏苡仁30 g、冬瓜仁30 g、款冬花12 g、炙甘草9 g 组成,由青岛市中医医院制剂科加工煎制。将上述药材加水充分浸泡后,煎煮2次,每次40 min,过滤,合并2 次药液,浓缩至生药量14.96 g/mL,于4 ℃冰箱保存备用,此为高剂量组药物,灌胃给药时,将药液分别稀释为3.74、7.48 g/mL 作为低、中剂量。
1.3 试剂 硫酸博来霉素(批号15361)购自美国Sigma 公司;吡非尼酮胶囊(批号150603)购自北京康蒂尼药业股份有限公司;H⁃89(PKA 抑制剂)、HE 染色液、RIPA 裂解液、二喹啉甲酸(bicinchoninic acid,BCA)试剂盒(货号S1643、C0105、P0013B、P0010)均购自上海碧云天生物技术有限公司;羟脯氨酸(hydroxyproline,HYP)检测试剂盒(货号A030⁃3)购自南京建成生物工程研究所有限公司;Masson 染色试剂盒(货号G1340)购自北京索莱宝科技有限公司;cAMP ELISA 试剂盒、白介素17B(interleukin 17B,IL⁃17B)、蛋白激酶A(protein kinase A,PKA)、p⁃PKA、环磷腺苷效应元件结合蛋白(cAMP⁃response element binding protein,CREB)、p⁃CREB(phospho S133)、β⁃actin、山羊抗兔 IgG H&L(HRP)(货号ab76238、ab106272、ab75991、ab32390、ab32515、ab32096、ab8227、ab205718)均购自英国Abcam 公司。
1.4 仪器 iMark680 型多功能酶标仪、蛋白转膜装置购自美国Bio⁃Rad 公司;ABI Prism ®7300 型荧光定量PCR 系统购自美国应用生物系统公司;显微镜购自日本Olympus 公司。
1.5 模型建立 采用气管插管注入博来霉素(5 mg/kg,PBS 溶解)构建肺纤维化模型[10],小鼠腹腔注射2%水合氯醛(0.4 mL/20 g)麻醉后,将小鼠垂直悬挂于鼠板上,清理口腔异物后,术者手执静脉置管 [管内已注入50 μL 博来霉素(2 μg/μL)] 通过声门裂插入气管内,后用1 mL针将0.8 mL 气体推入气管,约2 s 内完成,小鼠悬挂10 s 左右,使药物更加均匀地分布于肺内,注药后的小鼠右侧卧位置于鼠笼中等待自然苏醒。另设空白组,经气管注入等量生理盐水,其余操作同上。
1.6 分组及给药 造模完成后,将小鼠随机分为模型组,吡非尼酮组(6 mg/kg)[10],扶正化纤方低、中、高剂量组(37.4、74.8、149.6 g/kg),扶正化纤方+H⁃89 组(扶正化纤方149.6 g/kg+cAMP/PKA 抑制剂H⁃89 1 mg/kg),每组12只,另设空白组12 只。吡非尼酮组和扶正化纤方各剂量组灌胃相应剂量药液,给药容量为10 mL/kg,扶正化纤方+H⁃89 组在灌胃扶正化纤方的同时腹腔注射H⁃89 1 mg/kg,模型组和空白组灌胃等量无菌用水,每天1次,连续28 d。
1.7 取材及指标检测
1.7.1 肺指数 给药后,取小鼠肺组织,生理盐水冲洗后,滤纸吸干表面水分,分别称定小鼠体质量和肺质量,计算各组小鼠的肺指数。
1.7.2 肺组织病理学变化 取小鼠左侧肺组织一部分于-20 ℃冰箱保存;另一部分于4%多聚甲醛固定。固定的肺组织经石蜡包埋、切片后,进行HE 染色观察肺组织气道周围炎症细胞浸润情况;Masson 染色观察胶原沉积情况,评估肺纤维化程度,并对各组病理学进行分级评分,每只小鼠肺组织切片任取5 个独立区域进行评分,取平均值。评分标准参考[11] 报道,见表1。

表1 肺组织病理学评分标准Tab.1 Scoring criteria for lung histopathology
1.7.3 肺组织羟脯氨酸(HYP)水平 取适量于-20 ℃冰箱中保存的部分肺组织,加入组织裂解液,振荡混匀,于沸水中水解20 min,取4 mL 反应试剂,混匀,水浴锅中静置20 min 后取出,冷却至室温后离心15 min,取上清液,按照试剂盒说明书操作,在550 nm 波长处测定其吸光度值,计算HYP 水平。
1.7.4 RT⁃qPCR 法检测小鼠肺组织CFTRmRNA表达 将小鼠右侧肺组织一部分液氮速冻后,于-80 ℃冰箱保存,用于Western blot 实验;另一部分用TRIzol 试剂盒提取组织中的总RNA,紫外分光光度法检测总RNA 的浓度和纯度。按照试剂盒说明书进行反转录制备cDNA,收集cDNA 用于PCR 扩增。扩增体系(20 μL)为cDNA 1 μL,正、向引物各0.5 μL,SYBR ®Premix Ex TaqTM(2×)10 μL,加入ddH2O 使最终体积为20 μL。扩增条件为95 ℃10 min;95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸20 s,共40 个循环。以GAPDH为内参,采用2-ΔΔCT法计算CFTRmRNA 相对表达。引物序列见表2。

表2 引物序列Tab.2 Primer sequences
1.7.5 酶联免疫吸附法(ELISA)检测肺组织cAMP 水平 取适量于-20 ℃冰箱保存的肺组织,制备成10%组织匀浆,按照ELISA 试剂盒说明书检测肺组织匀浆中cAMP 水平。
1.7.6 免疫组化法检测肺组织CFTR、IL⁃17B 蛋白表达 取肺组织石蜡切片,脱蜡水化、抗原修复后,加3%过氧化氢封闭内源性过氧化物酶活性,山羊血清封闭,加入一抗(CFTR、IL⁃17B,1∶100)4 ℃孵育过夜,洗去一抗,加HRP 标记的山羊抗兔lgG(1∶200)37 ℃孵育30 min,DAB 显色,封片。光学显微镜下观察细胞内呈棕黄色颗粒为阳性表达,拍照并用Image⁃Pro Plus 6.0 软件计算阳性表达的积分光密度(integrated optical density,IOD)。
1.7.7 Western blot 法检测肺组织CFTR、IL⁃17B、PKA、CREB 蛋白表达 取于-80 ℃冰箱保存的肺组织,按照试剂盒说明书提取组织中总蛋白,BCA法测定蛋白浓度,取30 μg 蛋白质样品上样,SDS⁃PAGE 凝胶电泳,湿转法转膜,5%脱脂奶粉封闭,加入一抗(CFTR、IL⁃17B、PKA、p⁃PKA、CREB、p⁃CREB,1∶1 000;β⁃actin,1∶2 000)4 ℃孵育过夜,洗去一抗,加入羊抗兔二抗(1∶5 000)室温孵育1 h,ECL 法显色,通过计算与内参β⁃actin的灰度值比,得出目的蛋白的相对表达。
1.8 统计学分析 通过SPSS 22.0 和Image pro plus 6.0 软件进行处理,数据以()表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间有差异进一步采用SNK⁃q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 扶正化纤方对小鼠肺指数和肺组织HYP 水平的影响 与空白组比较,模型组小鼠肺指数、肺组织HYP 水平均升高(P<0.05);与模型组比较,吡非尼酮组和扶正化纤方各剂量组小鼠肺指数、HYP 水平降低(P<0.05),并呈剂量依赖性(P<0.05);与吡非尼酮组比较,扶正化纤方高剂量组上述指标差异无统计学意义(P>0.05);与扶正化纤方高剂量组比较,扶正化纤方+H⁃89 组小鼠肺指数、HYP 水平升高(P<0.05),见表3。
表3 各组小鼠肺指数比较(,n=12)Tab.3 Comparison of mouse pulmonary indices levels of each group(,n=12)
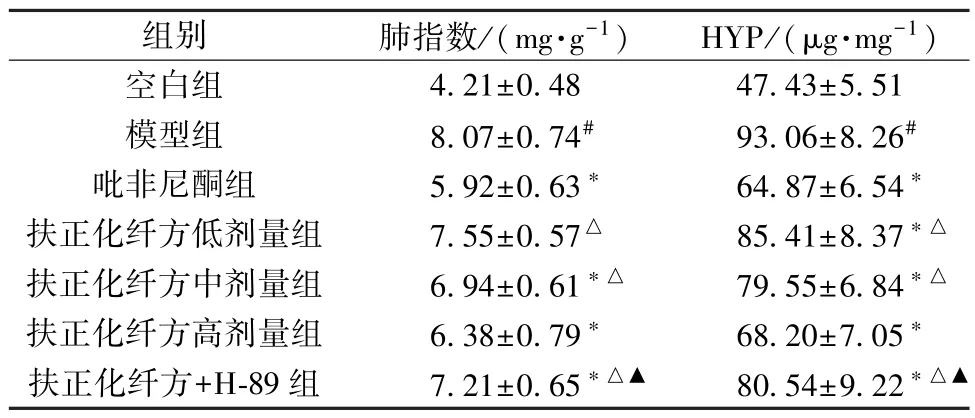
表3 各组小鼠肺指数比较(,n=12)Tab.3 Comparison of mouse pulmonary indices levels of each group(,n=12)
注:与空白组比较,#P<0.05;与模型组比较,∗P<0.05;与吡非尼酮组比较,△P<0.05;与扶正化纤方高剂量组比较,▲P<0.05。
2.2 扶正化纤方对小鼠肺组织病理学变化的影响 空白组小鼠肺组织结构完整,肺泡璧无增厚,无明显炎性细胞浸润和蓝色胶原纤维沉积;与空白组比较,模型组小鼠气道璧增厚明显,管腔狭窄,有大量炎性细胞浸润,蓝色胶原纤维沉积增多,病理损伤评分均升高(P<0.05);与模型组比较,吡非尼酮组和扶正化纤方各剂量组小鼠肺组织炎性细胞浸润和胶原纤维沉积减少,病理损伤评分降低(P<0.05),并呈剂量依赖性(P<0.05);与吡非尼酮组比较,扶正化纤方高剂量组炎性细胞浸润和胶原纤维沉积差异无统计学意义(P>0.05);与扶正化纤方高剂量组比较,扶正化纤方+H⁃89 组小鼠肺组织炎性细胞浸润和胶原纤维沉积增多,病理损伤评分升高(P<0.05),见表4、图1~2。

图1 各组小鼠肺组织HE 染色(×400)Fig.1 HE staining of mouse lung tissue of each group(×400)
表4 各组小鼠肺组织病理损伤评分比较(分,,n =12)Tab.4 Comparison of mouse pulmonary pathological damage scores of each group(score,,n =12)

表4 各组小鼠肺组织病理损伤评分比较(分,,n =12)Tab.4 Comparison of mouse pulmonary pathological damage scores of each group(score,,n =12)
注:与空白组比较,#P<0.05;与模型组比较,∗P<0.05;与吡非尼酮组比较,△P<0.05;与扶正化纤方高剂量组比较,▲P<0.05。

图2 各组小鼠肺组织Masson 染色(×400)Fig.2 Masson staining of mouse lung tissue of each group(×400)
2.3 扶正化纤方对小鼠肺组织CFTRmRNA 表达的影响 与空白组比较,模型组小鼠肺组织CFTRmRNA 表达降低(P<0.05);与模型组比较,吡非尼酮组和扶正化纤方各剂量组小鼠肺组织CFTRmRNA 表达升高(P<0.05),并呈剂量依赖性(P<0.05);与吡非尼酮组比较,扶正化纤方高剂量组CFTRmRNA 表达差异无统计学意义(P>0.05);与扶正化纤方高剂量组比较,扶正化纤方+H⁃89 组小鼠肺组织CFTRmRNA 表达降低(P<0.05),见表5。
表5 各组小鼠肺组织CFTR mRNA 表达和cAMP 水平比较(,n=12)Tab.5 Comparison of mouse pulmonary CFTR mRNA expression and cAMP level of each group(,n=12)

表5 各组小鼠肺组织CFTR mRNA 表达和cAMP 水平比较(,n=12)Tab.5 Comparison of mouse pulmonary CFTR mRNA expression and cAMP level of each group(,n=12)
注:与空白组比较,#P<0.05;与模型组比较,∗P<0.05;与吡非尼酮组比较,△P<0.05;与扶正化纤方高剂量组比较,▲P<0.05。
2.4 扶正化纤方对小鼠肺组织cAMP 水平的影响 与空白组比较,模型组小鼠肺组织cAMP 水平降低(P<0.05);与模型组比较,吡非尼酮组和扶正化纤方各剂量组小鼠肺组织cAMP 水平升高(P<0.05),并呈剂量依赖性(P<0.05);与吡非尼酮组比较,扶正化纤方高剂量组cAMP 水平差异无统计学意义(P>0.05);与扶正化纤方高剂量组比较,扶正化纤方+H⁃89 组小鼠肺组织cAMP 水平降低(P<0.05),见表5。
2.5 扶正化纤方对小鼠肺组织CFTR、IL⁃17B 阳性表达的影响 与空白组比较,模型组小鼠肺组织CFTR 阳性表达减少(P<0.05),IL⁃17B 阳性表达增加(P<0.05);与模型组比较,吡非尼酮组和扶正化纤方各剂量组小鼠肺组织CFTR 阳性表达增加(P<0.05),IL⁃17B 阳性表达减少(P<0.05),并呈剂量依赖性(P<0.05);与吡非尼酮组比较,扶正化纤方高剂量组CFTR、IL⁃17B 阳性表达差异无统计学意义(P>0.05);与扶正化纤方高剂量组比较,扶正化纤方+H⁃89 组小鼠肺组织CFTR 阳性表达减少(P<0.05),IL⁃17B 阳性表达增加(P<0.05),见图3~4、表6。
表6 各组小鼠肺组织CFTR、IL⁃17B 表达比较(IOD,,n=12)Tab.6 Comparison of mouse pulmonary CFTR and IL⁃17B expressions of each group(IOD,,n=12)
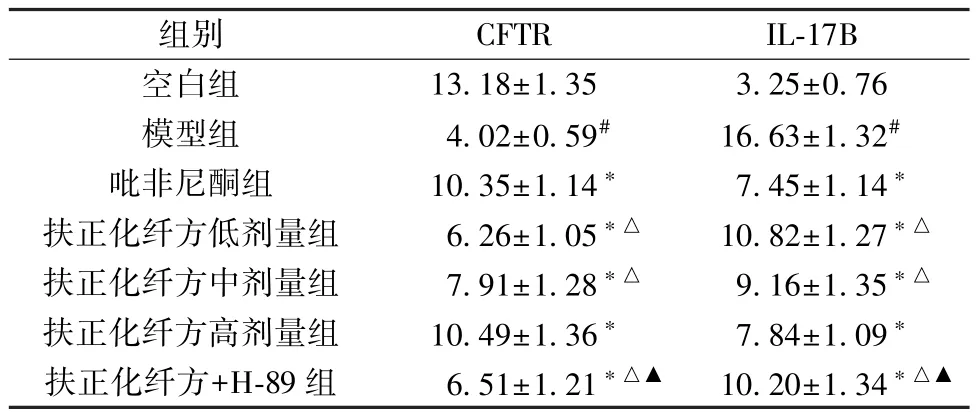
表6 各组小鼠肺组织CFTR、IL⁃17B 表达比较(IOD,,n=12)Tab.6 Comparison of mouse pulmonary CFTR and IL⁃17B expressions of each group(IOD,,n=12)
注:与空白组比较,#P<0.05;与模型组比较,∗P<0.05;与吡非尼酮组比较,△P<0.05;与扶正化纤方高剂量组比较,▲P<0.05。
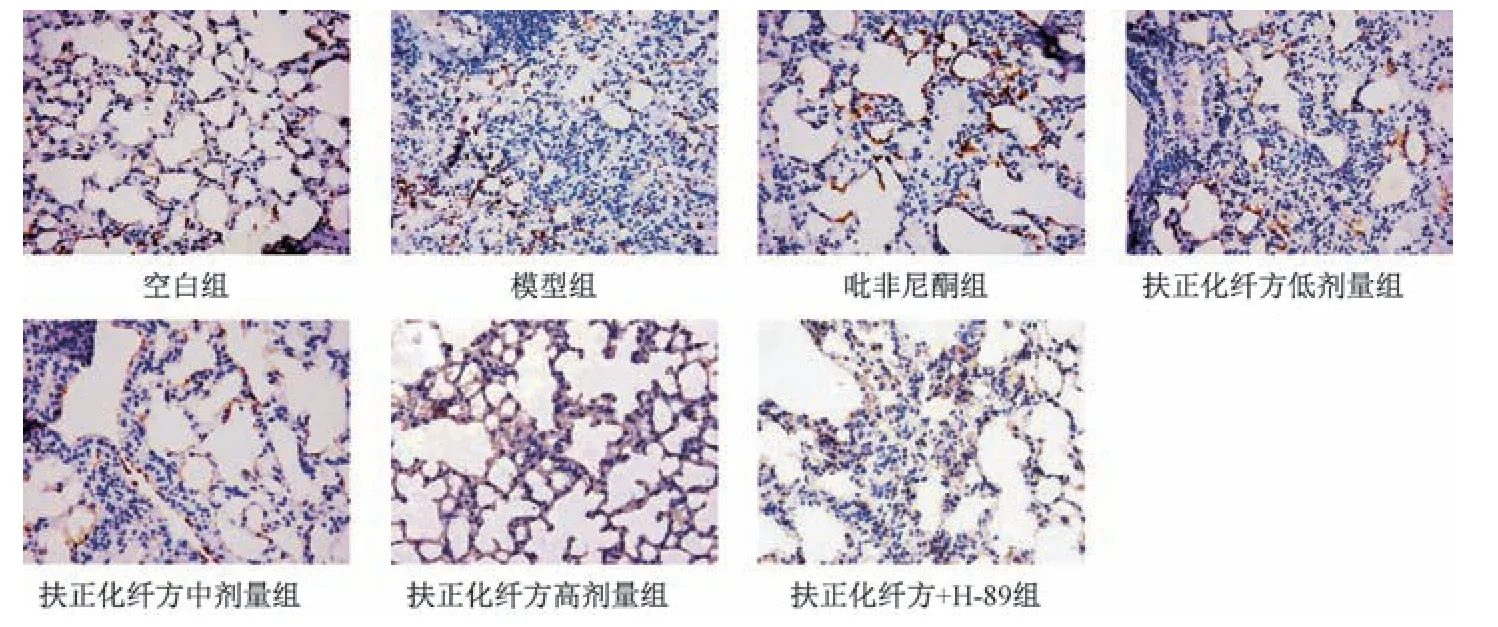
图3 各组小鼠肺组织CFTR 免疫组化染色(×400)Fig.3 Immunohistochemical staining of mouse pulmonary CFTR of each group(×400)
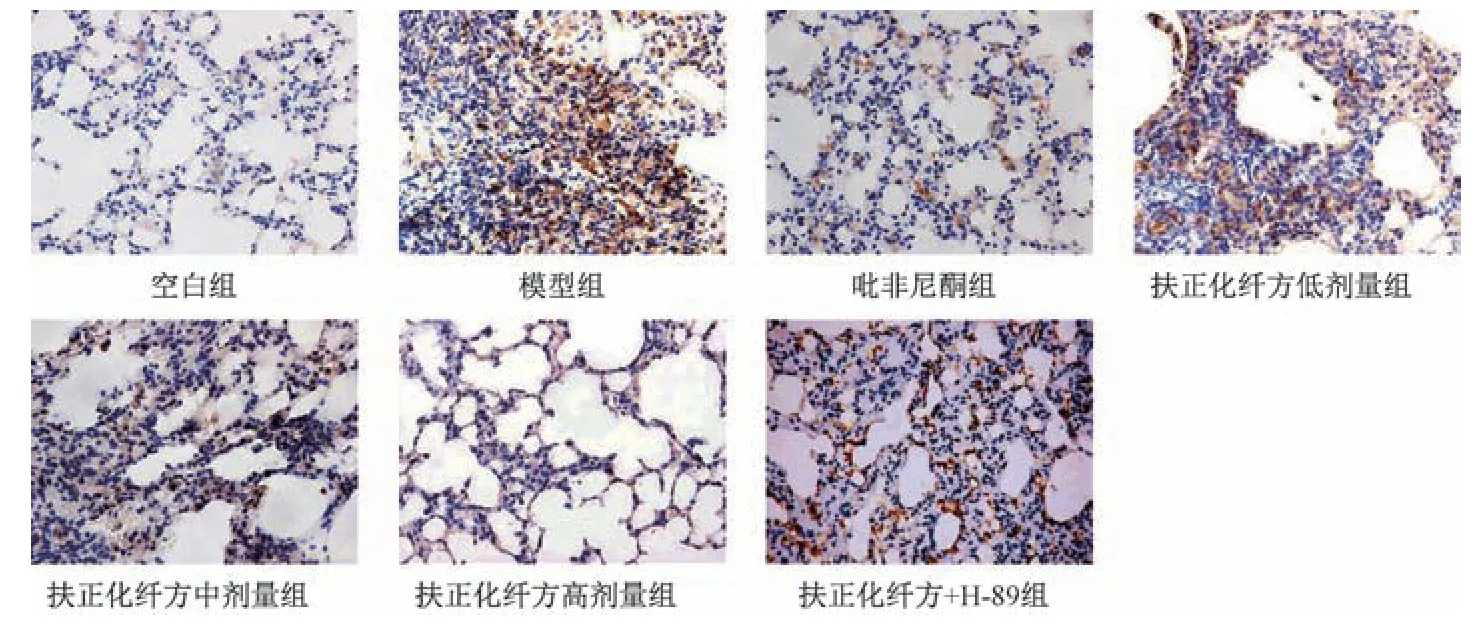
图4 各组小鼠肺组织IL⁃17B 免疫组化染色(×400)Fig.4 Immunohistochemical staining of mouse pulmonary IL⁃17B of each group(×400)
2.6 扶正化纤方对小鼠肺组织CFTR、IL⁃17B、PKA 蛋白表达的影响 与空白组比较,模型组小鼠肺组织CFTR、p⁃PKA/PKA、p⁃CREB/CREB 蛋白表达降低(P<0.05),IL⁃17B 蛋白表达升高(P<0.05);与模型组比较,吡非尼酮组和扶正化纤方各剂量组小鼠肺组织CFTR、p⁃PKA/PKA、p⁃CREB/CREB 蛋白表达升高(P<0.05),IL⁃17B 蛋白表达降低(P<0.05),并呈剂量依赖性(P<0.05);与吡非尼酮组比较,扶正化纤方高剂量组上述指标差异无统计学意义(P>0.05);与扶正化纤方高剂量组比较,扶正化纤方+H⁃89 组小鼠肺组织CFTR、p⁃PKA/PKA、p⁃CREB/CREB 蛋白表达降低(P<0.05),IL⁃17B 蛋白表达升高(P<0.05),见图5、表7。
表7 各组小鼠肺组织CFTR、IL⁃17B、PKA 蛋白表达比较(,n=12)Tab.7 Comparison of CFTR,IL⁃17B and PKA protein expressions in the lung tissue of mice in each group(,n=12)

表7 各组小鼠肺组织CFTR、IL⁃17B、PKA 蛋白表达比较(,n=12)Tab.7 Comparison of CFTR,IL⁃17B and PKA protein expressions in the lung tissue of mice in each group(,n=12)
注:与空白组比较,#P<0.05;与模型组比较,∗P<0.05;与吡非尼酮组比较,△P<0.05;与扶正化纤方高剂量组比较,▲P<0.05。
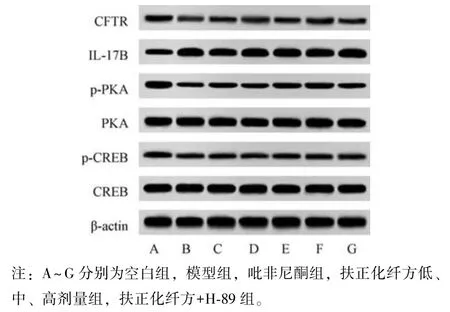
图5 各组小鼠肺组织CFTR、IL⁃17B、PKA 蛋白电泳图Fig.5 Electrophoresis of mouse pulmonary CFTR,IL⁃17B and PKA proteins of each group
3 讨论
抗纤维化药物吡非尼酮和尼达尼布可以延缓疾病的进展,但不能治愈,且与药物耐受性问题相关[12],目前特发性肺纤维化的发生率和患病率一直在上升,因此,急需寻找新的疗法[13]。中医药在改善特发性肺纤维化方面有着良好的疗效[14]。中医认为特发性肺纤维化基本病机为肺络失养、肺络不通、痰瘀等邪毒瘀滞,日久可累及肾脏,导致肾虚[15],当以通肺络、补肾脏为主要治则,兼以渗湿化瘀。扶正化纤方是用于气阴两虚、痰瘀阻证特发性肺纤维化的有效方剂,方中地龙、红景天、三七,能通达肺络;薏苡仁、茯苓、冬瓜仁,可祛除痰之所由生“湿邪”,以通肺络,均为君药。黄芪、太子参可使肺络中血运畅通,间接通肺络;麦冬、五味子,使肺络得养,共为臣药。佐以杏仁、款冬花,润肺;补骨脂、山萸肉,补肾精。炙甘草调和诸药。诸药合用可有效改善特发性肺纤维化[3]。赵国静等[16]发现,该方可能通过下调TGF⁃β1、IL⁃17A 表达减轻博来霉素诱导的小鼠肺纤维化。本研究结果显示,扶正化纤方可降低模型小鼠肺指数和HYP 水平,有效减轻肺部炎性细胞浸润和胶原纤维沉积。提示,扶正化纤方可有效改善肺纤维化。
博来霉素引起肺纤维化小鼠模型的肺部菌群失调,并触发IL⁃17B 的产生,促进肺纤维化,去除肺部菌群或IL⁃17B 的缺失可缓解博来霉素引起的肺纤维化[17]。本研究发现,模型小鼠肺组织中CFTR 表达低于正常小鼠,而IL⁃17B 表达升高,与文献报道一致[18]。CFTR 是一种由cAMP 调节的离子转运蛋白,可调节黏液的水合作用、气道上皮表面的黏度和酸度。在囊性纤维化中,CFTR 的丧失可破坏黏液纤毛清除和先天防御机制,导致黏液积聚和细菌定植,进而引起肺损伤[19⁃20]。CFTR 缺乏会导致内皮细胞持续的促炎状态,使用CFTR 调节剂(增强CFTR 或恢复细胞表面蛋白质水平降低的小分子药物)可抑制气道炎症,减轻肺损伤[21]。屈飞等[22]报道,增加大鼠肺CFTR 表达,可抑制气道黏液高分泌,改善慢性阻塞性肺疾病。本研究发现,扶正化纤方能上调模型小鼠肺中CFTR 表达,降低IL⁃17B 表达,并且表现出量效关系。
CFTR 的激活依赖于细胞内cAMP 水平的提升,cAMP 具有抗纤维化特性[4],可抑制T 细胞活化,降低IL⁃17A 水平,而这种作用可被PKA 抑制剂H⁃89 阻断[23]。PKA 为cAMP 的主要效应蛋白,CREB 是PKA 的直接下游转录因子,cAMP 刺激的基因转录是通过PKA 在Ser133 上将CREB 磷酸化来介导的[24]。本研究结果显示,扶正化纤方可升高肺纤维化小鼠肺中cAMP 水平,增加p⁃PKA/PKA 比值,而给予PKA 抑制剂H⁃89 干预后,扶正化纤方对cAMP/PKA 信号通路的激活作用被减弱,CFTR 表达降低,IL⁃17B 表达增加。提示,扶正化纤方可能激活cAMP/PKA 通路,上调CFTR表达。
