金藤清痹颗粒通过调节免疫微环境对类风湿关节炎大鼠的干预作用
2022-12-03唐今扬周彩云王鑫马芳潘峥韩淑花李斌杜丽妍程国良房定亚
唐今扬 周彩云王鑫马芳潘峥 韩淑花李斌 杜丽妍程国良 房定亚∗
(1.中国中医科学院西苑医院风湿病科, 北京100091; 2.中药制药共性技术国家重点实验室, 山东 临沂276000)
类风湿关节炎是一种累及周围关节为主的炎症性自身免疫病,影响全球0.5%~1.0%人口[1],我国大陆地区发病率为0.42%[2],是造成人群丧失劳动力和致残的主要病因之一。类风湿关节炎的发病机制涉及多种免疫活性细胞、细胞因子、炎症介质等信号传导途径的激活,是一个多因素参与、多通路累及的过程[3⁃4]。金藤清痹颗粒是中药六类新药,具有清热解毒、活血消肿、通痹止痛等功效,主治类风湿关节炎活动期,具有抗炎、止痛、解热和免疫调节作用[5]。临床研究表明,金藤清痹颗粒可以明显改善活动期类风湿关节炎患者的临床症状、体征以及各项生化指标,疗效确切[6⁃8],但其作用机制目前尚不明确。本实验拟通过注射牛Ⅱ型胶原和弗氏不完全佐剂建立胶原诱导型关节炎(CIA)大鼠模型,评价金藤清痹颗粒对类风湿关节炎的作用,并探索其对于免疫微环境的影响,从而为金藤清痹颗粒治疗类风湿关节炎提供实验基础。
1 材料与方法
1.1 动物 清洁级Wistar 大鼠,雌雄各半,9 周龄,体质量(200±20)g,购自上海杰思捷实验动物有限公司,实验动物生产许可证号SCXK(沪)2018⁃0004。大鼠饲养环境为室温20~24 ℃,普通饲料喂养,自由饮水和进食,适应性喂养7 d 后开始实验。
1.2 试剂与药物 金藤清痹颗粒(国药准字Z20123065,批号28180031,鲁南厚普制药有限公司)。弗氏不完全佐剂、苏木素(货号F5506、H9627,美 国Sigma 司);牛Ⅱ型胶原(批号20021,美 国 Chondrex公司);TRIzol(货号252250AX,北京艾德莱生物科技有限公司);HiScript Reverse Transcriptase(RNase H)、SYBR Green Master Mix(货号R101⁃01/02、Q111⁃02,南京诺唯赞生物科技股份有限公司);磷酸酶抑制剂、RIPA 裂解液(货号S1873、BP0013,上海碧云天生物技术有限公司);胞浆胞核蛋白提取试剂盒(货号KGP150,江苏凯基生物技术股份有限公司);GAPDH 抗体(货号AB⁃P⁃R 001,杭州贤至生物科技有限公司);LaminB 抗体、HRP 标记羊抗兔二抗(货号BA1228、BA1054,武汉博士德生物工程有限公司);IκBα 抗体(货号Bs⁃1287r,天津速徕生物科技有限公司);p⁃IκBα(SER32)抗体(货号2859,美国Cell Signaling Technology 公司);IKKβ 抗体(货号AF6009,美国Affinity 公司);p65抗体、TLR4抗体(货号10745⁃1⁃AP、19811⁃1⁃AP,武汉三鹰生物技术有限公司);ECL底物液(货号P1050,北京普利莱基因技术有限公司);FITC ANTI⁃RAT CD4(货号201505,美国BioLegend 公司);ANTI⁃MO/RT IL⁃17A PE(货号12⁃7177⁃81,美国Invitrogen 公司);伊红Y(水溶性)(货号71014544,国药集团化学试剂有限公司)。无水乙醇、二甲苯(货号 10009218、010023418,国药集团化学试剂有限公司)。
1.3 仪器 Scientific 8000 型CO2培养箱、ABI7500型实时荧光定量PCR仪,购自美国Thermo Fisher公司;BH2 型荧光显微镜,购自日本Olympus 公司;FACSVerse 型流式细胞仪,购自美国BD 公司;imark 酶标仪、电泳仪,购自美国Bio⁃Rad 公司。
1.4 类风湿关节炎模型建立 在无菌条件下,利用均质仪将牛Ⅱ型胶原和弗氏不完全佐剂按1∶1比例(体积比)充分乳化,形成胶原乳剂,牛Ⅱ型胶原的终质量浓度为1 mg/mL。每只大鼠于尾根部、背部多点皮内注射0.3 mL 胶原乳剂,正常组大鼠在相同部位注射等体积溶剂,建立胶原诱导型关节炎(CIA)模型,第7 天后,按照原方法于大鼠尾根部注射0.2 mL 胶原乳剂进行加强免疫1次,正常组注射等体积溶剂,共造模14 d,关节炎指数(AI)评分≥4 分视为造模成功。
1.5 分组及给药 将造模成功的大鼠随机分为模型组、甲氨蝶呤组、雷公藤多苷组及金藤清痹颗粒低、中、高剂量组,每组10只,另以10 只正常大鼠为正常组。金藤清痹颗粒低、中、高剂量组灌胃给予1.05、2.1、4.2 g/kg 金藤清痹颗粒溶液(0.9%氯化钠注射液配制),每天3 次;甲氨蝶呤组灌胃给予0.8 mg/kg 甲氨蝶呤片,每4 d 给药1次,其余时间灌胃给予等量0.9% 氯化钠注射液;雷公藤多苷组灌胃给予7.875 mg/kg 雷公藤多苷片,该剂量分3 次给予;模型组和正常组灌胃给予等量0.9% 氯化钠注射液,连续给药4 周(15~42 d)。各组存活大鼠均随机选取6 只进行后续检测。
1.6 大鼠四肢关节肿胀变化的测定 于第0、7、14、21、28、35、42 天检测各组大鼠左后肢关节肿胀足底厚度,肿胀度=[(dt-d0)/d0] ×100%,其中d0为造模前的足底厚度,dt为造模后的足底厚度。
1.7 关节炎指数 于第0、7、14、21、28、35、42 天对每只大鼠进行关节炎指数评分,标准为0分,足底厚度无关节炎;1分,轻微症状,但踝关节或腕出现红肿等现象;2分,踝关节或腕中度红肿现象;3分,整个爪包括趾(指)在内都严重红肿;4分,关节严重肿胀并伴有功能障碍。大鼠四肢分别所得的评分累加起来,即为每只大鼠的关节炎指数。
1.8 免疫组化染色检测巨噬细胞 给药4 周后(42 d),取大鼠膝关节滑膜组织,经脱水、浸蜡、包埋后切片。组织切片脱蜡后放入0.01 mol/L 枸橼酸缓冲液中,采用电陶炉加热对切片进行抗原修复,3%过氧化氢室温孵育15 min,正常山羊血清室温封闭30 min,加入一抗后4 ℃湿盒中孵育过夜,PBS 冲洗切片后滴加HRP 标记的山羊抗兔二抗,室温孵育20 min,按试剂盒说明书进行显色,复染,梯度乙醇脱水,中性树胶封片,显微镜下观察并采集图像。
1.9 流式细胞术检测Th17、Treg 细胞比例 给药4 周后(42 d),大鼠腹股沟动脉取血,Percoll 非连续性密度梯度离心法获得外周血单核细胞,加入20 ng/mL 丙二醇甲醚醋酸酯、1 μg/mL 钙离子载体、2 μmol/L 蛋白转运抑制剂,37 ℃、5% CO2培养箱孵育5 h,PBS 洗涤后重悬,加入一抗(CD4⁃FITC、CD25⁃APC)4 ℃避光孵育30 min,加入Fix/Perm Buffer 4 ℃孵育50 min,加入Perm/Wash Buffer 清洗后重悬,加入一抗(FOXP3⁃PE)4 ℃避光孵育30 min,离心后PBS 重悬,流式仪上机检测。
1.10 HE 观察膝关节滑膜组织病理变化 取“1.8”项下切片,经二甲苯和梯度乙醇脱蜡后,放入苏木素染液中染色5 min,自来水冲洗,放入1%盐酸乙醇中分化2~5 s,自来水冲洗,放入1%伊红染液中染色1 min,自来水冲洗30 s,再经梯度乙醇和二甲苯脱水,中性树胶封片,显微镜下观察。从每个高倍视野观察的炎性细胞浸润、滑膜组织增生、纤维组织增生3 个方面病理表现进行综合评判。评分标准为①炎细胞浸润,无炎性细胞浸润为0 分;少于20 个为1 分;20~50 个为2 分;大于50 个为3 分。②纤维组织增生,无纤维组织增生为0 分;平均增生少于0.2 个为1 分;0.2~0.4个为2 分;大于0.4 个为3 分。③滑膜细胞增生,滑膜细胞扁平,数量不多为0 分;滑膜细胞肿胀,密集单层排列为1 分;滑膜细胞肿胀,密集2 层排列为2 分;滑膜细胞肿胀,密集3 层以上排列为3 分。
1.11 Western blot 法检测膝关节滑膜组织TLR4、IKKβ、p⁃IκBα、IκBα、p65 蛋白表达 取大鼠膝关节滑膜组织,使用RIPA 裂解液(含蛋白酶抑制剂和磷酸酶抑制剂)裂解组织提取蛋白,BCA 试剂盒测定蛋白浓度,SDS⁃PAGE 凝胶电泳分离蛋白后转移到PVDF 膜上,经封闭液封闭后使用TLR4、IKKβ、p⁃IκBα、IκBα、p65 一抗孵育,然后使用HRP 结合二抗孵育,最后通过ECL 发光液显影并拍照。细胞核p65 蛋白以Lamin B1 为内参,其余蛋白以GAPDH 为内参,通过分析条带灰度值,计算目的蛋白相对表达量。
1.12 RT⁃qPCR 法检测膝关节滑膜组织TLR4、IKKβmRNA 表达 取大鼠膝关节滑膜组织,使用TRIzol 试剂从组织中提取总RNA,紫外分光光度计检测总RNA 浓度,将RNA 逆转录为cDNA,通过ABI 实时荧光定量PCR 仪进行RT⁃qPCR 实验,以GAPDH为内参,采用2-ΔΔCT法计算TLR4、IKKβ相对mRNA 表达。引物由北京擎科生物科技有限公司合成,TLR4 正向序列5′⁃TGGTGGCTGTGGAGAC AAAAATGAC⁃3′,反向序列5′⁃CTGAAAGGCTTGG GCTTGAATGGAG⁃3′;IKKβ正向序列5′⁃CAGAATC CTGACCTGGTCTCGC⁃3′,反向序列5′⁃CACAGTCA TCGTAGGGCAACTCATC⁃3′;GAPDH正向序列5′⁃ACAGCAACAGGGTGGTGGAC⁃3′,反向序列5′⁃TTT GAGGGTGCAGCGAACTT⁃3′。
1.13 统计学分析 通过SPSS 20.0 软件进行处理,计量资料以()表示,多组间比较采用方差分析,组间多重比较采用LSD 检验;计数资料采用卡方(χ2)检验。P<0.05 为差异有统计学意义。
2 结果
2.1 金藤清痹颗粒对CIA 大鼠左后肢肿胀的影响 如图1、表1 所示,7、14、21、28、35、42 d时,与正常组比较,模型组大鼠左后肢肿胀度增加(P<0.01);21、28 d时,与模型组比较,金藤清痹颗粒高剂量组、甲氨蝶呤组和雷公藤多苷组大鼠左后肢肿胀度降低(P<0.05,P<0.01);35、42 d时,与模型组比较,各给药组大鼠左后肢肿胀度均降低(P<0.05,P<0.01)。
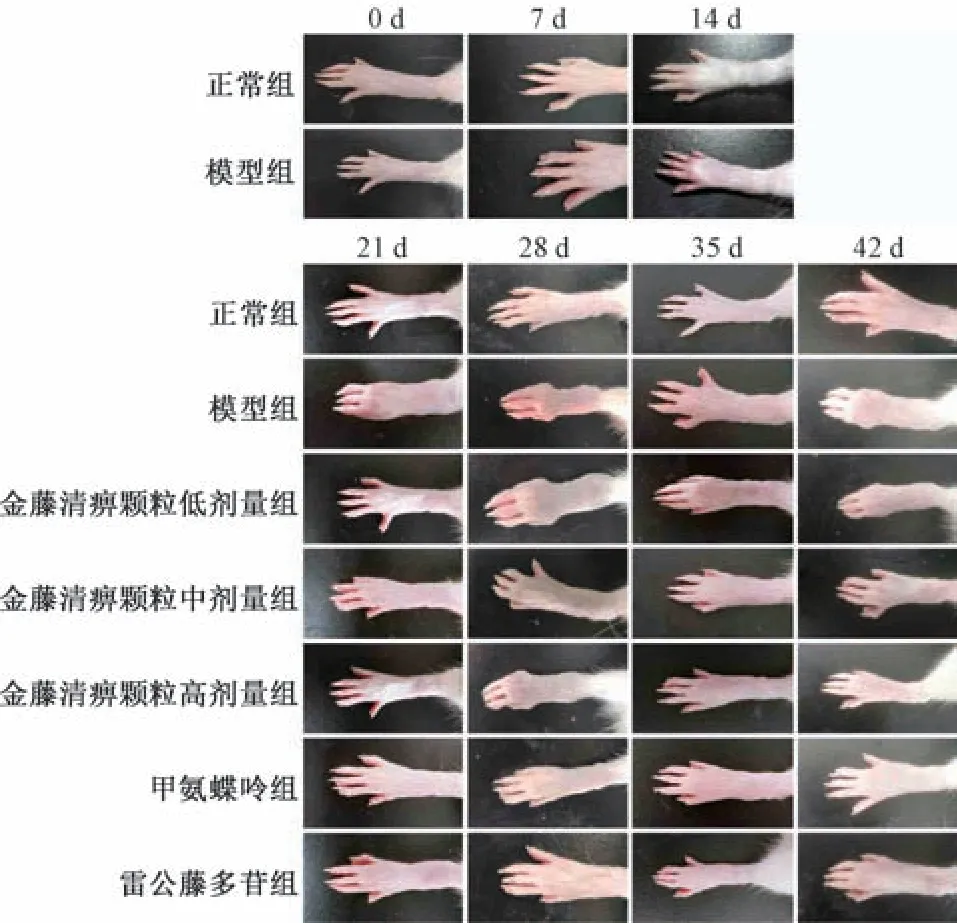
图1 各组大鼠左后肢肿胀情况Fig.1 Left hind limbs swelling in rats of each group
表1 各组大鼠左后肢肿胀度比较(%,,n=10)Tab.1 Comparison of left hind limb swelling degree in rats of each group(%,,n=10)
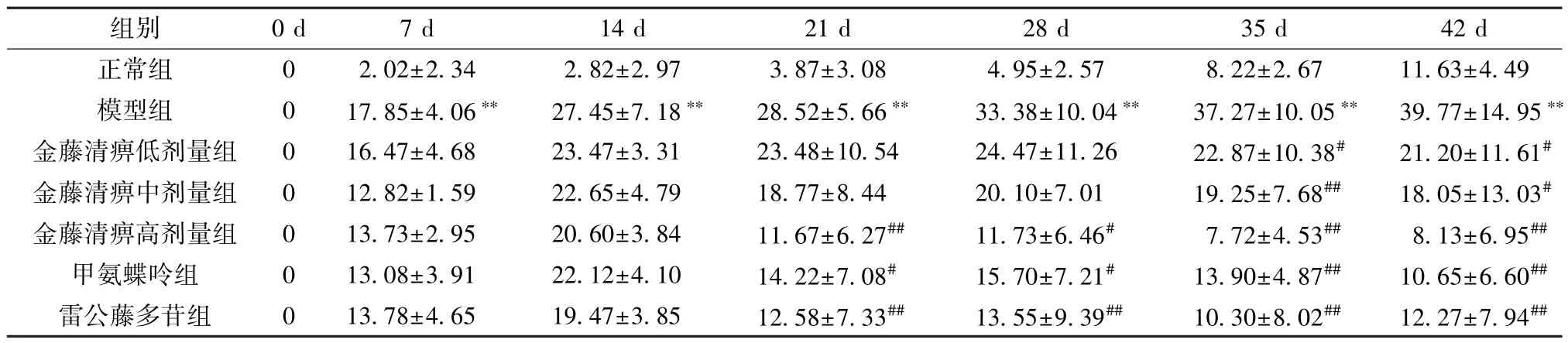
表1 各组大鼠左后肢肿胀度比较(%,,n=10)Tab.1 Comparison of left hind limb swelling degree in rats of each group(%,,n=10)
注:与正常组比较,∗∗P<0.01;与模型组比较,#P<0.05,##P<0.01。
2.2 金藤清痹颗粒对CIA 大鼠左后肢关节炎指数的影响 如表2 所示,与模型组比较,21 d时,金藤清痹颗粒高剂量组和雷公藤多苷组大鼠左后肢关节炎指数降低(P<0.05,P<0.01);28、35、42 d时,各给药组大鼠左后肢关节炎指数均降低(P<0.05,P<0.01)。
表2 各组大鼠左后肢关节炎指数比较(分,,n=10)Tab.2 Comparison of arthritis severity scale of left hind limb in rats of each group(score,,n=10)
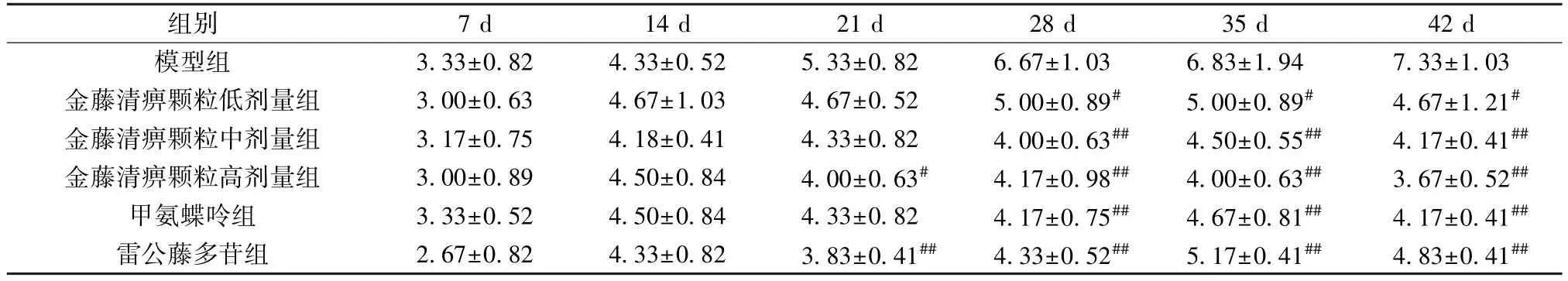
表2 各组大鼠左后肢关节炎指数比较(分,,n=10)Tab.2 Comparison of arthritis severity scale of left hind limb in rats of each group(score,,n=10)
注:与模型组比较,#P<0.05,##P<0.01。
2.3 金藤清痹颗粒对大鼠膝关节滑膜组织病理形态的影响 如图2 所示,正常组大鼠滑膜细胞无明显增生现象,未见炎性细胞浸润,无血管翳形成;与正常组比较,模型组大鼠滑膜细胞肿胀,密集排列,滑膜细胞增生明显,细胞间隙可见大量炎性细胞浸润,滑膜组织有大量血管增生;与模型组比较,金藤清痹颗粒低剂量组大鼠滑膜细胞增生有所下降,有明显血管增生和炎性细胞浸润,而金藤清痹颗粒中、高剂量组及甲氨蝶呤组、雷公藤多苷组大鼠滑膜细胞增生有较大程度下降,细胞间可见少量炎性细胞浸润,纤维组织增生不显著,滑膜组织中有少量血管增生。如表3 所示,与模型组比较,各给药组大鼠膝关节滑膜病理损伤评分均降低(P<0.01),且金藤清痹颗粒的作用呈剂量依赖性。
表3 各组大鼠膝关节滑膜病理损伤评分比较(分,,n=6)Tab.3 Comparison of pathological damage score of rat knee joint synovium of each group(score,,n=6)
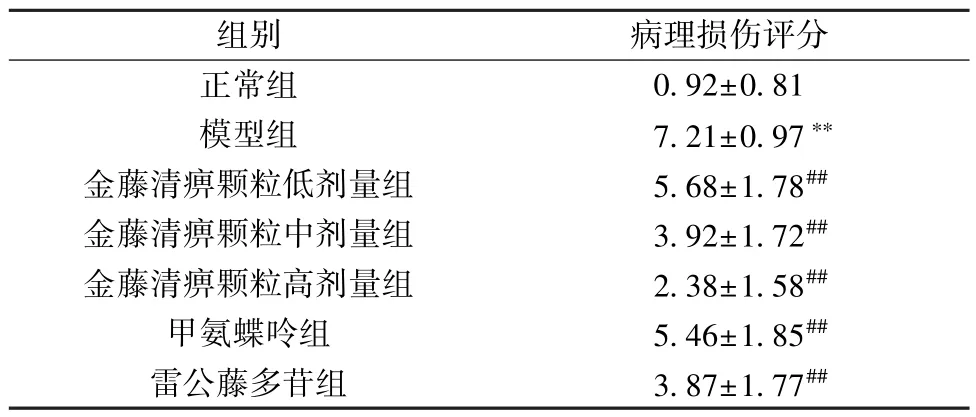
表3 各组大鼠膝关节滑膜病理损伤评分比较(分,,n=6)Tab.3 Comparison of pathological damage score of rat knee joint synovium of each group(score,,n=6)
注:与正常组比较,∗∗P<0.01;与模型组比较,##P<0.01。
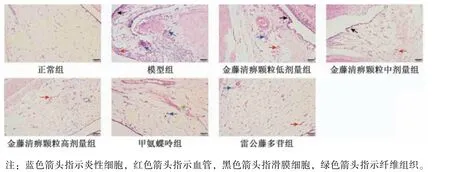
图2 各组大鼠膝关节滑膜组织病理形态(HE,×200)Fig.2 Pathological morphology of rat knee synovial tissue of each group(HE,×200)
2.4 金藤清痹颗粒对大鼠膝关节滑膜组织巨噬细胞表达的影响 CD68 为巨噬细胞表面分子,巨噬细胞分为M1 型和M2型,CD86 为M1 型巨噬细胞标记物,CD206 为M2 型巨噬细胞标记物。如图3~5、表4 所示,与正常组比较,模型组大鼠滑膜组织CD68、CD86 表达升高(P<0.01),CD206 表达降低(P<0.01);与模型组比较,各给药组大鼠滑膜组织CD68、CD86 表达降低(P<0.05,P<0.01),CD206 表达升高(P<0.01),且金藤清痹颗粒的作用呈剂量依赖性。
表4 各组大鼠滑膜组织CD68、CD86、CD206 表达比较(,n=6)Tab.4 Comparison of CD68,CD86 and CD206 expressions in rat synovial tissues of each group(,n=6)
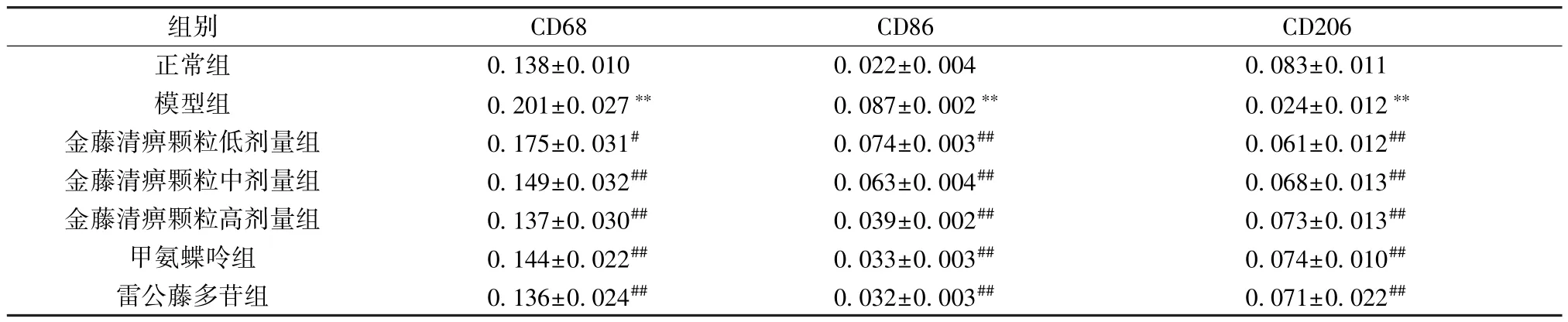
表4 各组大鼠滑膜组织CD68、CD86、CD206 表达比较(,n=6)Tab.4 Comparison of CD68,CD86 and CD206 expressions in rat synovial tissues of each group(,n=6)
注:与正常组比较,∗∗P<0.01;与模型组比较,#P<0.05,##P<0.01。
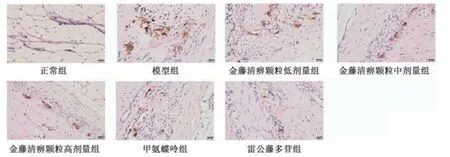
图3 各组大鼠滑膜组织CD68 免疫组化染色图(×400)Fig.3 Immunohistochemical staining of CD68 in rat synovial tissue of each group(×400)
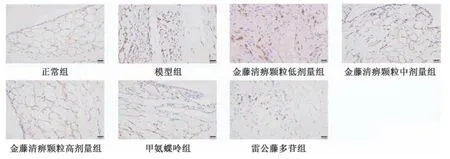
图4 各组大鼠滑膜组织CD86 免疫组化染色图(×400)Fig.4 Immunohistochemical staining of CD86 in rat synovial tissue of each group(×400)
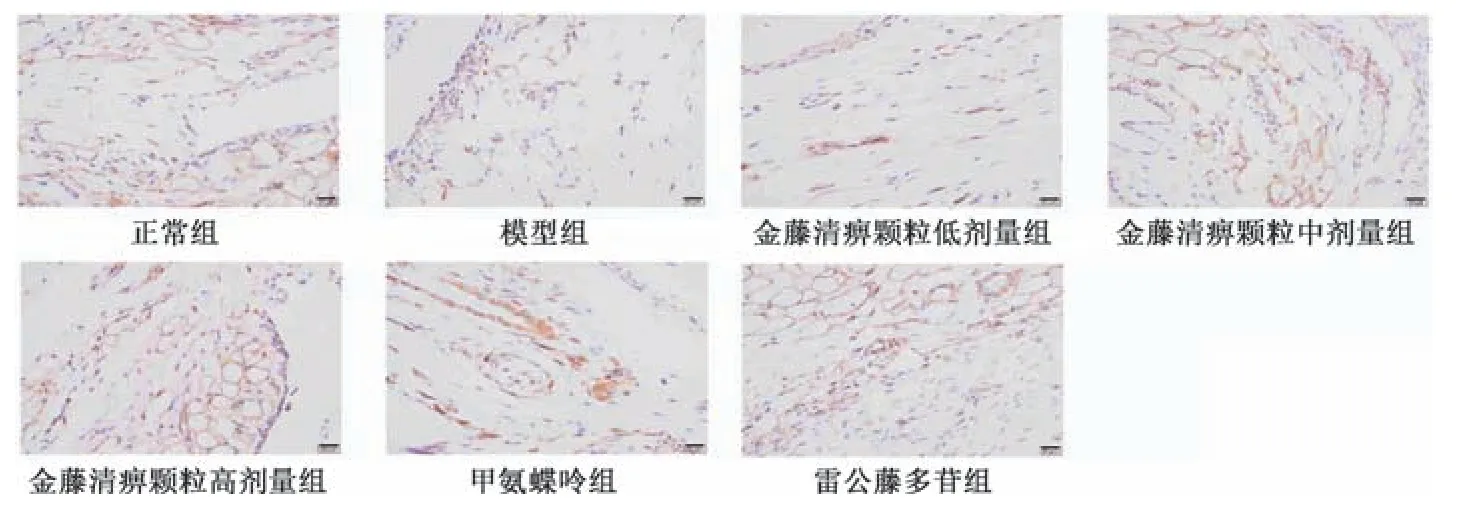
图5 各组大鼠滑膜组织CD206 免疫组化染色图(×400)Fig.5 Immunohistochemical staining of CD206 in rat synovial tissue of each group(×400)
2.5 金藤清痹颗粒对大鼠外周血Th17、Treg 细胞比例的影响 如图6~7、表5 所示,与正常组比较,模型组大鼠外周血Th17 细胞比例、Th17/Treg比例升高(P<0.01),Treg 细胞比例降低(P<0.01);与模型组比较,各给药组大鼠外周血Th17 细胞比例、Th17/Treg 比例降低(P<0.01),Treg 细胞比例升高(P<0.05,P<0.01),且金藤清痹颗粒的作用呈剂量依赖性。结果表明,造模后大鼠Th17/Treg 比例升高,促进炎症的发生;金藤清痹颗粒、甲氨蝶呤和雷公藤多苷均能改善大鼠Th17/Treg 比例,抑制炎症反应,且高剂量金藤清痹颗粒作用优于低、中剂量。
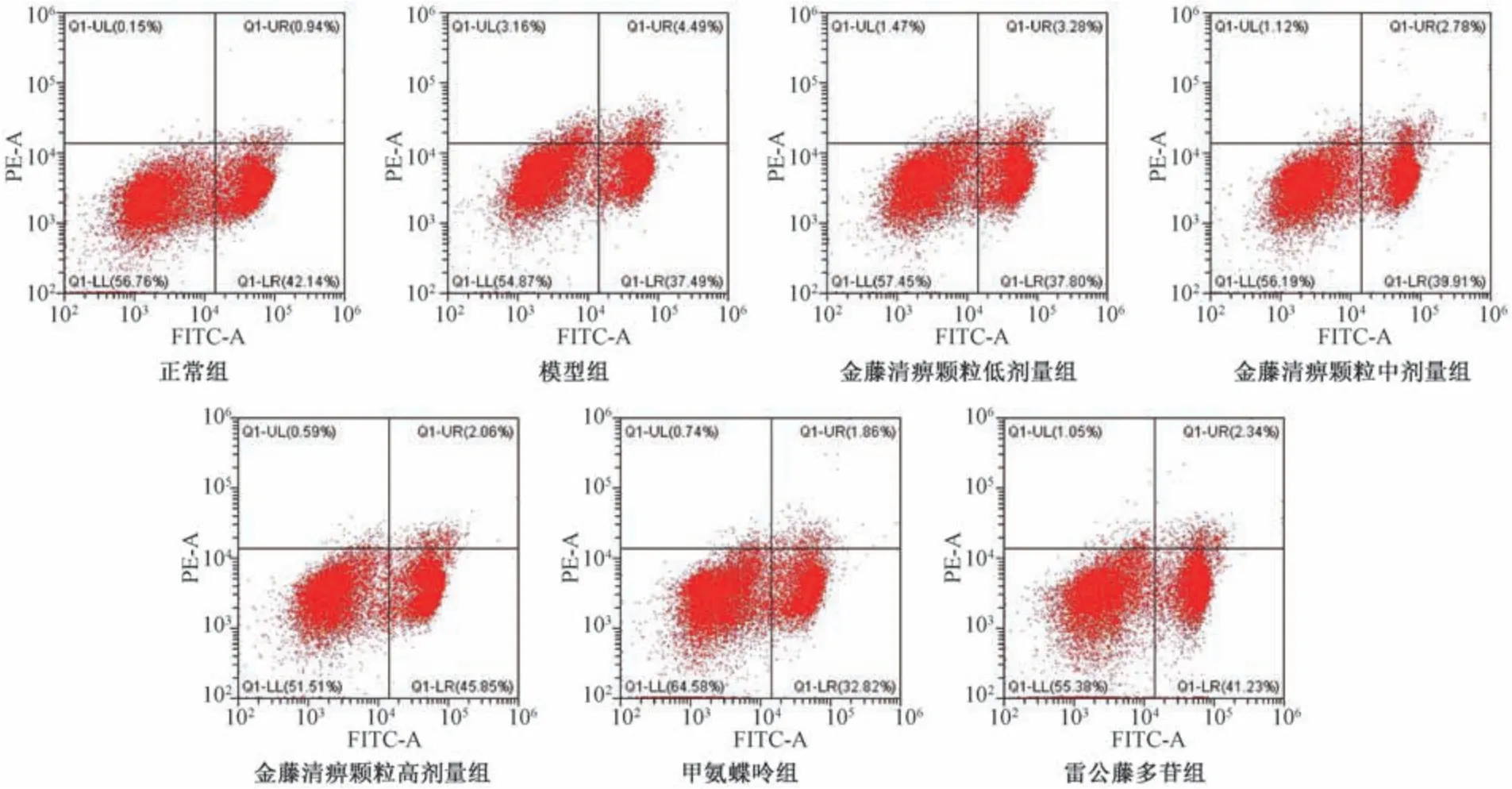
图6 各组大鼠外周血中Th17 细胞比例Fig.6 Proportions of Th17 cells in rat peripheral blood of each group
表5 各组大鼠外周血中Th17、Treg 细胞比例比较(,n=6)Tab.5 Comparison of the proportions of Th17 and Treg cells in rat peripheral blood of each group(,n=6)
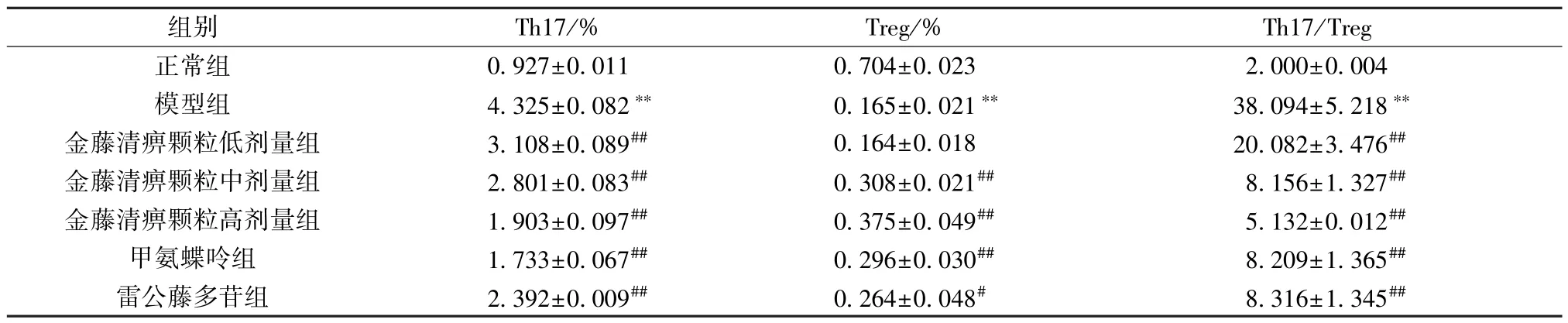
表5 各组大鼠外周血中Th17、Treg 细胞比例比较(,n=6)Tab.5 Comparison of the proportions of Th17 and Treg cells in rat peripheral blood of each group(,n=6)
注:与正常组比较,∗∗P<0.01;与模型组比较,#P<0.05,##P<0.01。
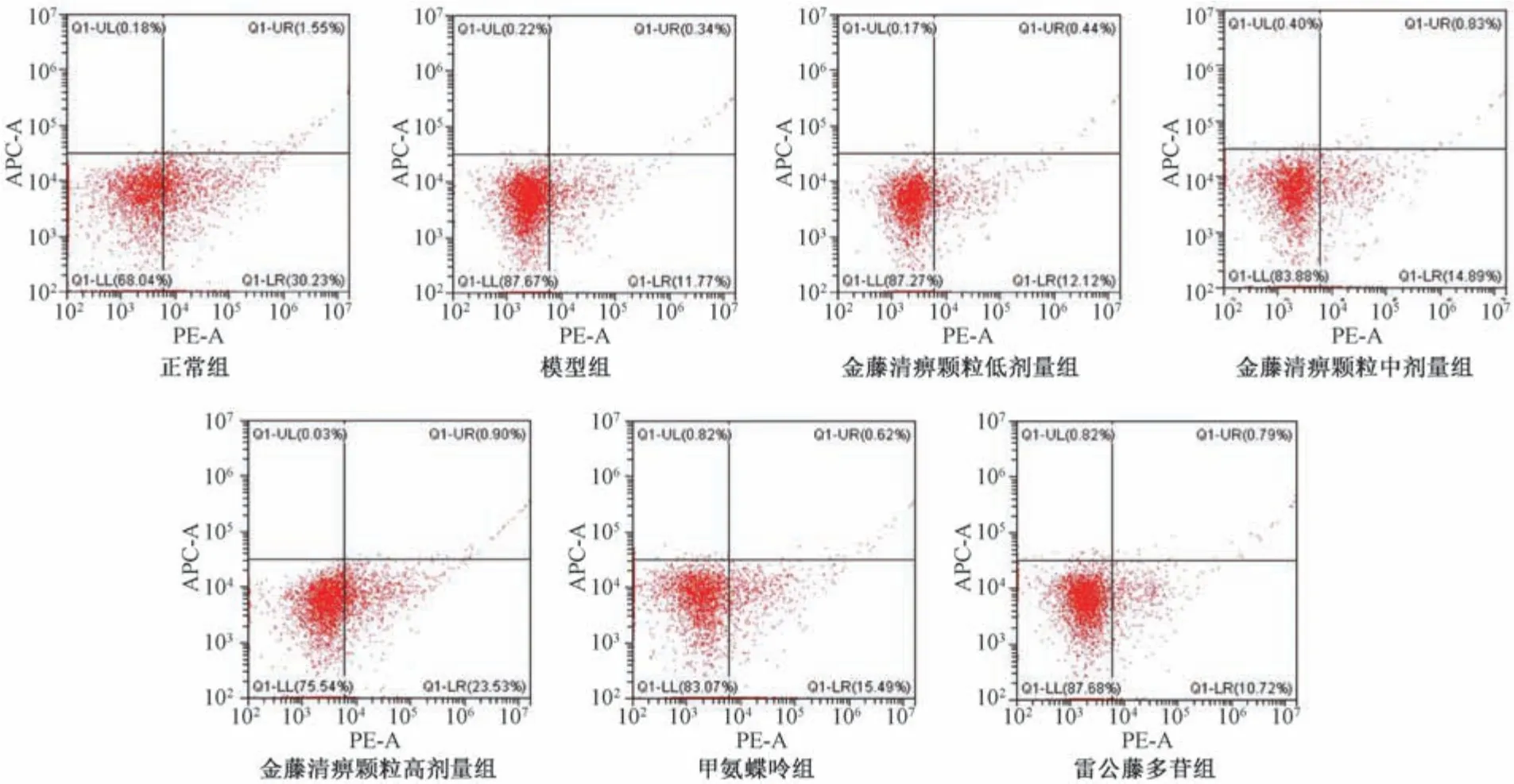
图7 各组大鼠外周血中Treg 细胞比例Fig.7 Proportions of Tregs in rat peripheral blood of each group
2.6 金藤清痹颗粒对大鼠膝关节滑膜组织TLR4/NF⁃κB 信号通路相关蛋白表达的影响 如图8 所示,与正常组比较,模型组大鼠滑膜组织中TLR4、p⁃IκBα 和细胞核p65 蛋白表达升高(P<0.01),IKKβ 和胞质p65 蛋白表达降低(P<0.01);与模型组比较,各给药组TLR4、p⁃IκBα 和细胞核p65蛋白表达降低(P<0.05,P<0.01),IKKβ 和胞质p65 蛋白表达升高(P<0.01),且金藤清痹颗粒的作用呈剂量依赖性。
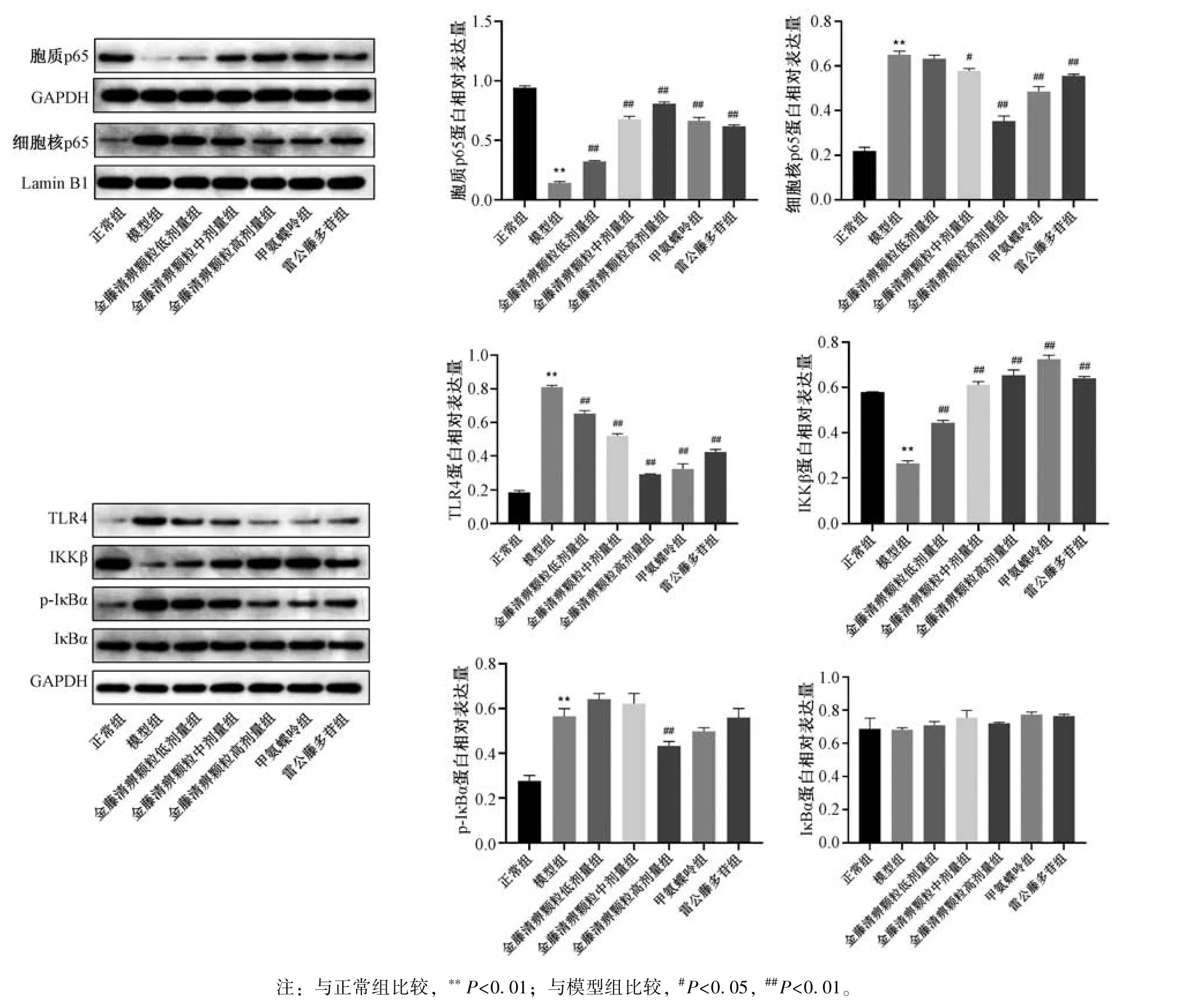
图8 各组大鼠滑膜组织TLR4/NF⁃κB 信号通路相关蛋白表达比较(,n=6)Fig.8 Comparison of TLR4/NF⁃κB signaling pathway related proteins expression in rat synovial tissues of each group(,n=6)
2.7 金藤清痹颗粒对大鼠膝关节滑膜组织TLR4、IKKβmRNA 表达的影响 如图9 所示,与正常组比较,模型组大鼠滑膜组织中TLR4 mRNA 表达升高(P<0.01),IKKβmRNA 表达降低(P<0.01);与模型组比较,各给药组TLR4 mRNA 表达降低(P<0.05,P<0.01),IKKβmRNA 表达升高(P<0.05,P<0.01)。
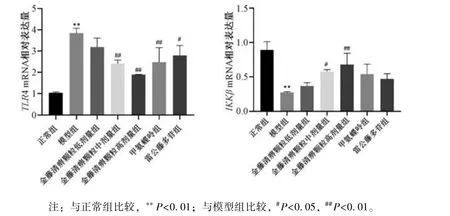
图9 各组大鼠滑膜组织TLR4、 IKKβ mRNA 表达比较(,n=6)Fig.9 Comparison of TLR4 and IKKβ mRNA expressions in rat synovial tissues of each group(,n=6)
3 讨论
类风湿关节炎的基本病理改变为滑膜细胞增生,衬里层增厚,多种炎性细胞浸润,血管形成,侵蚀软骨与骨组织,最终导致关节畸形和功能丧失[9]。Ⅱ型胶原诱导性关节炎模型是类风湿关节炎基础研究常用的经典动物模型,其关节症状和病理表现与人类的类风湿关节炎相似。本研究发现,金藤清痹颗粒和甲氨蝶呤以及雷公藤多苷均不同程度减轻了炎性细胞浸润、滑膜増生、血管新生等类风湿关节炎病理损伤。
免疫功能紊乱及免疫微环境的改变是类风湿关节炎发生发展的主要机制和重要环节。CD4+T 细胞被认为在类风湿关节炎发病过程中起着关键性的作用,它至少有4 个不同的亚群,即Th1、Th2、Th17 和Treg 细胞,其中Th1 和Th17 细胞具有促炎作用,而Th2 和Treg 细胞有抑炎作用[10⁃12]。Th17与Treg 在发育和功能上相互拮抗,Th17/Treg 之间的平衡在类风湿关节炎的发生发展中发挥重要作用[13⁃14],调控其平衡可成为防治类风湿关节炎的重要策略[15]。本研究发现,CIA 模型大鼠外周血Th17 比例升高,而Treg 比例降低;金藤清痹颗粒、甲氨蝶呤和雷公藤多苷均能降低Th17 比例并升高Treg 比例,最终降低Th17/Treg 比值。
巨噬细胞来源于骨髓的单核细胞,类风湿关节炎滑膜中下层巨噬细胞数量的增加是病情活动的早期特征,且巨噬细胞浸润程度与关节侵蚀程度密切相关,从炎症组织中清除这些巨噬细胞具有潜在的治疗作用[16]。同时,巨噬细胞分为M1 型和M2 型2类,M1 型巨噬细胞主要分泌促炎细胞因子,引起关节损伤;M2 型巨噬细胞释放抗炎细胞因子,抑制类风湿关节炎的进展[17]。研究表明,类风湿关节炎患者存在巨噬细胞活化与M1/M2 比例失衡,外周血呈现M1 和M2 混合型,而关节腔积液呈现M1 型[18]。本研究发现,CIA 模型大鼠膝关节滑膜总巨噬细胞及M1 型巨噬细胞增加,而M2 型巨噬细胞减少,M1/M2 巨噬细胞极化状态失衡;金藤清痹颗粒、甲氨蝶呤和雷公藤多苷均可以使滑膜总巨噬细胞数减少,且均能够调节巨噬细胞失衡的极化状态趋于正常。
TLR4 是一种模式识别受体,与慢性炎症、肿瘤及自身免疫性疾病密切相关,NF⁃κB 是TLR4 下游炎症信号转录因子,主要由p65 和p50 结合形成二聚体或异二聚体,具有明显的促炎活性[19⁃20]。IκBα 是IκB 家族中的一员,是NF⁃κB 的主要抑制剂。当细胞外刺激发生时,TLR4 信号通路级联反应首先激活IKB 激酶复合物,使IKB 发生磷酸化并降解,从NF⁃κB 中解离,使p65 活化并从胞质转移到细胞核中,与炎症基因相结合,启动炎症因子转录,释放促炎因子。本研究发现,金藤清痹颗粒、甲氨蝶呤和雷公藤多苷均降低TLR4、p⁃IκBα和细胞核p65 蛋白表达,升高IKKβ 和胞质p65 蛋白表达,降低TLR4 mRNA 表达,并升高IKKβmRNA 表达,说明金藤清痹颗粒能够抑制TLR4/NF⁃κB 信号通路转导,发挥抗类风湿关节炎作用。
