地西他滨联合维奈克拉与地西他滨联合CAG方案治疗老年初治急性髓系白血病的临床疗效比较
2022-12-03张诗佳许旋旋唐元艳
张诗佳, 许旋旋, 唐元艳
急性髓系白血病(acute myeloid leukemia,AML)是一种好发于老年人群的血液肿瘤,在65岁左右发病率较高,患者5年生存率不理想[1]。据报道,AML约占所有白血病的60%,老年患者由于体能状态差、合并症多及存在耐药基因等因素使其不能耐受标准诱导化疗方案[2]。地西他滨联合CAG方案(阿糖胞苷、阿克拉霉素及粒细胞集落刺激因子)是目前临床应用较为广泛的治疗AML的方案。B淋巴细胞瘤-2(B-cell lymphoma 2,Bcl-2)抑制剂维奈克拉于2018年11月21日获得美国食品药品管理局(Food and Drug Administration,FDA)批准,与去甲基化药物(hypomethylation agent,HMA)组合作为一线药物治疗75岁以上新发的或无法耐受高强度化疗的AML患者[3]。这种方案逐渐被接受并应用到临床,但与现行普遍方案的临床疗效比较尚少。鉴此,本研究选取了29例不适合强化化疗的老年初治AML患者作为观察对象,分别采用地西他滨联合维奈克拉方案和地西他滨联合CAG方案进行治疗,比较两者的疗效和安全性,为不适合强化化疗的老年初治AML患者诱导治疗方案的选择提供参考。
1 对象与方法
1.1研究对象 选择我院2016年5月至2022年2月收治的不适合接受强化化疗的老年初治AML患者29例。根据患者病情推荐治疗方案供患者选择,并依据患者的选择情况将其分为维奈克拉组(地西他滨+维奈克拉,17例)和CAG组(地西他滨+CAG方案,12例)。两组基线资料比较差异无统计学意义(P>0.05),具有可比性。见表1。
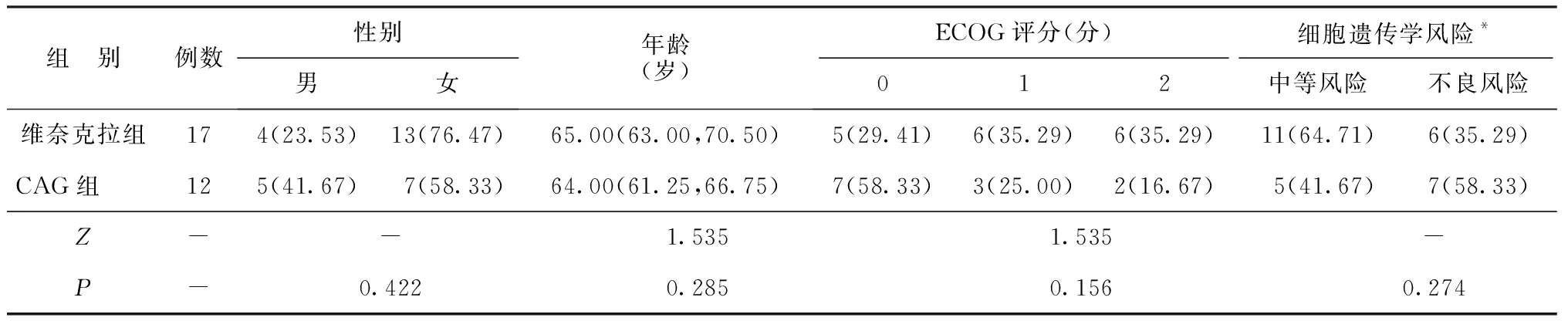
表1 两组基线资料比较[M(P25,P75),n(%)]
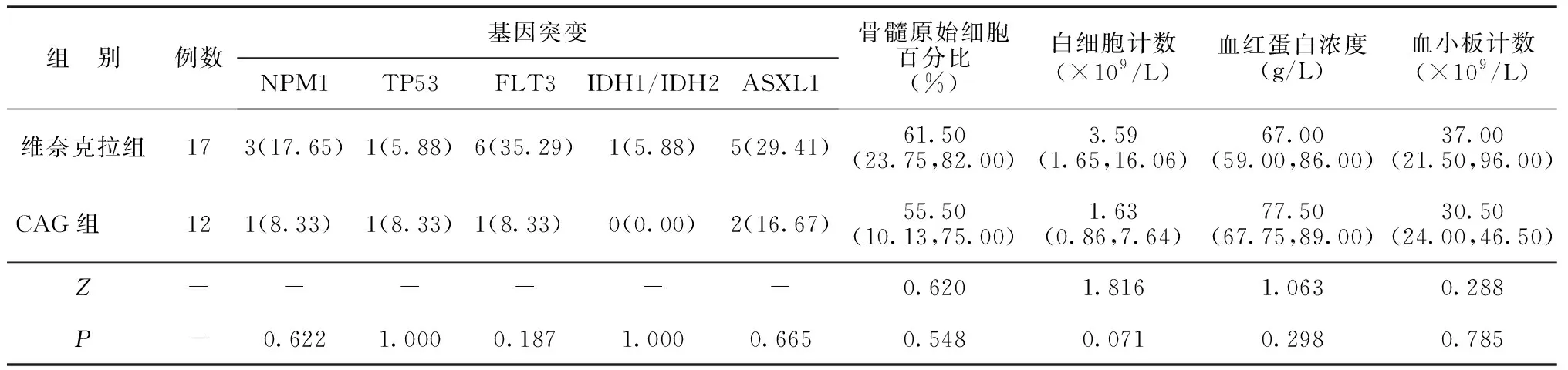
续表1
1.2纳入与排除标准 纳入标准:(1)经骨髓细胞形态学、免疫分型、细胞遗传学和分子生物学等检查明确诊断均为AML[急性早幼粒细胞白血病(M3)除外][4];(2)初治患者,年龄≥60岁;(3)患者ECOG评分为0~2分,无严重心、肝、肾等重要器官功能损害;(4)经与患者及其家属充分沟通治疗方案及其相关不良反应后,患者及家属考虑选择采用地西他滨+维奈克拉方案或地西他滨+CAG方案进行治疗,并签署化疗同意书。排除标准:(1)有严重的脏器(心、肝、肾)损伤或严重感染无法耐受化疗者;(2)合并其他肿瘤疾病者;(3)临床资料不全者。
1.3治疗方法
1.3.1 诱导治疗 (1)维奈克拉组:地西他滨(正大天晴药业集团股份有限公司,国药准字:H20120067)20 mg/(m2·d),第1~5天。维奈克拉[商品名:唯可来,艾伯维医药贸易(上海)有限公司,国药准字:HJ20200055]采用剂量爬坡的方式给药,从100 mg/d逐渐增量至400 mg/d,第1~4天,随后按400 mg/d继续口服,疗程28 d。对于伴有FLT3-ITD突变的患者,加用FLT3抑制剂索拉菲尼治疗。为避免肿瘤溶解综合征,在开始治疗前使具有高白细胞水平的患者口服羟基脲将白细胞水平降至20×109/L以下。(2)CAG组:地西他滨(正大天晴药业集团股份有限公司,国药准字:H20120067)20 mg/(m2·d),第1~5天,静脉注射。阿糖胞苷[商品名:赛德萨,辉瑞制药有限公司,国药准字:H20160403]10 mg/m2,1次/12 h,皮下注射,第3~9天。阿克拉霉素5~7 mg/(m2·d),静脉滴注,第3~6天。粒细胞集落刺激因子[齐鲁制药有限公司,药品注册证号:S19990049]300 μg/m2,皮下注射,第3~9天,外周血白细胞>20×109/L时停用。治疗期间定期检测患者血常规、肝肾功能、心功能及骨髓细胞学等指标,根据患者病情及耐受程度可适当调整药物剂量。
1.3.2 巩固治疗 经过上述方案(第1疗程)获得缓解后,继续4~6疗程巩固治疗,每月1疗程,直至复发。维奈克拉组患者采用与诱导治疗相同的化疗方案行巩固治疗;CAG组患者采用HMA,如地西他滨或阿扎胞苷行巩固治疗。若未获得缓解,则继续使用第1疗程方案进行诱导治疗,观察缓解情况。若仍未获得缓解,则改用其他方案,如异基因造血干细胞移植。
1.3.3 支持治疗 所有患者治疗过程中予以护胃、护肝、护心、止吐等治疗,定期检测血常规、肝肾功能、电解质等,同时加强患者口腔护理,并积极预防肛周感染。若患者发生感染,予以经验性抗生素治疗,对于有明确病原学依据的感染,根据药敏结果调整抗生素治疗方案。在骨髓抑制期,血红蛋白<60 g/L时,予以输注红细胞治疗;血小板<20×109/L时,予以输注血小板治疗。
1.4随访 通过门诊复查或电话的方式进行随访,每3个月随访1次,随访内容主要为疗效评价、生存状态、复发情况及不良反应发生情况。随访截至2022年2月28日。
1.5疗效评价 根据《血液病诊断及疗效标准》[5]进行疗效评价。(1)完全缓解(complete remission,CR):临床无白血病浸润的症状和体征,脱离输血,中性粒细胞绝对计数>1.0×109/L,血小板>100×109/L。(2)形态学完全缓解而血细胞计数未完全恢复(CR with incomplete blood count recovery,CRi):除仍有中性粒细胞减少(<1.0×109/L)或血小板减少(<100×109/L)外符合CR的其他标准。(3)部分缓解(partial remission,PR):临床症状、体征及血细胞计数均有所改善,骨髓原始细胞比例5%~25%,同时较治疗前下降50%以上。(4)未缓解(non-remission,NR):未达到以上标准者为未缓解。复合完全缓解率=(CR+CRi)/总数×100%。总反应率(overall response rate,ORR)=(CR+CRi+PR)/总数×100%。总生存期(overall survival,OS):自化疗开始至患者死亡或末次生存随访日。无进展生存期(progression-free survival,PFS):自开始化疗之日起至治疗失败、复发、死亡或末次随访日。
1.6不良反应评级 不良反应参照美国卫生和公共服务部发布的常见不良反应术语评定标准(common terminology criteria for adverse events,CTCAE)V5.0进行评级[6]。
1.7统计学方法 应用SPSS26.0统计软件进行数据分析。计量资料以中位数(下四分位数,上四分位数)[M(P25,P75)]表示,组间比较采用秩和检验。计数资料以例数(百分率)[n(%)]表示,组间比较采用Fisher′s确切概率法。等级资料的组间比较采用秩和检验。采用Kaplan-Meier法绘制生存曲线,以log-rank检验进行组间比较。P<0.05为差异有统计学意义。
2 结果
2.1两组疗效比较 患者随访时间为8.1~70.3个月,中位随访时间为27.7个月。29例随访的患者中,有8例存活,均为维奈克拉组,其中5例仍处于缓解阶段,行巩固治疗;3例为缓解后复发,1例患者行造血干细胞移植,另2例根据患者意愿予以对症支持治疗。19例患者死亡(其中维奈克拉组9例,CAG组10例),2例失访。维奈克拉组的CR率、CRi率、复合完全缓解率及ORR均高于CAG组,但差异无统计学意义(P>0.05)。见表2。维奈克拉组中位OS为10.73个月,CAG组中位OS为8.57个月,两组生存预后差异无统计学意义(P>0.05)。维奈克拉组中位PFS为7.93个月,CAG组中位PFS为5.77个月,两组复发情况差异无统计学意义(P>0.05)。见图1。
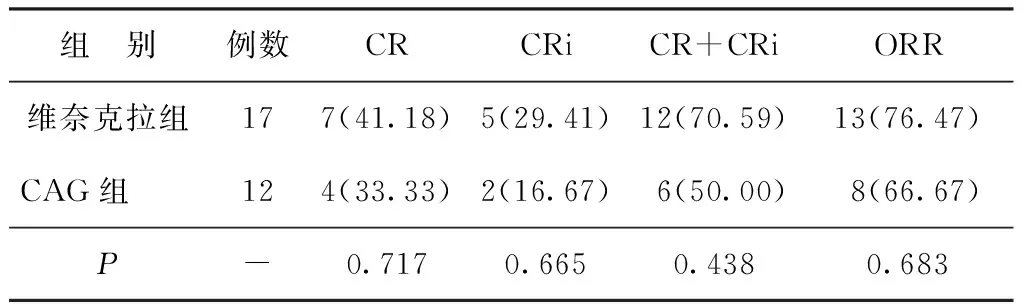
表2 两组疗效比较[n(%)]

ⓐOS生存曲线;ⓑPFS生存曲线
2.2两组不良反应发生情况比较 主要不良反应为化疗导致的骨髓抑制及其所致的感染和出血。29例中有27例(维奈克拉组16例,CAG组11例)出现了3~4级血液学不良反应。维奈克拉组和CAG组中位粒细胞缺乏时间分别为24 d和25 d,中位血小板恢复时间分别为20 d和18 d,差异均无统计学意义(P>0.05)。19例患者发生感染(维奈克拉组10例,CAG组9例),部分患者合并多部位感染,主要感染部位为肺部(维奈克拉组9例,CAG组6例),其次为皮肤软组织(维奈克拉组2例,CAG组1例)和肠道(维奈克拉组0例,CAG组2例)。8例患者发生出血(维奈克拉组2例,CAG组6例)。经对症治疗后患者均安全度过骨髓抑制阶段,无一例发生治疗相关死亡。见表3。
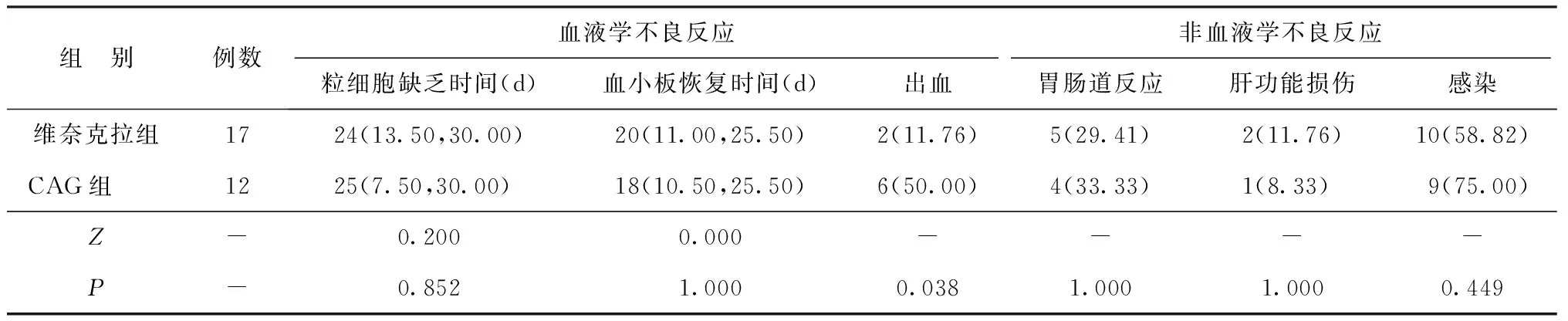
表3 两组不良反应发生情况比较[M(P25,P75),n(%)]
3 讨论
3.1因强化化疗的细胞毒性较强,老年AML患者不能耐受,因此需要寻求一种毒性较低的治疗方案。地西他滨作为一种去甲基化剂已被欧盟批准应用于AML患者。其起初被批准用于治疗骨髓增生异常综合征(myelodysplastic syndrome,MDS),表观遗传学的研究发现小剂量的地西他滨能够激活抗癌基因,诱导白血病细胞分化,且地西他滨在AML患者中显示出了单药活性,但缓解率有限[7]。虽然部分AML患者对地西他滨产生反应,但随后对HMA治疗产生耐药性几乎是不可避免的问题。Chowdhury等[8]首次采用地西他滨联合吉姆珠单抗的方案治疗12例复发难治性AML患者,CR率达42%且安全性良好。这提示地西他滨联合其他药物是安全有效的,有望提高AML的反应率并克服HMA耐药问题。
3.2采用由阿糖胞苷、阿克拉霉素及粒细胞集落刺激因子组成的CAG方案治疗复发难治AML,CR率可达83%。CAG方案的作用机制是利用粒细胞集落刺激因子诱导AML细胞的增殖、分化,使静止期的AML细胞进入细胞周期,增加细胞毒性药物对AML细胞的杀伤作用,从而提高AML的诱导缓解率[9]。临床试验显示,CAG方案在老年患者中的CR率为50%,毒性耐受性良好[10]。Qin等[11]在体外实验中发现,地西他滨在去甲基化同时能够增强细胞毒性药物的活性,体现为地西他滨联合CAG使患者缓解率进一步提高[12-14]。
3.3维奈克拉是一种抗凋亡蛋白Bcl-2的选择性小分子抑制剂。Konopleva等[15]首次报道了单药维奈克拉治疗AML,结果显示复合完全缓解率为19%,但单药应用容易出现耐药导致疾病复发。有体外实验观察到维奈克拉与HMA联合具有协同作用,其机制是HMA通过整合应激反应(intergrated stress response,ISR)途径诱导BH3-only蛋白NOXA转录,促进NOXA与抗凋亡蛋白结合,诱导AML细胞凋亡[16]。而维奈克拉能够抑制E2相关抗肿瘤因子(NF-E2-related factor 2,Nrf2)的异常激活,减少HMA在AML中诱导的Nrf2的活化,改善Nrf2介导的耐药性[17]。有2项多中心前瞻性临床试验结果显示,维奈克拉(400 mg)联合地西他滨治疗初治老年AML的复合完全缓解率达73%;IDH1/2和NPM1突变者对治疗反应较好,复合完全缓解率分别为71%和91.5%[18-19]。
3.4基于上述研究,地西他滨联合CAG方案治疗老年AML疗效得到肯定且已在临床广泛应用。维奈克拉作为近年来靶向治疗的热点,对于联合地西他滨治疗老年AML,在疗效及安全性上是否优于地西他滨联合CAG方案,国内尚鲜见相关报道。本研究结果显示,维奈克拉组的疗效、预后情况优于CAG组,但差异无统计学意义(P>0.05)。在不良反应方面,两组均发生了不同程度的骨髓抑制,未发生治疗相关的死亡。维奈克拉组的感染、出血风险低于CAG组,但差异无统计学意义(P>0.05)。这可能与本研究纳入样本量较少有关,需继续扩大样本量加以验证。非血液学不良反应主要为胃肠道反应,予以对症治疗后均好转。老年AML患者治疗效果差,生存时间较短。因此,提高老年患者的生活质量,减少患者的住院天数,增加患者陪伴家人的时间也是临床工作的重点方向。在一项Ⅱ期研究中,研究者观察到地西他滨的口服制剂获得了与静脉制剂相似的疗效,且安全性相当,近期FDA也批准了地西他滨口服制剂用于治疗AML患者,这开启了对不能耐受强化化疗AML患者的潜在高效口服疗法[地西他滨口服制剂(地西他滨/西达尿苷)+维奈克拉],这或许能使门诊化疗在未来成为可能,有助于提高患者的生存质量[20]。
综上所述,地西他滨联合维奈克拉方案和地西他滨联合CAG方案均可作为不能接受强化化疗的老年初治AML患者的有效治疗方案,安全性较好,值得临床推广应用,但仍需要更大样本量的多中心前瞻性研究对这两种方案的疗效和安全性差异情况进行验证。
