基于脑电响应分析睡眠剥夺对运动表现的影响
2022-12-02纽晓丹王保平贺晓雄池爱平
纽晓丹,肖 涛,王保平,贺晓雄,池爱平
(陕西师范大学 体育学院, 陕西 西安 710119)
在耐力运动中,增加运动负荷会挑战心血管和中枢神经系统的功能[1]。运动过程中为了有良好的运动表现,机体既需要良好的心血管系统为肌肉提供足够的代谢能量,又需要中枢神经系统的高效相互作用[2]。睡眠是中枢神经系统重要的稳态功能,在运动表现中有重要作用。研究发现在自行车运动中,与正常睡眠状态相比,4 h短期的睡眠剥夺会降低运动持续时间[3],而4.5 h短期睡眠剥夺会导致受试者提前达到疲劳状态[4]。Daaloul等[5]发现睡眠剥夺后,再进行午休30 min可提高认知结果和身体机能,故睡眠状态直接影响运动表现。
基于脑电信号(electroencephalogram,EEG)的脑功能网络分析可以了解大脑不同脑区之间的交互工作模式[6-8]。中枢神经活动的变化与大脑各区域之间功能连接和信息重组有关,而基于图论的脑功能网络拓扑分析可以定量分析信息变化情况。研究发现,全身力竭运动后受试者的皮质脊髓兴奋性被抑制,即运动诱发电位幅度降低[9]。在功能上,力竭运动后,男子运动员的躯体感觉运动区与小脑、海马旁回及额叶和小脑之间的功能连接降低[10]。文献[11]报道了16名运动员进行在跑台上进行分级运动跑步直至力竭,结果显示力竭运动后,大脑的网络效率逐渐下降,同时随着运动疲劳逐渐加深,聚类系数也呈现下降趋势。上述研究从脑功能网络层面揭示运动表现的中枢神经特征。
虽然大量研究探索了运动表现的脑功能网络特征,但目前对睡眠影响运动表现的中枢神经机制知之甚少。因此,本文通过建立睡眠剥夺模型和运动模型,使用无创脑电实验仪器,检测睡眠充足和睡眠不足状态下进行运动前后的脑功能网络特征,从大尺度脑功能网络层面揭示睡眠影响运动表现的中枢神经机制,为提升运动表现提供理论基础。
1 研究对象与方法
1.1 研究对象与分组
本研究通过招募,筛选了30名身体健康且具有一定运动能力的男性大学生作为实验对象,筛选标准:(1)视力或矫正视力正常,且为右利手;(2)受试者在24 h内无抽烟、喝酒、喝咖啡、剧烈运动或情绪波动等情况;(3)根据身体机能检测仪(GT9X-BT),受试者均睡眠质量良好,且无与睡眠相关的疾病。排除标准:(1)患有心脏病、精神病、家族病等病史;(2)睡眠质量较差。测试前告知受试者本次实验的过程与目的,并签署知情同意书,自愿参与本次实验,研究根据《赫尔辛基宣言》指导进行,参与者均签署了知情同意书,经陕西师范大学审议委员会批准 (协议代码202016002,批准日期2020年1月17日)。研究对象统计学特征见表1。
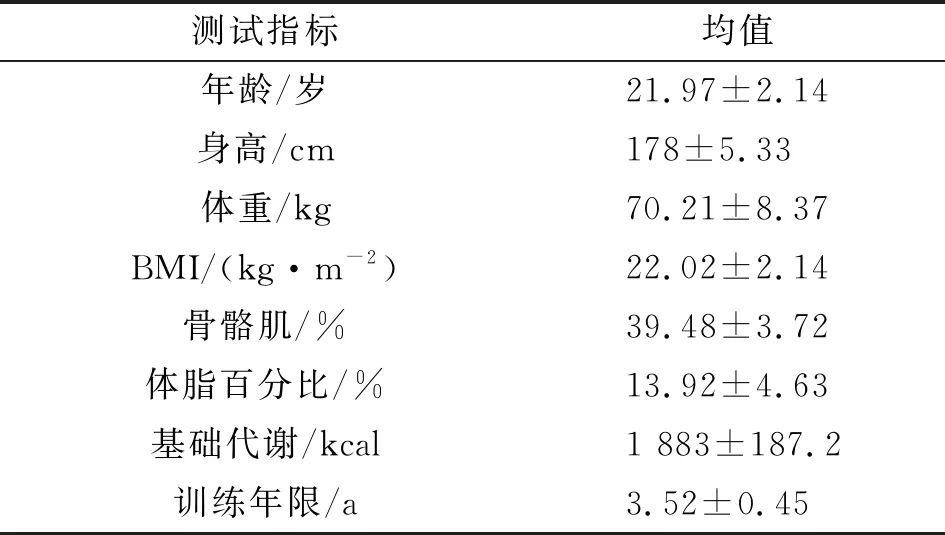
表1 研究对象统计学特征
1.2 睡眠剥夺模型的建立
依据美国睡眠基金会关于18~25岁青年人夜晚睡眠时间的推荐量(2015)[12],即:睡眠时间<4 h为重度睡眠不足,4 h≤睡眠时间<7 h为轻度睡眠不足,睡眠时间≥7 h为正常睡眠。本实验中建立的睡眠剥夺模型如下:(1) 30名实验对象在造模前保证睡眠良好,无躯体与精神方面的疲劳积累。(2) 在运动前日晚22点,佩戴人体能耗检测仪(GT9X-BT)与极性心率传感器(ActiLife),记录24 h内的睡眠时间、体力活动强度与时间,采集频率为1 000 Hz。(3) 参与者于测试前在实验室静坐休息,确保实验对象静坐期间处于清醒状态,直至凌晨3:00开始睡觉,7:00前被唤醒,保证实际睡眠时间<4 h,认定为睡眠剥夺组(sleep deprivation,SD)。(4) 正常睡眠对照组(normal control,NC)依然为同组实验对象,入睡时间为晚上10点,唤醒时间为次日晨7点,保证实际睡眠时间≥7小时。
1.3 运动方案的建立
运动方案采用Bruce 运动方案,跑台设置参数见表2。在跑台(cos10253 德国)进行运动测试。受试者在上跑台前佩戴安全保护绳索并且佩戴Polar表监测和记录动态心率,启动跑台后,受试者从第一级(速度为2.7 km/h,坡度为10%)开始运动,之后每3 min速度和坡度均会逐渐递增。在运动期间受试者佩戴便携式血压计(欧姆龙)以便记录运动中的动态血压值和心率,同时采用运动负荷主观感觉评估表(rating of perceived exertion,RPE)于每级运动末询问受试者的主观感受并记录。在其运动终止后,立刻记录运动终止时的Bruce方案等级与总运动时间。
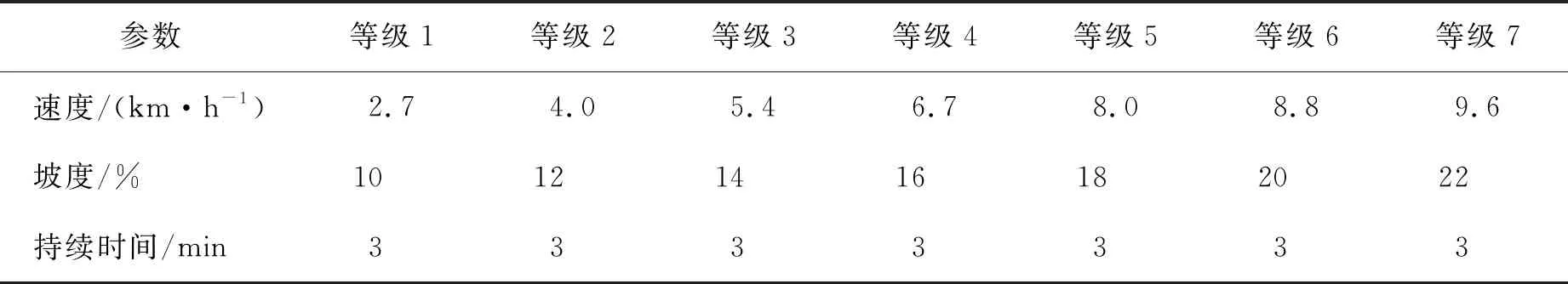
表2 Bruce方案各级别的运动负荷
运动终止的判断标准依据文献[13-14],即受试者出现以下4种情况中任意3种情况即可终止运动:(1) 行为表现,受试者表现出呼吸困难情况;(2) 血压变化,受试者收缩压(systolic blood pressure,SBP) >150 mm Hg和舒张压(diastolic blood pressure,DBP)>75 mm Hg;(3) 心率,受试者心率接近或达到本人HRmax=208-0.7×年龄[15-16];(4) RPE等级,受试者RPE值达到18~19级时,经过鼓励后仍无法继续运动。
1.4 脑电数据采集与分析
1.4.1 脑电数据采集
脑电测试过程中需保持实验室安静,实验室内的灯光、温度适宜,采集数据时受试者坐在舒适的椅子上,且禁止携带电子产品(手机、电子表等)。告知受试者测试过程中闭眼,且始终保持清醒状态;同时为了避免外界干扰,受试者测试过程中需全程佩戴耳塞与防噪耳机(3MX5A)。脑电数据的采集主要分2次进行:第一次采集受试者安静状态下基线值,采集时间为8 min,从采集的数据中选取5 min进行分析;第二次采集受试者大强度运动后的EEG数据,同第一次采集时间和选取分析时段相同。由于佩戴脑电帽在跑步机上进行大强度运动时会造成采集到的脑电数据大幅度漂移,故本研究未采集运动中的数据。
采用国际10-20系统扩展的32导电极帽的高分辨率脑电采集系统(Neuroscan)完成对2组受试者脑功能连接EEG信号的采集。脑电信号采集条件:记录在线EEG数据采用0.05~100 Hz带通滤波,采样频率为1 000 Hz/导,以双侧乳突为参考电极,前额接地;放置左眼上方和下方的电极记录垂直眼电图(electrooculography,EOG)活动,放置双眼外侧的电极记录水平EOG活动。所有电极与头皮之间阻抗都小于5 kΩ;采集前24 h内,被试不能抽烟、喝酒、服用药物、喝含咖啡因的饮料,且不能有大强度运动以及情绪波动等事件发生。
1.4.2 脑电数据预处理
使用MATLAB的EEGLAB工具箱对数据进行预处理。具体的预处理过程如下:进行带通滤波(0.5~100 Hz)和凹陷滤波(48~52 Hz),将采样率降至500 Hz,将双侧乳突(M1、M2)作为参考电极,将数据分为2 s/段;去掉漂移很大的时间段数据,并记录坏电极。采用独立主成分分析(ICA)算法校正信号中可能存在的眼电伪迹和其他伪迹信号,如肌电、心电等;观察并确定各个独立成分属性。
1.4.3脑网络构建
本研究采用相位延迟指数(phase lag index,公式中用VPLI表示)来计算电极X和电极Y的相位差。在带通滤波后对X电极和Y电极各个频段脑电进行Hilbter变换,提取各频段信号相位,计算X电极和Y电极各个频段的相应相位差,计算每个分段的PLI[17],计算公式为
|Δφn,m(t)|=|nφj(t)-mφk(t)|,
(1)
VPLI=|〈sign[Δφ(t)]〉|。
(2)
式中:φj代表频率点n的相位;φk代表频率点m的相位;Δφ(t)代表两个通道之间的瞬时相位差。sign为符号函数;〈 〉代表求均值;VPLI的取值范围是[0,1],1表示完全相位同步,0表示无相位同步。
1.4.4 图论分析
根据生成的PLI网络矩阵,进一步计算网络特征。PLI矩阵代表功能节点之间的连接状态,使用连续的稀疏阈值T将PLI矩阵转化为相应的二进制矩阵。将步长确定为0.02,0.1≤T≤0.6。每个波段共获得36个稀疏度逐步增加的脑功能网络集。图论分析中经常使用聚类系数、特征路径长度、全局和局部效率来量化网络的特征[18-19]。
(1)聚类系数是复杂网络中的局部特征,反映脑网络中各节点的密集程度。
(3)
式中:Ci是一个节点的聚类系数;aij、aih、ajh表示节点i、j和h之间的连接情况(如有连接边,其值取1,否则取0);ki是一个节点的连接度。
(2)特征路径长度定义为
(4)
式中:N为节点连接网络中所有节点的集合;n为网络中节点数;dij表示节点i和j之间的最短路径。
(3)局部效率EL可以用来衡量局部信息的传输能力,定义为
(5)
式中:EL,i是节点i的局部效率;djh(Ni)是节点j和h经过节点i的所有路径中的最短路径。
(4)全局效率Eg是衡量复杂网络中信息传递速度的重要指标,定义为
(6)
式中:Ei表征一个节点的全局效率;dij表示节点间的最短路径。
1.5 数据统计方法
使用SPSS 26.0软件进行分析,采用Shapiro-Wilk检验每组数据是否符合正态分布。不符合正态分布的数据采用非参数检验,符合正态分布的数据采用参数检验。采用非参数检验中的Welcoxon-test对受试者统计学特征和运动模型的评估进行分析。以睡眠为组间变量(睡眠充足组、睡眠剥夺组),以运动(运动前、运动后)和频段(δ、θ、α1、α2、β1和β2)为组内变量对网络拓扑属性聚类系数、特征路径长度、全局效率和局部效率进行三因素混合方差分析。所有重复测量方差分析使用Mauchly’s球形假设检验来判断是否符合球形假设,对不满足球形检验的采用Greenhouse-Geisser方法进行校正,事后配对比较采用Bonferroni法进行校正。数据结果以“均值±标准差”的形式表示,将P<0.05作为具有显著性差异的标准。
2 结果
2.1 运动模型的评估
依据美国睡眠基金会关于18~25岁青年人夜晚睡眠时间的推荐量(2015)[12],本实验通过记录测试受试者夜晚实际睡眠时间,将睡眠时间<4 h确定为判断睡眠剥夺造模是否成功的主要条件。将呼吸困难、血压明显升高、最大心率达到180次/min以上、运动中的RPE等级达到18级等4项条目作为运动终止的筛选条件;将运动开始至运动终止的时间作为评价测试者运动成绩的依据。实验结果如表3所示。

表3 运动模型的评估结果(n=30)
表3结果显示,睡眠剥夺后,实验对象的睡眠时间均不足4 h,说明睡眠剥夺模型建模成功,而正常睡眠组的睡眠时间均≥7 h,符合“美国睡眠基金会关于青年人夜晚正常睡眠时间”的推荐量。按照运动终止的标准,在睡眠剥夺和睡眠充足两种情况下,实验对象在运动末期均感到呼吸困难、心率达到180次/min以上、RPE等级达到18级以上,而且实验对象运动末的收缩压与舒张压平均值均超过150 mmHg和75 mmHg。上述结果证实测试者均符合运动终止条件。与睡眠充足组相比较,实验对象在睡眠剥夺的情况下,其运动持续时间显著降低(P<0.01),表明睡眠剥夺会使实验对象的运动成绩明显降低。
2.2 脑功能网络构建
图1为两组受试者运动前的平均PLI连接矩阵图,图2为两组受试者运动后的平均PLI连接矩阵图。根据PLI矩阵,可以进一步计算脑功能网络的特征参数。
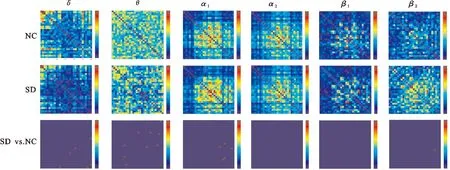
NC:睡眠充足组;SD:睡眠剥夺组;SD vs. NC:两组的差异。
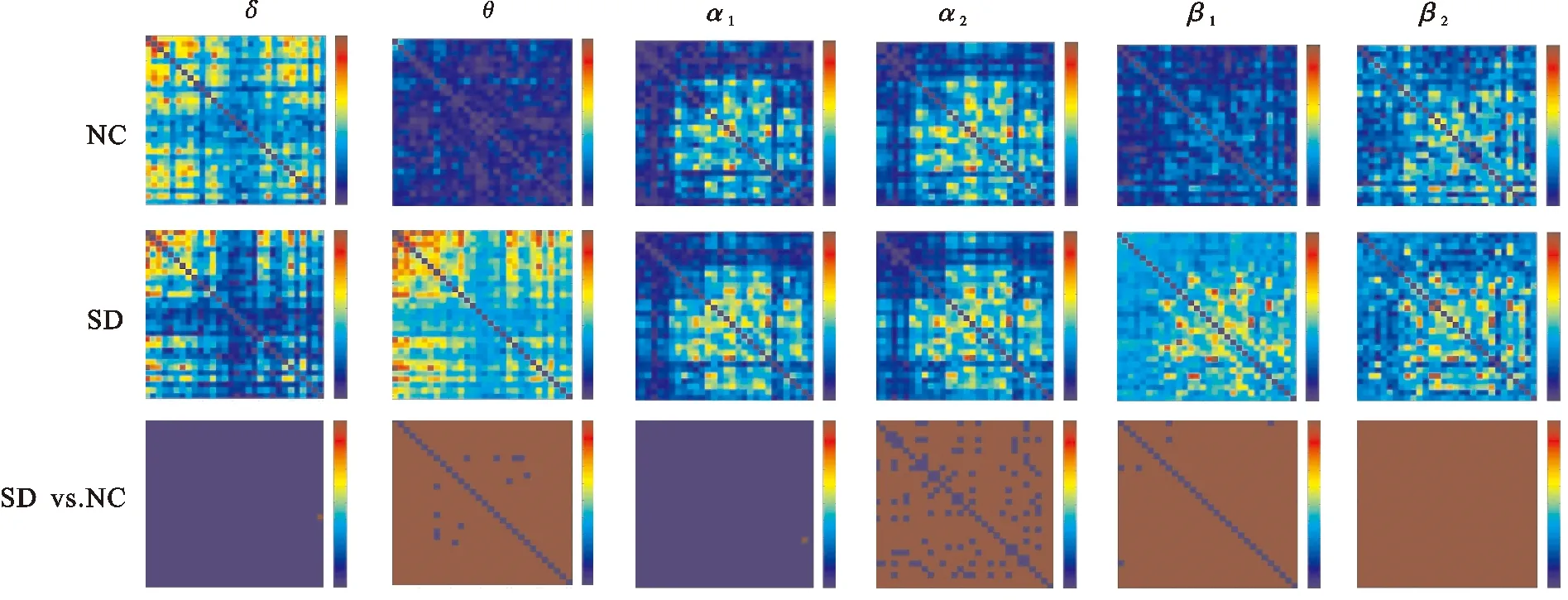
NC:睡眠充足组;SD:睡眠剥夺组;SD vs. NC:两组的差异。
2.3 聚类系数
对聚类系数进行2(睡眠)×2(运动)×6(频段)的三因素重复测量方差分析,结果见表4。结果显示睡眠、运动与频段三者之间的交互作用显著(F(5,145)=4.54,P<0.01,η2=0.14)。简单效应分析发现,在δ频段运动前睡眠剥夺组比睡眠充足组的上聚类系数显著降低(P<0.05),而在其余5个频段上均未发现任何显著差异(P>0.05)。运动后,在δ、θ和α1频段上睡眠剥夺组比睡眠充足组聚类系数显著升高(P<0.001或P<0.05),而在其余3个频段上均未发现任何显著差异(P>0.05)。

表4 不同频段上Cp的统计结果
2.4 特征路径长度
对特征路径长度进行2(睡眠)×2(运动)×6(频段)的三因素重复测量方差分析,结果见表5。结果发现,睡眠、运动与频段三者之间的交互作用显著(F(3.25, 94.36)=8.68,P<0.001,η2=0.23)。简单效应分析发现,运动前睡眠剥夺组比睡眠充足组在θ频段上特征路径长度显著降低(P<0.05),而在其余5个频段上均未发现任何显著差异。运动后睡眠剥夺组比睡眠充足组在δ和θ频段上特征路径长度显著升高(P<0.001),而在α1频段上的特征路径长度显著降低(P<0.05),在其余3个频段上均未发现任何显著差异。
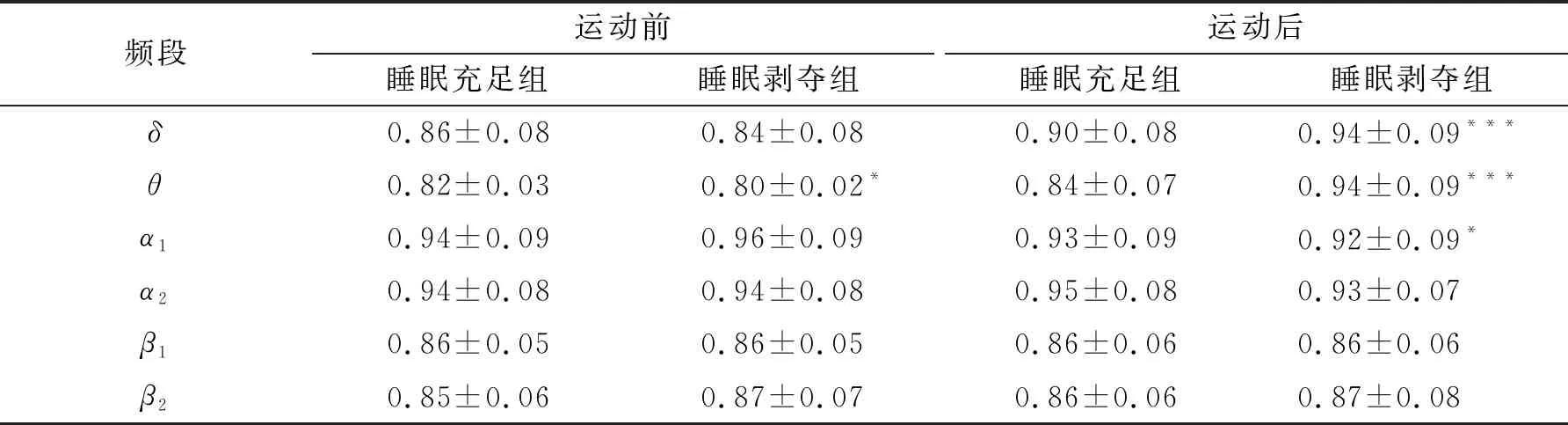
表5 不同频段上Lp的统计结果
2.5 全局效率
对全局效率进行2(睡眠)×2(运动)×6(频段)的三因素重复测量方差分析,结果见表6。结果显示,睡眠、运动与频段三者之间的交互作用显著(F(3.06, 88.85)=9.50,P<0.001,η2=0.25)。简单效应分析发现,运动前睡眠剥夺组比睡眠充足组在θ频段上全局效率显著降低(P<0.001),而在其余5个频段上均未发现任何显著差异。运动后睡眠剥夺组比睡眠充足组在δ、θ和α1频段上全局效率显著降低(P<0.001或P<0.05),而在其余3个频段上均未发现任何显著差异。
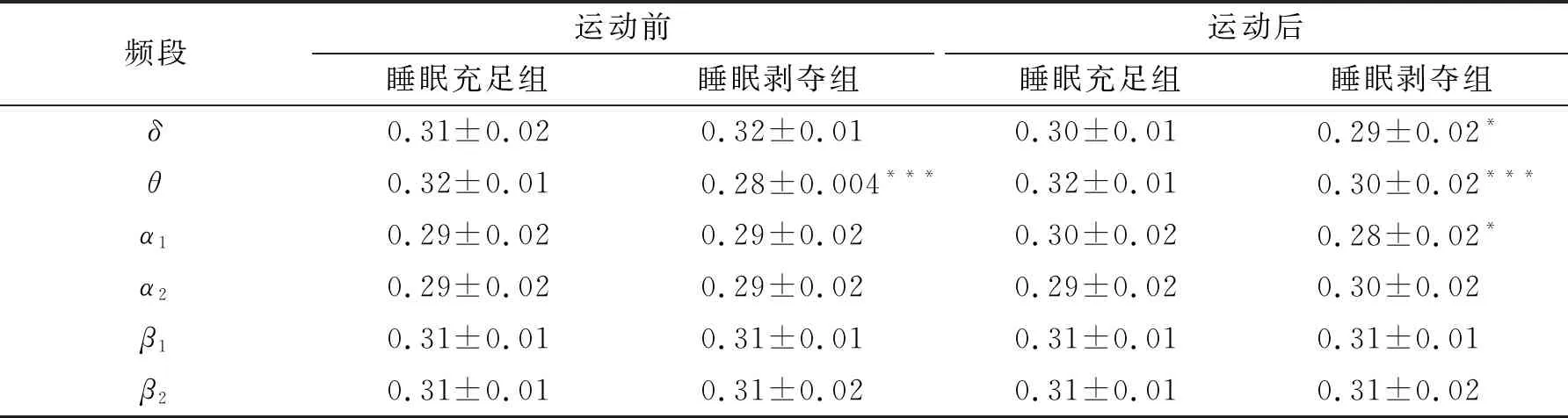
表6 不同频段上全局效率的统计结果
2.6 局部效率
对局部效率进行2(睡眠)×2(运动)×6(频段)的三因素重复测量方差分析,结果见表7。统计分析结果显示,睡眠、运动与频段三者之间的交互作用显著(F(5, 145)=2.73,P<0.05,η2=0.09)。简单效应分析发现,运动前睡眠剥夺组比睡眠充足组在6个频段上均未发现任何显著差异。运动后睡眠剥夺组比睡眠充足组在δ、θ和α1频段上局部效率显著升高(P<0.05),而在其余3个频段上均未发现任何显著差异。
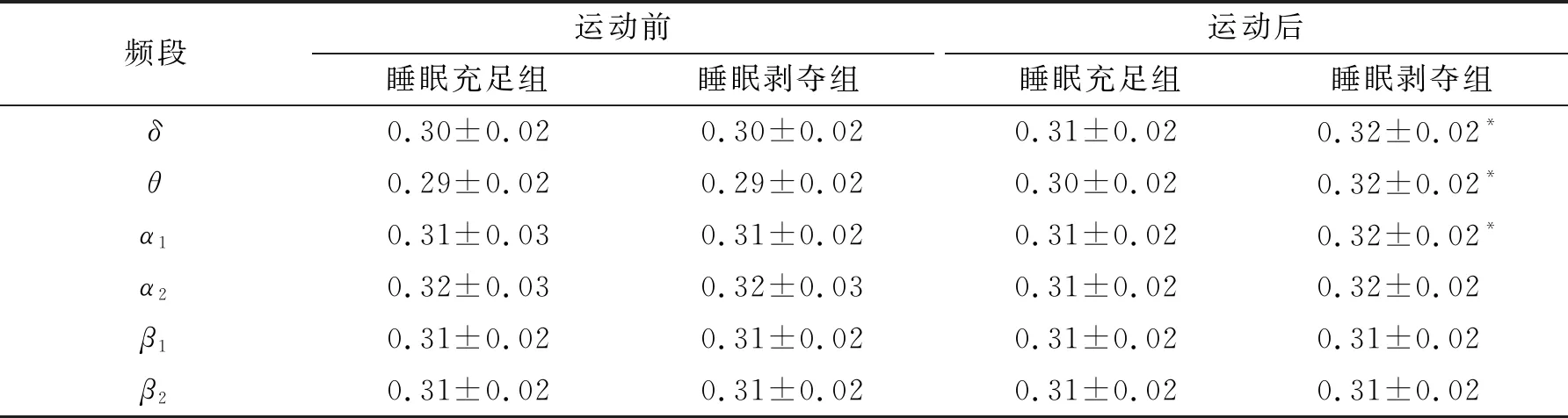
表7 不同频段上局部效率的统计结果
3 讨论
与正常睡眠状态相比,总体睡眠剥夺会导致耐力运动员的运动表现受损10%[20]。睡眠剥夺时间越长,运动期间的最大摄氧量以及运动表现显著性降低[21]。本研究显示睡眠剥夺后受试者的HRmax逐渐增加,呼吸困难、收缩压与舒张压也随之增加;同时睡眠剥夺后,受试者的运动时间逐渐减少,运动成绩显著降低,进一步证明了睡眠剥夺会影响运动表现。
脑网络分析的基本思想是利用图论来确定脑网络拓扑特性。在脑功能网络中,特征路径长度和全局效率反映了信息在网络的整体传输能力;而聚类系数与局部效率从网络局部的角度刻画了信息传递与处理的快慢[22]。本研究显示:受试者在睡眠剥夺后,δ频段的聚类系数降低和θ频段的路径长度和全局效率降低。δ频段为 1~3 Hz 的脑电波,多出现在颞叶和枕叶,与睡眠品质好坏有直接关联[23];θ频段为 4~7 Hz的脑电波,与脑部边缘系统有明显直接的关系,与记忆功能有关。并且中央额区的θ频段被认为与思维活动和集中程度等相关[24]。上述结果表明睡眠剥夺后,大脑信息传输量减少、传输效率降低,这些变化是由于睡眠剥夺导致中枢疲劳的表现。有研究采用EEG记录正常睡眠和睡眠剥夺40 h后5 min的脑电数据,β频段的特征路径长度和聚类系数下降表明睡眠剥夺会影响脑区不同的认知过程[25]。杨柳[26]选取37名受试者进行2次40 h睡眠剥夺和正常睡眠,采用自身前后对照实验发现:在δ频段上的聚类系数和特征路径长度在睡眠剥夺后升高,而全局效率呈现相反的变化;在α频段上的聚类系数、局部效率和全局效率均降低,特征路径长度升高。本研究未发现频段β和α的改变,可能与睡眠剥夺时长较短有关。
本研究发现,力竭运动后睡眠剥夺组的脑功能网络特征参数在δ、θ和α频段发生改变。δ和θ频段上的聚类系数、特征路径长度和局部效率呈现升高趋势,全局效率降低;α1频段的聚类系数和局部效率升高,特征路径长度和局部效率降低。由θ频段上全局效率降低的特征,可以认为大强度的力竭运动会严重降低脑功能网络效率。Porter等[27]报道了在极限运动强度下完成数学任务的工作,发现θ频段上节点的度在右额叶和左额叶区域增加,而在中额叶区域显著降低,但是随着任务变得更加困难时,θ频段上的度和聚类系数降低,表明极限运动强度会造成大脑认知能力丧失,这与本文结果一致。
综上所述,睡眠剥夺和运动均会对脑功能网络产生影响,在睡眠剥夺状态下,力竭运动会导致聚类系数更低,特征路径长度更短,全局效率降低,大脑整合信息的能力进一步减弱。
4 结论
本文利用PLI构建了受试者在睡眠剥夺状态下和睡眠充足状态下进行运动前后的脑功能网络。结果表明:睡眠剥夺和运动均会对脑功能网络指标产生影响,睡眠不足会加剧降低运动中大脑的工作效率与传递信息速度,进而影响受试者的运动表现。
