食管鳞状细胞癌中HIF-1α、CTSD表达和血管生成拟态的关系及其临床意义
2022-12-02徐林生
徐林生
(武汉市黄陂区人民医院,江汉大学附属黄陂区人民医院,湖北 武汉 430300)
食管鳞状细胞癌(esophagealsquamouscellcarcinoma,ESCC) 是近年来临床上发病率持续升高的一种疾病。在发生该疾病的期间,肿瘤血管生成会为肿瘤的转移、复发提供一定的基础[1]。血管生成理论认为,当实体肿瘤直径大于2 mm 时需要诱导生成新的血管来获取血供,否则肿瘤就会因为缺血缺氧发生坏死。肿瘤诱导的血管生成主要步骤包括:肿瘤经过无血管的缓慢生长期后( 指体积小于2 mm 时期),便释放多种血管生成因子,引起血管内皮细胞形态改变,基底膜及周围的细胞外基质降解,内皮细胞迁移、增殖,血管形成、改建。目前抗血管生成已经成为肿瘤治疗的一种新手段。在1999 年有学者根据对人眼葡萄膜黑色素瘤微循环的研究,首次提出了一种与经典肿瘤血管生成途径不同,不依赖机体内皮细胞的全新肿瘤微循环模式,即血管生成拟态(vasculogenic mimicry,VM) 的概念。血管生成拟态是一种肿瘤细胞供血模式,在形成血管生成拟态时会有多种因子参与,比如血管内皮生长因子(VEGF)、缺氧诱导因子-1α(HIF-1α) 等[2]。组织蛋白酶D(cathepsinD,CTSD) 是一种天门冬氨酸水解酶,它的作用是降解细胞基膜、降解细胞外基质等,它在肿瘤发生、发展期间起到了非常重要的作用[3]。此次我院对食管鳞状细胞癌中HIF-1α、CTSD 表达和血管生成拟态的关系进行了研究,发现HIF-1α 与CTSD 表达存在一定的关系,CTSD 表达和血管生成拟态也存在一定的关系,现报道如下。
1 资料与方法
1.1 一般资料
选取2016 年2 月至2018 年2 月我院收治的食管鳞状细胞癌患者130 例,对患者的HIF-1α、CTSD 表达水平进行检测与分析。主要是收集了在我院进行食管鳞状细胞癌手术切除标本的患者130 例,选取标准:1)患者在术前接受了活检,无相关家族病史;2)均是在我院接受食管鳞状细胞癌手术切除的患者;3)术后经病理诊断确诊为食管鳞状细胞癌;4)年龄均在40 ~80 岁之间;5)肿瘤无远处转移;6)术前未进行过放化疗;7)随访患者死于食管癌或者是相关疾病;8)患者均知晓同意此次研究。排除标准:1)术前接受放化疗治疗的患者;2)精神异常的患者;3)合并有其他恶性肿瘤的患者;4)术后病理未确诊为食管癌;5)蜡块保存不完整;6)随访资料不完整。130 例患者中有男88 例,女42 例;年龄43 ~78 岁,平均年龄(67.4±4.1)岁;肿瘤分化程度:低分化27 例,中分化65 例,高分化38 例。肿瘤浸润程度:浸润至深肌层及外膜层55 例,浸润至黏膜层及浅肌层75 例。淋巴结转移情况:无转移80 例,转移50 例。病理分级:共3 级,光镜检查下特征为:Ⅰ级:存在明显的癌珠或者是角化;Ⅱ级:存在少许癌珠或者是角化,形状为多角形、圆形、卵圆形,最常见的为核分裂;Ⅲ级:无癌珠或者是角化,癌细胞为规则形、卵圆形、索形,索形较少,最常见的为核分裂。Ⅰ级为高分化,Ⅱ级为中分化,Ⅲ级为低分化。其中Ⅰ级34 例、Ⅱ级56 例、Ⅲ级40 例。肿瘤分期:Ⅰ期26 例,Ⅱ期47 例,Ⅲ期57 例。无脉管癌栓形成72 例,脉管癌栓形成58 例,经过病理检查排除肿瘤累及。研究在我院伦理委员会得到了批准。
1.2 方法
1.2.1 试剂HIF-1α、CTSD、鼠抗人单克隆抗体CD34(北京中杉金桥公司生产),PAS 染色试剂盒(上海贝索生物公司生产),二抗试剂盒、DAB 显色试剂盒(福州迈新公司生产)[4]。
1.2.2 免疫组化方法 选取我院2016 年2 月至2018 年2月手术切除的食管癌标本,对新鲜食管鳞状细胞癌切除标本进行固定(10% 中性福尔马林),采用常规石蜡对组织进行包埋,对组织进行连续切片(4μm 厚),常规对其进行烘烤、蜡脱水、抗原修复,后严格按照试剂盒说明书对食管鳞状细胞癌组织中的HIF-1α、CTSD 表达情况进行检测,将已知阳性切片作为参考,PBS 代替一抗作为阴性对照[5]。具体的免疫组化图片见图1、图2、图3、图4。
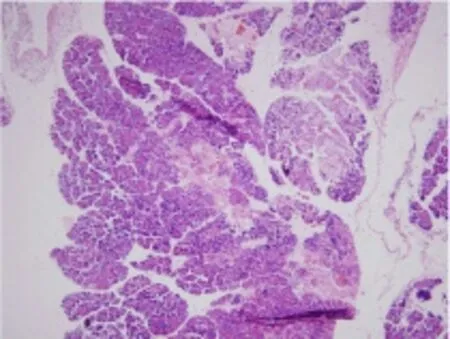
图2 免疫组化组织中存在角化珠(标尺:4 倍)

图3 免疫组化组织中存在血管生成拟态现象(标尺:20 倍)
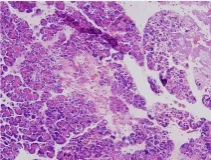
图4 免疫组化组织中存在胞浆内阳性表达(标尺:40 倍)
1.2.3 CD34、PAS 染色应用免疫组化法 对CD34 进行染色,并进行DAB 显色。按照PAS 试剂盒说明书依次加入1 滴0.5% 的高碘酸,对其进行还原,时间为10min ;后应用水流对其进行冲洗10min,之后将切片放置到避光湿盒内,再加入1 滴Schiff 试剂,将其放到37℃温箱中孵育20min。待组织变成红色后使用蒸馏水对其进行冲洗20min,后加入1 滴Mayer 苏木精染液对细胞核复染2min,再使用温水对其返蓝1min 后进行脱水、封固[6]。
1.2.4 结果分析免疫组化染色后CTSD 阳性信号主要存在于细胞质,HIF-1α 阳性信号主要存在于细胞核[7]。按照阳性染色强度判断标准对其进行评估:0 分:阴性;1 分:淡黄色;2 分:深黄色;3 分:棕色。按照阳性细胞 数 评 估:0 分:≤10%;1 分:11% ~30% ;2 分:31% ~69%;3 分:≥70%。阳性:两项乘积≥3 分;阴性:两项乘积<3 分[8]。具体见图5、图6。
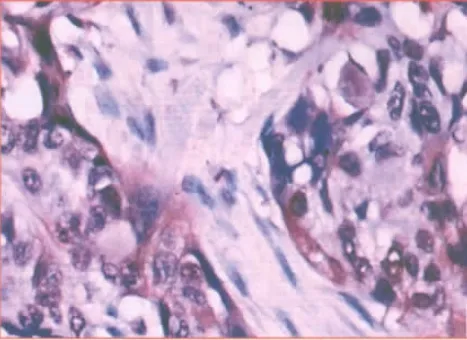
图5 HIF-1α 在食管鳞癌组织中阳性表达于细胞核
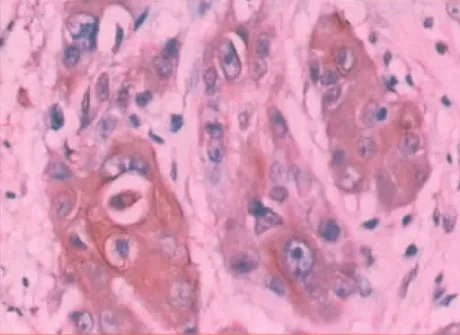
图6 HIF-1α 在食管鳞癌组织中阳性表达于细胞质
1.2.5 CD34、PAS 染色判断标准 通过显微镜观察,食管鳞状细胞无内皮细胞,有肿瘤细胞围成管腔;腔内有无红细胞;PAS 全部或者是部分阳性;食管鳞状细胞癌:免疫组化CD34 阴性[9]。判断时由三位经验丰富、高年资的医生进行盲法读片。
1.3 观察指标
1)分析患者的HIF-1α、CTSD 表达情况与食管鳞状细胞癌临床特征情况。2)分析患者食管鳞状细胞癌中CTSD 与血管生成拟态的相关性。3)分析患者食管鳞状细胞癌中CTSD 与HIF-1α 的相关性。
1.4 统计学方法
数据应用SPSS18.0 进行分析,计量资料用均数±标准差(±s)表示,采用t检验,计数资料用百分比(%)表示,采用χ² 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 HIF-1α、CTSD 表达情况与食管鳞状细胞癌临床特征情况分析
130 例食管鳞状细胞癌患者中,HIF-1α 阳性57 例,CTSD 阳性66 例;HIF-1α、CTSD 阳性表达情况与年龄、性别无明显关系(P=0.071),但是HIF-1α、CTSD 阳性表达情况与脉管癌栓、分化程度、临床分期、淋巴结转移、浸润程度明显有关(P=0.023)。见表1。

表1 HIF-1α、CTSD 表达情况与食管鳞状细胞癌临床特征情况分析[例(%)]
2.2 食管鳞状细胞癌中CTSD 与血管生成拟态的相关性分析
130 例患者中存在血管生成拟态患者的CTSD 阳性率高于无血管生成拟态患者,CTSD 与血管生成拟态呈正相关(P=0.017),见表2。

表2 食管鳞状细胞癌中CTSD 与血管生成拟态的相关性分析
2.3 食管鳞状细胞癌中CTSD 与HIF-1α 的相关性分析
130 例患者中HIF-1α 阳性患者的CTSD 阳性率高于HIF-1α 阴性患者,CTSD 与HIF-1α 呈正相关(P=0.022),见表3。

表3 食管鳞状细胞癌中CTSD 与HIF-1α 的相关性分析
3 讨论
食管鳞状细胞癌是临床消化科常见的恶性肿瘤。该肿瘤容易发生局部转移、浸润,且临床致死率极高,而在肿瘤发生转移与浸润期间,血管生成发挥了重要的作用[10]。血管生成拟态是一种肿瘤细胞供血模式,它不需要依赖内皮细胞进行供血[11]。血管生成拟态的形成与肿瘤恶性程度有很大的关系。肿瘤生长速度越快,恶化程度就越高。肿瘤的侵袭能力越强,越容易形成血管生成拟态,临床上可以将血管生成拟态作为判断肿瘤患者预后不良的重要指标[12]。
恶性肿瘤血管生成拟态形成期间,除肿瘤自身发生形变外,细胞外基质降解重塑也是重要的一部分。因此,临床上一般认为血管生成拟态形成与HIF-1α 诱导VEGF 表达,然后通过各级信号对级联反应进行激活有关,最终会使细胞外基质发生降解,从而使得肿瘤细胞游离并形成了血管生成拟态。缺氧是恶性肿瘤中比较常见的微环境,在恶性肿瘤发生发展期间,缺氧导致CTSD 水平明显升高。另外,CTSD 会参与细胞外基质降解,发挥重塑作用。本研究显示,130 例食管鳞状细胞癌患者中,HIF-1α 阳性57 例,CTSD 阳性66 例;HIF-1α、CTSD 阳性表达情况与年龄、性别无明显关系(P=0.071),但是HIF-1α、CTSD 阳性表达情况与脉管癌栓、分化程度、临床分期、淋巴结转移、浸润程度明显有关(P=0.023)。这说明,HIF-1α、CTSD 参与了食管鳞状细胞癌的浸润与转移。缺氧状态在实体肿瘤环境中属于基本状态,肿瘤对微环境缺氧有适应与调节功效,而这种调节机制需要依赖于HIF-1α 因子的介导来完成,在这个过程中涉及侵袭转移、细胞生存、血管生成[13-14]。在食管鳞癌中HIF-1α 因子的水平较高,且与肿瘤分期、转移、血管生成拟态有很大的关系。相关研究发现,食管鳞癌中HIF-1α 因子的表达是判断患者预后的重要指标。有研究显示,血管生成拟态与HIF-1α因子的表达呈正相关,且与肿瘤的分期、淋巴结转移有很大的关系,这可能与肿瘤恶性程度高、瘤细胞生长繁殖速度较快、变形能力较强、对周围组织产生压力、瘤组织内的间质液体量显著升高有关。同时,肿瘤处于缺氧状态会诱导HIF-1α 因子水平升高,HIF-1α 会通过调节多种血管生成因子表达情况来刺激血管新生,其中发挥作用最大、特异度最高的因子为血管内皮生长因子。当新生的血管无法满足生长繁殖需要时,部分肿瘤细胞就会分泌大量细胞外基质来促使基质重塑,模拟血管结构使其与正常的血管相通,从而促进了血管生成拟态的形成,最终为肿瘤自身的生长提供了血氧。HIF-1α 因子水平升高会促使血管生成拟态的形成。本研究显示,130 例患者中存在血管生成拟态患者的CTSD 阳性率高于无血管生成拟态患者,CTSD 与血管生成拟态呈正相关(P=0.017);130 例患者中HIF-1α 阳性患者的CTSD 阳性率高于HIF-1α 阴性患者,CTSD 与HIF-1α 呈正相关(P=0.022)。这说明,肿瘤的恶性程度越高,肿瘤的繁殖生长速度就越快,且瘤体不断增大会对周围组织造成压迫,使肿瘤出现缺氧状态,使HIF-1α 水平显著提高,而HIF-1α 水平与CTSD 呈正相关,HIF-1α 水平越高,CTSD 水平就越高。HIF-1α 会通过调节多种血管生成因子来刺激心血管的生成,整个过程为后期血管生成拟态的形成都奠定了基础[15]。因此,血管生成拟态的形成与HIF-1α、CTSD 紧密相关。
综上所述,对食管鳞状细胞癌中HIF-1α、CTSD表达和血管生成拟态的关系进行研究发现,CTSD 表达与血管生成拟态存在一定的联系,而HIF-1α 与CTSD表达存在一定的联系。
