蒲公英多糖对溃疡性结肠炎合并菌群失调小鼠肠道菌群调节及抗炎作用研究
2022-12-02周亚妮郭耀东刘成飞李娟芳
周亚妮,郭耀东,刘成飞,李娟芳
溃疡性结肠炎(ulcerative colitis,UC)是一种病因不明确,临床表现为腹痛、黏液脓血便、里急后重,病变主要累及直肠和临近结肠的慢性炎症性肠道疾病,又称非特异性溃疡性结肠炎。大多数UC 患者在肠道微生态方面常表现出不同程度的菌群失调,这些细菌主要有乳酸杆菌、双歧杆菌、大肠杆菌及肠球菌[1]。冉艳等[2]、Lloyd-Price J 等[3]研究表明,UC 患者肠道细菌总数发生变化,病原菌比例增高,菌群的多样性降低。蒲公英有效成分蒲公英多糖具有抑菌、抗炎等作用,对肠道微生态的调节具有重要的作用[4]。然而基于蒲公英抗菌成分对UC 合并菌群失调对炎性因子的调节作用少有研究。笔者研究在2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzene sulfonicacid,TNBS)诱导灌肠法建立小鼠UC 模型的基础上,采用林可霉素灌胃建立肠道菌群失调模型,旨在探讨蒲公英多糖对合并菌群失调的模型小鼠肠道菌群及炎性因子的调节的作用,为临床治疗UC 提供新的思路和实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
选择ICR 清洁级小鼠70 只,磁性不限,鼠龄4~8周,体质量19~23 g。购自西安交通大学基础医学院实验动物中心,动物使用许可证号为SCXK(陕)2012-001。所有动物实验均遵照国家实验动物使用指南。实验计划通过医学院动物实验伦理委员会审查。
1.1.2 主要药物与试剂
蒲公英购自西安市怀仁堂中药店(小寨店),并经生药鉴定为正品;盐酸林可霉素(杭州高科药业有限公司,中国)。
白细胞介素6(interleukin-6,IL-6)、白细胞介素4 (interleukin-4,IL-4)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α) 酶联免疫吸附分析 (enzyme- linked immunosorbent assay,ELISA)试剂盒、内毒素ELISA 试剂盒(上海科美生物科技有限公司,中国);一氧化氮(nitric oxide,NO)试剂盒(南京建成生物工程研究所,中国);丽珠肠乐(珠海丽珠集团丽珠制药厂,中国);肠杆菌选择性培养基(Enterobacteriaceae selective medium,ESM)、乳酸杆菌选择性培养基(Lactobacillus selective medium,LSM)、双歧杆菌选择性培养基 (Bifidobacterium selective medium,BSM)(开封津成生物科技有限公司,中国);无水乙醇、苯酚、葡萄糖、浓硫酸、90%乙醇溶液等均为国产分析纯(西安东威化学试剂有限公司,中国)。
1.1.3 主要仪器
电子分析平台、紫外可见分光分度计(西安昌平仪器厂,中国);EP(eppendorf)管(北京中杉金桥公司,中国);低速自动平衡离心机(北京高科科技有限公司,中国);中空纤维膜(南京鑫威技术有限公司,中国);微量移液器(Eppendorf 公司,美国);酶标仪(Olympus 公司,日本)。
1.2 方法
1.2.1 制备蒲公英多糖
根据侯丽然等[5]报道的方法,结合实验实际进行改进,制备蒲公英多糖。
1.2.2 动物分组
将40 只小鼠随机分为4 组,每组10 只。分别为:正常对照组(正常组)、模型对照组(模型组)、丽珠肠乐组(阳性对照组)和蒲公英多糖组(治疗组)。
1.2.3 小鼠菌群失调造模及药物干预处理
首先参照有关方法[6],采用TNBS 建立小鼠UC模型(笔者所在实验室长期备用)。其次根据有关参考文献[7,8]中的方法,设置饲养条件为恒温25 ℃,湿度为60%。造模前动物喂养准备:自然光照12 h,昼夜交替,适应性喂养1 周。除正常组外,各组小鼠均用林可霉素灌胃,每只每次剂量为0.3 mL,每天2 次,连续用药3 d,制备小鼠肠道菌群失调模型。模型制备成功后,正常组和模型组以等容量0.9%氯化钠溶液(生理盐水)灌胃;阳性对照组以丽珠肠乐稀释液灌胃,每只每次剂量为0.3 mL,每天2 次,连续用药7 d;治疗组以蒲公英多糖稀释液灌胃,每只每次剂量为0.3 mL,每天2 次,连续用药7 d。期间每天观察和记录各组小鼠的一般状况,如精神、活动、进食、毛色、排便及饮水等情况,并分别于第3 天、第5 天、第7 天称量小鼠体质量。根据相关研究显示,炎症性肠病动物模型其炎症反应程度在第7 天到达最高峰,后期病情逐渐恢复[9]。故实验7 d 后处死小鼠,留取标本进行各项指标检测。
1.2.4 酶联免疫吸附分析法
1.2.4.1 ELISA 检测血清中尿酸、一氧化氮的含量 末次给药24 h 后,4 组小鼠均禁食12 h,于次日采集各组小鼠眼眶静脉血4~6 mL;室温置于EP 管中,静置2 h;于4 ℃温控下、3 000 r/min 条件下离心5 min,取上层血清。将分离的血清置于-20 ℃条件下保存备用。严格参照尿酸(uric acid,UA)、NO 试剂盒说明书检测各组小鼠血清UA、NO 含量。
1.2.4.2 检测血清中IL-4、IL-6、TNF-α 的表达水平将分离的血清从-20 ℃冰箱中取出后,放入4 ℃冰箱中溶解24 h,待血清全部溶解,轻轻振荡摇匀待用。检测操作严格按照小鼠IL-4、IL-6 和TNF-α ELISA 试剂盒使用说明书进行,利用酶标仪分光光度计测定450 nm 处光密度(optical density,OD )值,分别计算出血清IL-4、IL-6 和TNF-α 的浓度。
1.2.5 肠道菌液的收集与细菌培养
在上述1.2.4.1 节实验完成后,参照有关文献研究方法[10,11],无菌采集盲肠内容物5.0 g,按比例混合[(1.0 g 盲肠内容物∶4 mL 0.9%氯化钠溶液(生理盐水)],置振荡器上振荡15 min 至混悬液。在低于4 ℃条件下,高速离心10 min(转速3 000 r/min),取上清液 (即肠道菌液)。将肠道菌液用0.9%氯化钠溶液(生理盐水)连续稀释,准备进行大肠杆菌、双歧杆菌、乳酸杆菌的选择性培养[10],具体方法见表1。

表1 细菌培养与鉴定Tab.1 Bacterial culture and identification
1.2.6 活菌计数
根据3 种细菌培养情况进行菌落计数,按平板活菌计数法,按照公式计算活菌数(用对数表示):CFU/g标本=X×47×稀释倍数,取平板菌落数在50~300 个为宜。
1.3 统计学方法
采用SPSS 20.0 软件进行统计分析,计量资料采用均值± 标准差表示,进行两个样本均数的t 检验。P<0.05 为差异有统计学意义,P<0.01 为差异有显著统计学意义。
2 结果
2.1 治疗后4 组小鼠一般情况及体质量变化比较
正常组小鼠精神佳,体毛顺滑,进食、进水及二便均正常;模型组小鼠第2 天开始出现精神倦怠乏力、行动迟缓、体毛毛躁、进食量减少、粪便稀糊不成型等状况。经过治疗后,阳性对照组和治疗组小鼠精神好转明显,体毛较前顺滑,活动量增加,摄食饮水量也有所增加,粪便逐渐成形。通过体质量数据记录,选取第1 天、第3 天、第5 天、第7 天进行比较(表2)。与正常组比较,模型组小鼠第1 天、第3 天体质量均减轻,第3 天体质量比较,差异有统计学意义(P <0.05),而第1 天体质量比较,差异无统计学意义(P>0.05);比较第5 天、第7 天体质量,差异有显著统计学意义(P <0.01)。与模型组比较,阳性对照组小鼠体质量有增长趋势,第3 天、第5 天体质量比较,差异有统计学意义(P <0.05);第7 天体质量比较,差异有显著统计学意义(P <0.01)。与模型组比较,治疗组小鼠体质量有增长趋势,第5 天、第7 天体质量比较,差异有统计学意义(P <0.05)。与阳性对照组比较,治疗组小鼠体质量稍偏低,但差异无统计学意义(P >0.05)。见图1。

表2 治疗后4 组小鼠体质量比较 gTab.2 Comparison of body mass after treatment in 4 groups g
2.2 治疗后4 组小鼠血清中尿酸、一氧化氮水平比较
与正常组相比,模型组小鼠血清UA、NO 含量明显增加,差异均有统计学意义(P <0.05)。分别给予丽珠肠乐、蒲公英多糖灌胃治疗7 d 后,阳性对照组、治疗组小鼠血清UA、NO 含量较模型组降低,差异具有统计学意义(P <0.05);但阳性对照组、治疗组小鼠血清UA、NO 含量还高于正常组,差异具有统计学意义(P <0.05)。然而,阳性对照组与治疗组小鼠血清中UA、NO 含量比较,差异无统计学意义(P >0.05)。见表3。

表3 治疗后4 组小鼠血清中UA、NO 含量比较 μmol/LTab.3 Comparison of serum UA and NO after treatment in 4 groups μmol/L
2.3 治疗后4 组小鼠肠组织中炎性因子水平比较
与正常组比较,模型组、阳性对照组和治疗组IL-4 的含量均降低(P <0.05),其中模型组IL-4 含量显著降低,差异有显著统计学意义(P <0.01)。与模型组比较,阳性对照组和治疗组IL-4 含量显著升高,差异有显著统计学意义(P<0.01)。与模型组比较,阳性对照组IL-6、TNF-α 含量均降低,但差异无统计学意义(P>0.05);但与正常组比较,IL-6、TNF-α 含量均升高,差异有统计学意义(P <0.05)。阳性对照组IL-6、TNF-α 含量与治疗组比较,差异无统计学意义(P>0.05)。见表4。
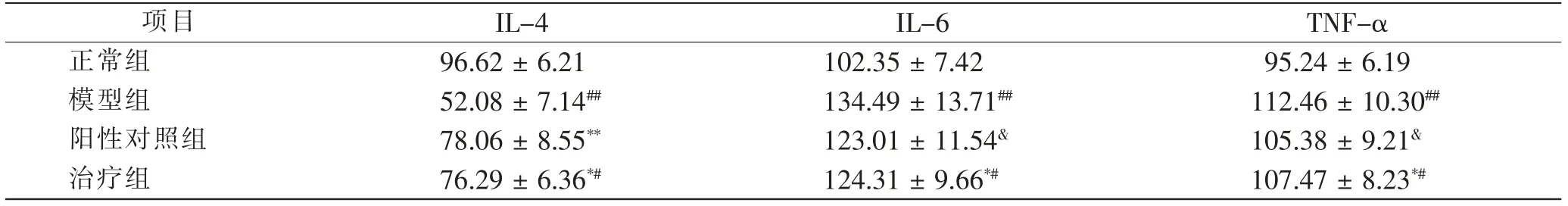
表4 治疗后4 组小鼠血清中炎性因子含量比较 ng/mLTab.4 Comparison of serum inflammatory factors after treatment in 4 groups ng/mL
2.4 治疗后4 组小鼠肠道菌群变化比较
对各组小鼠肠道中的大肠杆菌、双歧杆菌和乳酸杆菌的数量进行比较,与正常组比较,模型组小鼠肠道内大肠杆菌数量明显增加,而乳酸杆菌和双歧杆菌数量均明显减少,差异有显著统计学意义(P <0.01);与模型组比较,阳性对照组、治疗组大肠杆菌数量明显下降(P <0.01),而乳酸杆菌和双歧杆菌数量均显著增加,差异具有显著统计学意义(P <0.01);与模型组相比,治疗组大肠杆菌数量明显减少,差异具有显著统计学意义(P <0.01),而双歧杆菌、乳酸杆菌数量均增加明显,差异有显著统计学意义(P <0.01);与阳性对照组比较,治疗组大肠杆菌数量稍低,而双歧杆菌、乳酸杆菌数量略有增加,但差异均无统计学意义(P >0.05)。见表5。

表5 蒲公英多糖对肠道内细菌数量的影响Tab.5 Comparison of dandelion polysaccharide effect on intestinal bacteria in 4 groups
3 讨论
菌群失调是肠功能紊乱的一种表现,主要表现为肠道正常菌群的改变和益生菌的改变,促使肠道炎性细胞活化,释放多种细胞因子,可见肠道菌群与肠道免疫因子的分泌有密切的关系[12]。根据有关方法,笔者在建立UC 模型的基础上,利用林可霉素灌胃建立菌群失调小鼠模型,该菌群失调模型更接近于人类肠道菌群失调症[6~9]。研究发现,肠道益生菌作为一种稳定肠道内环境平衡的一种微生物,可作用于肠上皮细胞,通过调节肠道菌群对宿主产生有益的作用,这些细菌主要包括双歧杆菌、乳酸杆菌等,而大肠杆菌属于正常菌群,其主要作用是预防胃肠炎,同时益生菌可对微生物群类分布产生一定的影响[13]。有临床研究报道,菌群失调患者体内的肠道菌群多样性下降,益生菌数量减少,机会性致病菌数量增加[14]。笔者研究结果显示,与正常组相比,模型组大鼠体质量下降,差异有统计学意义;血清中UA、NO 含量增加,血清中IL-4 降低,而IL-6 和TNF-α 含量增高,差异均有统计学意义;模型组大肠杆菌数量增多,而肠道有益菌双歧杆菌、乳酸杆菌的数量减少,差异均有统计学意义。分别给予丽珠肠乐(阳性对照组)及蒲公英多糖治疗后,结果显示:与模型组大鼠比较,阳性对照组大鼠体质量下降,差异有统计学意义;血清中UA、NO 含量增加,血清中IL-4 降低,而IL-6和TNF-α 含量增高,差异均有统计学意义;大肠杆菌数量增多,而肠道有益菌双歧杆菌、乳酸杆菌的数量减少,差异均有统计学意义。TNF-α 是一种由活化的单核-巨噬细胞产生的细胞因子,可引起细胞坏死、水肿甚至蛋白质破坏,进而促使肠道内细胞的损害。IL-6 是一种由单核细胞、上皮细胞产生的促炎因子,可加剧肠黏膜炎性反应。TNF-α 可协同IL-6 改变结肠上皮细胞的屏障结构,于是导致了肠黏膜通透性增加。IL-4 为抑炎因子,可下调炎性细胞因子基因的转录及其分泌,发挥抗炎和免疫调节作用,是肠道免疫的重要因子[15]。实验数据显示,模型组小鼠血清中TNF-α、IL-6 含量均显著高于正常组,而IL-4低于正常组;阳性对照组(丽珠肠乐)及治疗组(蒲公英多糖)大鼠血清中TNF-α、IL-6 的水平较模型组均显著降低,IL-4 水平升高,说明蒲公英多糖可能通过减少菌群失调模型小鼠的炎性细胞因子分泌,减轻肠道炎症反应和组织损伤,进而对菌群失调引起的肠道功能紊乱起到治疗作用。血液中的UA、NO 增高,多考虑与溃疡性结肠炎刺激导致的炎性因子TNF-α 和IL-6 增高、而抑炎因子IL-4 降低有关。
综上,笔者应用蒲公英多糖治疗林可霉素诱导的小鼠肠道菌群失调后,肠道菌群失调现象有明显改善,推测蒲公英多糖是一种良好的肠道微生态调节剂,但具体作用机制尚有待进一步研究。
