花生组织抗氧化生理生化指标快速测定方法
2022-12-01莹王馨宁孙泽鑫蒋春姬赵新华于海秋王
于 莹王馨宁孙泽鑫蒋春姬赵新华于海秋王 婧
(沈阳农业大学农学院,辽宁 沈阳 110866)
植物组织感受到周围环境变化时,可通过调控自身的代谢水平,维持细胞正常生理功能[1]。测定生理生化指标的变化是探讨逆境下植物内部生理特点变化的基础,也是确定植物分子机制的关键。如何快速而准确地测定生理生化指标,对了解逆境下植物生理代谢变化具有重要意义,同时也可为确定植物对外界环境的响应机制提供重要信息[2-9]。课题组前期测定花生叶片和根系组织超氧化物歧化酶(SOD)、过氧化物酶(POD)、丙二醛(MDA)、可溶性蛋白(SP)等抗氧化生理生化指标时,均采用传统方法;而在试验过程中发现该方法提取粗酶液的过程耗时、耗力,酶易失活,测定数据效率低、误差较大。针对这些缺点,对传统测定方法进行改进,例如,采用液氮冻样,预冷组织研磨器,测定时等比例加入反应液及酶液。另外,改用酶标仪测定样品吸光度,建立了SOD、POD、MDA、SP 等生理生化指标的快速测定方法。本文检测了花生叶片及根系在干旱逆境处理条件下生理生化指标的变化,验证了新方法的可行性和准确性,可在常规科研中使用。该测定方法具有节省材料、耗时短、准确率高等优点,适合大批量花生组织的快速测定,为广大科研工作者提供了改进方法。
1 材料与方法
1.1 试验材料培养
试验材料为花生,置于沈阳农业大学农学院幼苗培养室(光暗周期16 h/8 h,湿度60%,温度昼28℃/夜23℃)进行培养。
1.2 植物组织预处理
花生幼苗培养至三叶一心期,用20%PEG-6000模拟干旱环境,分别在干旱胁迫后0、3、6、9、12、24 h进行取样。
1.2.1 快速测定方法
将花生叶片和根部组织各取0.2 g剪碎,立即装入内有1~2粒直径0.2 mm 钢珠的2.0 mL离心管中,标好序号后放入-80℃超低温冰箱中冻存。测定前将待测样品从超低温冰箱转入液氮中至少0.5 h(图1 a),装入事先经冷冻处理的组织研磨适配器中(48×2 mL)(图1 b),利用高通量组织研磨器(SCIENTZ-48) 在60~70 Hz下研磨120~180 s(图1 c)。研磨结束加入2 mL 4℃预冷的磷酸缓冲液(PBS,p H=7.8),利用旋涡震荡仪(VETEX SHAKER QL-866)混匀(图1 d),随后在冷冻高速离心机(HEMA TGL-16R Refrigerated Centrifuge)13 000 r/min下离心15 min(图1 e),上清液即为酶粗提液(图1 f)。

图1 快速测定方法的操作流程Fig.1 The procedure of rapid determination
1.2.2 传统测定方法
将花生叶片和根部组织各取0.5 g装入自封袋,做好标记放入-80℃超低温冰箱中冻存。测定各项目之前,将待测样品从超低温冰箱中转入4℃预冷的研钵中,加入石英砂和2 mL磷酸缓冲液(PBS,p H=7.8)于冰盒上手动研磨120 s,研磨成匀浆后倒入5 mL离心管中,并用3 mL磷酸缓冲液冲洗研钵,一同倒入离心管,利用高速落地冷冻离心机(Thermo Fisher SCIENTIFIC,LYNX4000)15 000 r/min离心20 min,上清液即为酶粗提液。
1.3 项目测定
1.3.1 超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)光化还原法[10]
反应液的配制和显色反应过程,快速测定方法与传统测定方法相同。
(1)测定步骤。
取50 mL小烧杯,加入显色混合液2.95 mL,粗酶液0.05 mL,再取4个相同规格烧杯加入混合液2.95 mL和磷酸缓冲液0.05 mL,其中3个与样品一同放入光照培养箱(照度6 000 lx)照光30 min,另外一个放入暗室作为对照,样品照光30 min后取出放入暗室终止反应,以遮光的对照管作为空白调零,分别在560 nm 下测定各管吸光度值。
快速测定方法:每个样品取0.3 mL 待测液加入酶标板,于酶标仪(Thermo SCIENTIFIC,MULTISKAN GO)中测定。
传统测定方法:每个样品取3 mL 待测液加入比色皿中,放进紫外/可见分光光度计(PerkinElmer,Lambda 365)中进行测定。
(2)两种方法结果计算公式一致。
1.3.2 过氧化物酶(POD)活性测定采用愈创木酚法[10]
(1)反应液的配制。
快速测定方法:0.1 mol/L pH=6.0的磷酸缓冲液50 mL加入烧杯中,加入愈创木酚28μL,水浴加热摇匀直至愈创木酚完全溶解,测定前加入30%的过氧化氢19μL,充分溶解后,将反应液分装到2 mL离心管中,置于37℃温浴器中5~8 min。
传统测定方法:0.1 mol/L pH=6.0的磷酸缓冲液100 mL加入烧杯中,加入愈创木酚56μL,水浴加热摇匀直至愈创木酚完全溶解,测定前加入30%的过氧化氢38μL,充分溶解后,置于37℃水浴锅中待用。
(2)测定步骤。
快速测定方法:分别吸取0.005 mL酶粗提液并加入0.295 mL反应液于酶标板中,波长470 nm下,从反应0 s开始,每30 s测定一次吸光度,共计6 个数值,即测定150 s终止,记录150 s内ΔA470变化。以0.295 mL 反应液加0.005 mL缓冲液对照调零。
传统测定方法:分别吸取0.05 mL酶粗提液并加入2.95 mL反应液于比色皿中,波长470 nm下,从反应0 s开始,每30 s测定一次吸光度,共计6 个数值,即测定150 s终止,记录150 s内ΔA470变化。以29.5 mL反应液加0.05 mL 缓冲液对照调零。
(3)两种方法结果计算公式一致。
1.3.3 丙二醛(MDA)含量测定采用硫代巴比妥酸比色法(TBA)[10]
(1)反应液的配制。
快速测定方法与传统测定方法此步骤相同。
(2)测定步骤。
快速测定方法:选取新的2 mL离心管编号,分别往新离心管中加入粗提取液0.3 mL和0.5%的TBA 0.3 mL,沸水浴15 min,迅速冷却后离心(8 000 r/min,10 min),每个样品吸取0.3 mL上清液加到酶标板中,在波长532 nm、600 nm 下测定吸光度值。
传统测定方法:选取新的5 mL离心管编号,分别往新离心管中加入粗提取液1.5 mL和0.5%的TBA 1.5 mL,沸水浴15 min,迅速冷却后离心(8 000 r/min,10 min),上清液移至比色皿中,在波长532 nm、600 nm 下测定吸光度值。
(3)两种方法结果计算公式一致。
1.3.4 可溶性蛋白质(SP)含量测定采用考马斯亮蓝染色法[10]
(1)反应液的配置和标准曲线配制。
快速测定方法与传统测定方法此步骤相同。
(2)测定步骤。
快速测定方法:分别吸取0.29 mL 考马斯亮蓝溶液和0.01 mL 酶粗提取液加入酶标板中混匀,反应2 min,595 nm 波长下比色,以0.29 mL考马斯亮蓝溶液加0.01 mL 磷酸缓冲液(0.05 mol/L pH=7.8)对照调零。
传统测定方法:分别吸取2.9 mL 考马斯亮蓝溶液和0.1 mL 酶粗提取液置于比色皿中混匀,反应2 min,595 nm 波长下比色,以2.9 mL考马斯亮蓝溶液加0.1 mL 磷酸缓冲液(0.05 mol/L pH=7.8)对照调零。
(3)两种方法结果计算公式一致。
2 结果与分析
2.1 快速测定方法与传统测定方法的测定数据对比分析
分别使用快速测定方法和传统测定方法做重复性试验,具体结果如表1、表2所示。
2.1.1 花生根系不同抗氧化指标测定数据的差异显著性分析
对两种测定方法在花生根系中测定的试验数据进行t检验分析,判断两种方法得到的数据是否存在显著性差异(表1)。数据分析表明,SOD、POD、MDA 和SP指标的t检验概率事件数值分别为0.98,1.00,0.88和0.08,均大于0.05,说明快速测定方法与传统测定方法测定的结果差异不显著,快速测定方法可以代替传统方法测定花生组织中的抗氧化生理生化指标。
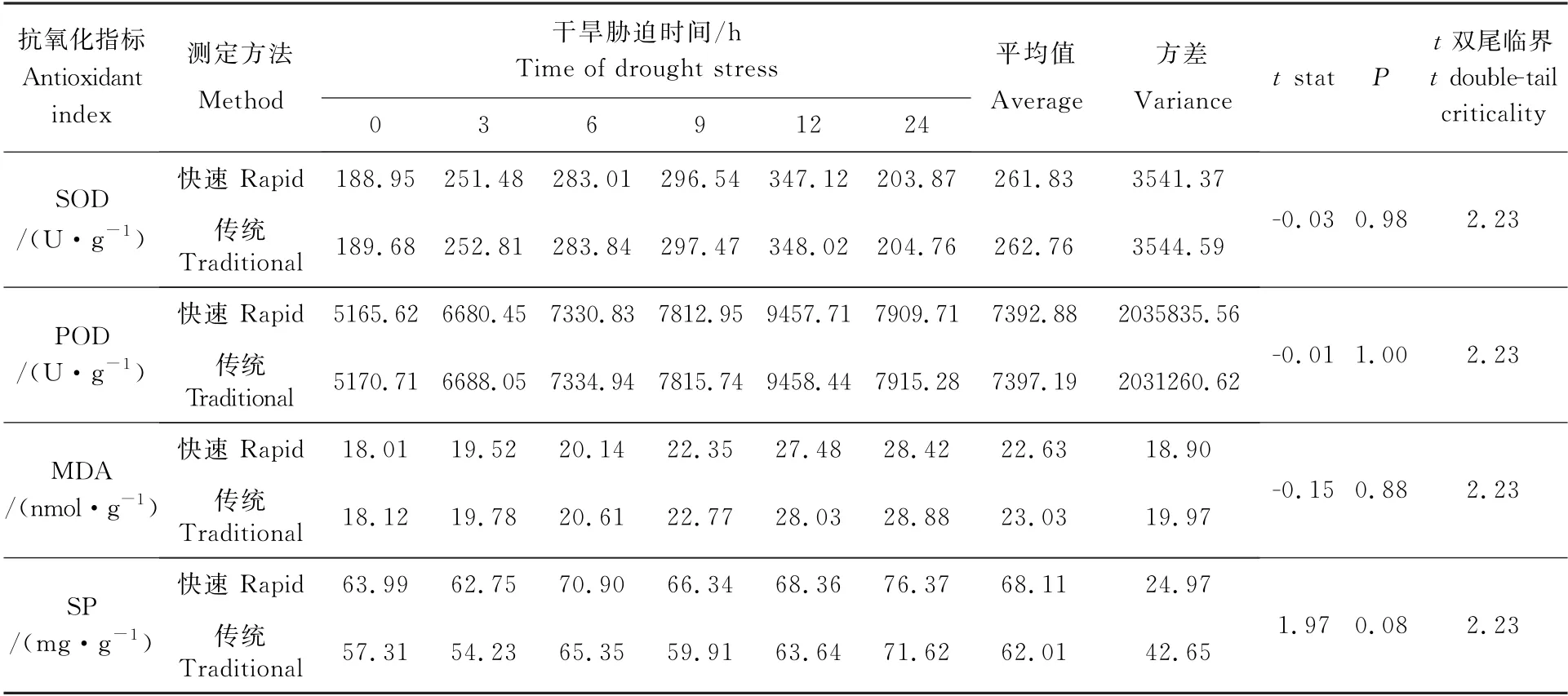
表1 两种方法测定根系抗氧化指标的结果差异性比较Table 1 Comparison of the difference of antioxidant indexes in root with two methods
2.1.2 花生叶片不同抗氧化指标测定数据的差异显著性分析
对两种测定方法在花生叶片中测定的试验数据进行t检验,判断两种方法得到的数据是否存在差异显著性(表2)。数据分析表明,SOD、POD、MDA 和SP指标的t检验概率事件的数值分别为0.81,0.96,0.85和0.97,均大于0.05,说明快速测定方法与传统测定方法测定的结果差异不显著,快速测定方法可代替传统方法测定花生组织中的抗氧化生理生化指标。

表2 两种方法测定叶片抗氧化指标的结果差异性比较Table 2 Comparison of the difference of antioxidant index in leaves with two methods
2.2 快速测定方法与传统测定方法的用时对比
表3可见,快速测定方法和传统测定方法研磨样品及测定时所需的理论时间差异,其中快速测定方法研磨70个样品所需时间120~300 s(图2 a),当天测定4个生理生化指标理论耗时约2.0~2.5 h;传统测定方法研磨1个样品的时间为120 s(图2 b),研磨70个样品所需时间约8 400 s,当天测定4个生理生化指标理论耗时约7.0~8.1 h。

图2 快速测定方法和传统测定方法研磨样品用时及样品数量对比Fig.2 Comparison of required ground time and sample number between rapid measurement method and traditional measurement method

表3 快速测定方法和传统测定方法的理论用时对比Table 3 Comparison of theoretical required time between rapid measurement method and traditional measurement method
但在实际操作中,使用快速测定方法当天检测4个生理生化指标时,研磨过程可在5 min内完成,加上配制反应液等步骤,大约耗时10~12 h。
而传统测定方法往往耗时更久,研磨过程主要在冰盒上完成,不仅样品易失活而且耗费人力。当天检测70个样品的4个生理生化指标,需耗时24~30 h。而且在指标测定过程中,需要及时清洗比色皿,逐步进行不同项目的测定,等待软件运行,消耗更多时间。因此,可以看出快速测定方法的用时约为传统测定方法的一半;另外,快速测定方法研磨出的样品匀浆液的均匀度高于传统测定方法,可降低同一批次数据误差 (图3)。

图3 快速测定方法(左)和传统测定方法(右)样品均一度对比Fig.3 Uniformity comparison of grinding sample between rapid measurement method (left)and traditional measurement method (right)
3 讨论
本文介绍的花生组织抗氧化生理生化指标测定方法快速直接,与传统测定方法相比具有以下优点:
①减少样品用量。传统测定方法通常选取0.5 g样品,设三个重复进行测定;而实际操作中往往遇到试验材料数量有限、样品量不足的问题。快速测定方法仅需0.2 g样品,三个重复可在24 h内同时测定出SOD、POD、MDA、SP等多个生理生化指标的数值,测定时吸取的酶液仅为传统测定方法的1/10左右,反应液用量也按比例减少,降低了样品和反应液的使用量;相比传统方法在节约样品的同时也节省了试验费用(图3)。由于取样量较常规方法减少一半,相对增加了组织特异性误差,可在实际操作中增加样品取样分布点,增加生物学重复及技术性重复,平衡样品取样量较少的问题。
②节省研磨样品时间。传统测定方法试验过程操作繁琐,耗时长,仅研磨组织样品这一环节就需花费大量时间,平均手工研磨一个样品需要2 min。虽全程在冰盘上操作,但周围环境温度不稳定,且研磨过程中产生的热量可使样品中酶的活性发生改变进而影响最终测定结果,因此传统方法测定结果受外界因素影响较大。而快速方法取样前已在离心管中加入钢珠,采集的花生组织也在极短时间内装入离心管并冻存于超低温冰箱中;研磨时将离心管直接放进预冷的适配器中,5 min即能够完成70个样品的研磨工作,操作简单快捷,节省人工 (图1,图2,表3)。
③研磨更加彻底。传统测定方法操作中采用人工研磨样品,导致样品间存在较大差异,且有些样品如生育后期的根系、茎秆具有一定的韧性,不易磨碎,增加了试验人员的操作难度,对测定结果造成很大影响;而快速检测方法利用液氮及预冷的组织研磨仪对样品进行冷冻研磨,每个离心管中放入相同数量及大小(0.2 mm)的钢珠,研磨环境相同,研磨时间相同,减少了样品间在磨样过程中产生的操作误差,且与人工研磨相比,更加均匀彻底(图3)。通常在样品数量大的情况下,试验人员使用传统方法检测时需要提前一天将所有样品研磨完毕,然后放入4℃冰箱进行保存。由于抗氧化酶系统的酶类物质从细胞释放出来后对温度比较敏感,传统方法的操作流程会因为酶的活性下降而影响试验数据的准确性。而快速检测方法能在短时间内解决大量样品的研磨问题,可在当天检测研磨出的样品,减少试验误差。此外,通过对测定结果的统计学分析,证明了两种方法获得的数据差异不显著 (表1,表2)。
手工研磨样品,利用分光光度计测定样品吸光度是当前植物组织生理试验中普遍使用的方法,但该方法操作复杂,效率较低。本文对传统测定方法进行了改进,在保证测定结果合理、准确的同时,优化了样品用量和试剂使用量,降低了科研工作者的工作强度,契合降本控费、提质增效的理念。此外,数据经过t检验证明两种方法测得的数据差异不显著。同时该快速测定方法也可用于单双子叶作物等微量组织的生理生化指标测定。因此,快速测定方法可代替传统测定方法广泛应用于植物组织生理生化指标的测定。
致谢:感谢沈阳农业大学大豆研究所姚兴东老师在快速测定方法建立过程中提供的帮助,感谢杜琪(现任职河北省农林科学院,滨海农业研究所)博士期间对传统测定方法的验证。
