花生壳吸附白芍水提液中重金属的性能研究
2022-12-01曹洪斌邓波李冬刘振中申明金汤迪甘玲莉
曹洪斌邓 波李 冬刘振中申明金汤 迪甘玲莉
(1.川北医学院基础医学与法医学院,四川 南充 637000;2.川北医学院公共卫生学院,四川 南充 637000;3.南充水务集团有限(责任)公司水质监测中心,四川 南充 637000;4.川北医学院临床医学院,四川 南充 637000)
中药是世界传统医学的重要组成部分,也是中华民族的瑰宝。然而中药重金属含量超标会危害人体健康,而且使中药出口遭遇“绿色贸易壁垒”,同时也是中药现代化和国际化的瓶颈。《中国药典》制定了严格的重金属限量标准,其他国家也对进口中药的重金属制定了限量标准。因此,控制中药重金属含量刻不容缓,当务之急是采取行之有效的方法来降低中药重金属含量,以保障人体健康和加快推进中药国际化。
去除中药重金属的方法主要有絮凝沉淀法[1]、大孔螯合树脂法[2]、超临界CO2配合萃取法[3]、γ-巯丙基键合硅胶法[4],以及其他如EDTA络合法[5]、NH3·H2O-NH4NO3法[6]、麦饭石吸附法[7]、阴离子交换树脂法[8]、阳离子交换树脂[9]和电吸附法[10]等。这些方法能有效降低中药重金属含量,但也存在一些不足,比如反应机理不明确,或设备昂贵,或工艺复杂,或应用重金属元素有限等,因此在实际规模化应用中受到限制。
近年来,国内外研究的热点主要是采用安全、经济的天然材料作为吸附剂处理重金属,其中最主要的来源是低成本农林副产品中的生物质废弃物。农林废弃物具有天然高分子结构,它主要包括纤维素、半纤维素和木质素等。农林废弃物是一种新的吸附剂,具有成本低,对环境无二次污染,取材来源广等特点。研究表明,农林废弃物如甘蔗渣[11]、核桃壳[12]、花生壳[13]、柚子皮[14]、玉米芯[15]和稻壳[16]等皆可用于废水中重金属离子的吸附,这也为去除中药重金属奠定了理论基础,但其在处理中药重金属方面的应用却鲜有报道。目前中药重金属研究主要集中在单一金属的吸附,很少关注重金属去除前后吸附剂形态或结构的变化以及中药有效成分的变化。
本研究以经济、环保、安全和资源再利用为出发点,将花生壳等用于去除白芍水提液中的两种重金属(Pb2+和Cd2+),优化吸附条件,比较不同农林废弃物的吸附能力,研究吸附中药重金属前后的药液含固量和HPLC图谱,分析吸附前后药液中主要的化学成份变化情况,采用FTIR(Fourier transform infrared spectroscopy)、SEM(scanning electron microscope)和XRD(X-ray diffraction)分析花生壳的结构或形态变化,探讨花生壳的吸附机理,探索花生壳去除中药重金属的可行性以及技术的适用性,以期为处理中药中重金属提供一种新的思路和途径,并为农林废弃物在中药重金属处理方面的实际应用提供科学数据,同时为农林废弃物的资源化利用提供参考。
1 材料与方法
1.1 材料与试剂
实验用的不同目数花生壳粉:购自江苏连云港;白芍饮片:四川聚元药业有限公司;铅、镉标准溶液(1 000μg/m L):国家有色金属及电子材料分析测试中心;芍药苷对照品(批号110736-202145):中国食品药品检定研究院;硝酸(优级纯),30%过氧化氢(优级纯),氢氧化钠(分析纯):成都市科隆化学品有限公司;超纯水:实验室纯水机制备。所用器皿均经5%硝酸浸泡过夜,并用超纯水洗净,晾干备用。
1.2 仪器与设备
THZ-82恒温振荡器:常州市国旺仪器制造有限公司;电感耦合等离子体质谱仪,微波消解仪:美国PerkinElmer公司;Nicolet iS5型傅立叶变换红外光谱仪,赛默飞U3000高效液相仪:美国赛默飞世尔科技公司;日立S4800场发射扫描电镜仪:日本日立公司;Bruker D8 Advance X射线多晶衍射仪:德国Bruker科技有限公司;旋转蒸发器:上海亚荣生化仪器厂;TDZ4-WS 离心机:湖南湘仪实验室仪器开发有限公司;电子天平:上海舜宇恒平科学仪器有限公司;PHS-3C型p H 计:上海仪电科学仪器股份有限公司。
1.3 方 法
1.3.1 吸附剂的制备
花生壳粉置干燥箱内于80℃下烘干至恒量,分别过40目、60目、80目、100目、120目和150目筛,然后置于干燥器中备用。采用ICP-MS测定该花生壳Pb(II)和Cd(II)的含量,分别为0.740 0 mg/kg和0.092 36 mg/kg,远低于限量标准,因此该花生壳含有的Pb(II)和Cd(II)对白芍药液重金属的吸附影响可以忽略。
1.3.2 含铅和镉白芍药液的制备
适量的白芍饮片于80℃下烘干至恒量,取其100 g,加入超纯水,浸泡30 min,加热回流提取2次,第一次加1 000 mL超纯水回流提取1.5 h,第二次加800 mL,回流提取1.5 h[17],过滤,合并提取液,70℃下进行旋转蒸发浓缩至接近1 L,离心,经0.45μm 微孔滤膜过滤,加入适量铅和镉的标准溶液,摇匀,然后加入适量NaOH 调节药液p H 至5.0[18],用超纯水定容至1 L。此时药液浓度为100 g/L,即每1 mL相当于药材0.1 g,含铅1μg和镉0.2μg。
1.3.3 吸附实验
在锥形瓶中加入一定质量和一定粒径的花生壳吸附剂,加入50 mL含铅和镉白芍药液,然后置于恒温振荡器振荡(150 r/min)一定时间后,离心,微孔滤膜过滤。取一定体积的滤液经微波消解后,采用ICP-MS测定药液中Pb2+和Cd2+的浓度。各影响因素的吸附实验则通过改变相应的实验条件。Pb2+和Cd2+去除率R的计算公式为:
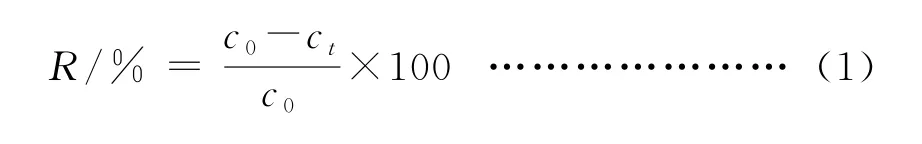
式中:c0/(μg·L-1)和ct/(μg·L-1)分别为吸附前Pb2+或Cd2+的初始浓度和吸附t时刻的浓度。
1.3.4 样品的消解及铅镉含量测定
准确移取吸附前后的白芍药液5.00 mL至微波消解罐,加入5 mL浓HNO3和2 mL H2O2,设置微波消解程序,进行消解至无色。消解结束后,放冷,转移至聚四氟烧杯,然后赶酸至约2 mL,转移至50 mL容量瓶中,用超纯水定容。同法操作制得空白溶液。采用ICP-MS测定重金属含量。
1.3.5 吸附前后的花生壳FTIR、SEM 和XRD分析
分别取适量的吸附重金属前后的花生壳,用KBr压片,在4 000~400 cm-1范围内测定红外吸收光谱。对吸附前后的花生壳,进行不同放大倍数扫描电镜分析。花生壳的XRD 分析,采用德国Bruker D8 Advance X-Ray仪,以Cu靶,Kα为辐射源,管电压为40 k V,管电流为40 m A,扫描步长0.15°/s,扫描范围5~90°。
2 结果与分析
2.1 吸附因素试验结果与分析
2.1.1 吸附剂用量的影响
从图1可知,随着花生壳用量的增加,Pb2+和Cd2+的去除率提高,这是因为溶液中吸附剂越多,表面积就越大,金属离子可交换位点也越多,吸附效率就越高。当花生壳的用量达到3.6 g后,Pb2+和Cd2+去除率分别保持在86%和72%以上,且变化幅度较小。表明花生壳用量的增加有利于重金属的去除,但达到平衡后,过量吸附剂并不能显著地提高吸附率,可能是因为吸附剂颗粒的聚集或结块,以及重金属离子吸附于颗粒的表面后,由于颗粒间的拥挤而使表面的空吸附位减少,导致去除率不会明显增加[19]。为提高花生壳利用率和吸附率,适宜的花生壳用量为3.8 g。
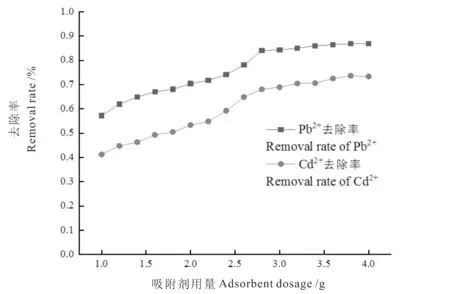
图1 吸附剂的用量对Pb2+和Cd2+去除率的影响Fig.1 Effect of adsorbent dosage on the removal rate of Pb2+and Cd2+
2.1.2 吸附时间的影响
由图2可见,Pb2+和Cd2+去除率随时间的增加而增加,吸附1 h,Pb2+和Cd2+去除率分别达85.78%和73.53%,当吸附2.5 h后,重金属去除率趋于稳定。这可能是因为刚开始吸附时,药液中重金属离子浓度相对较高,花生壳表面的活性位点未被占据,Pb2+和Cd2+主要吸附在花生壳表面,因此吸附速度较快;随着吸附过程的进行,重金属离子逐步进入花生壳空隙中,并随着在空隙中传质动力的逐步降低,重金属离子去除率随时间缓慢增加,直到吸附平衡[20]。因此选定吸附达到平衡的时间为2.5 h。
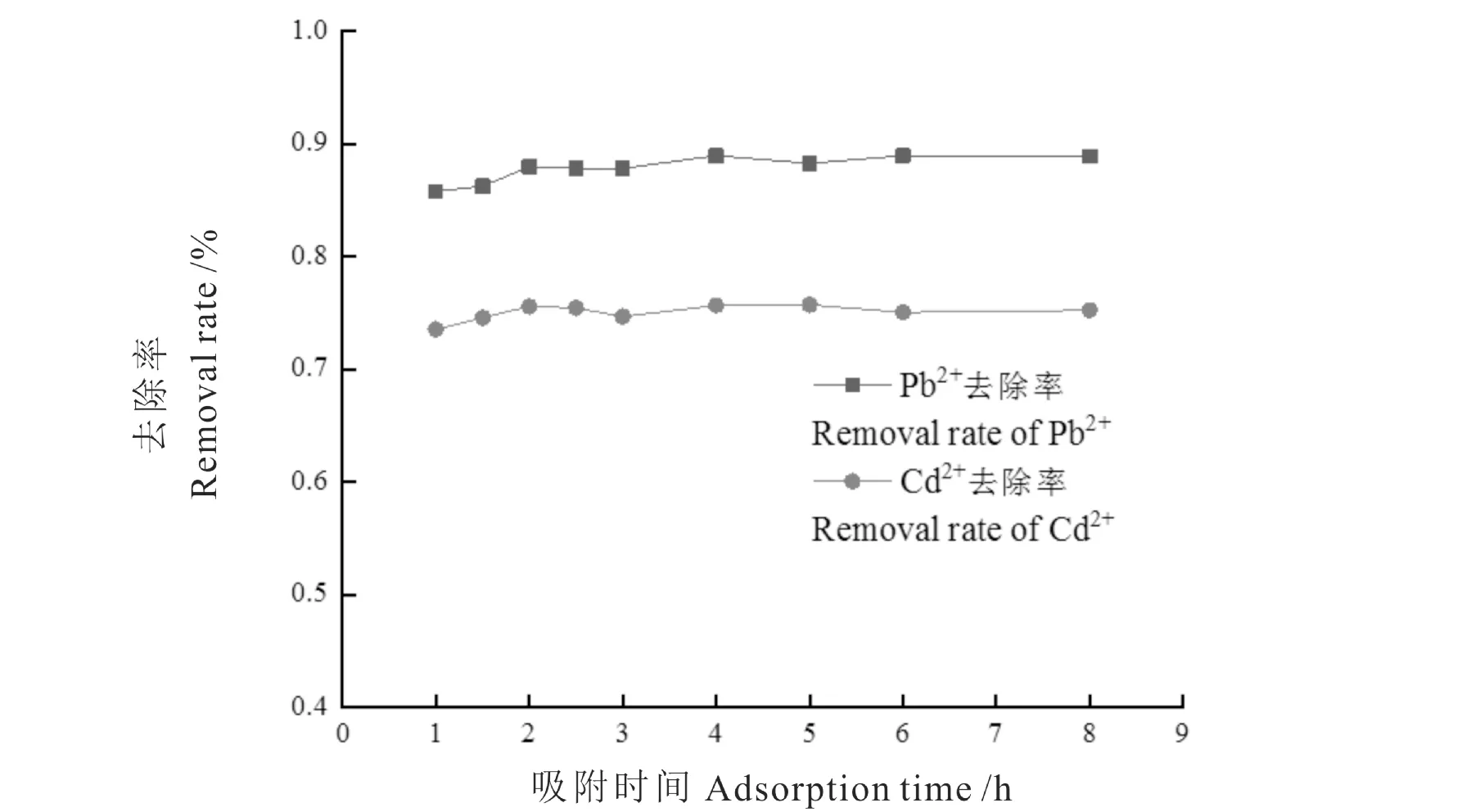
图2 吸附时间对Pb2+和Cd2+去除率的影响Fig.2 Effect of adsorption time on the removal rate of Pb2+and Cd2+
2.1.3 花生壳粒径的影响
由图3可知,随着花生壳的目数增大,药液中Pb2+和Cd2+的去除率也增大,这可能是因为花生壳的目数越大,单位质量花生壳的表面积就越大,所提供的吸附活性位点越多,使去除率提高。但花生壳粒径越小,后续的离心和过滤难度将增大。因此选用100目的花生壳进行实验。
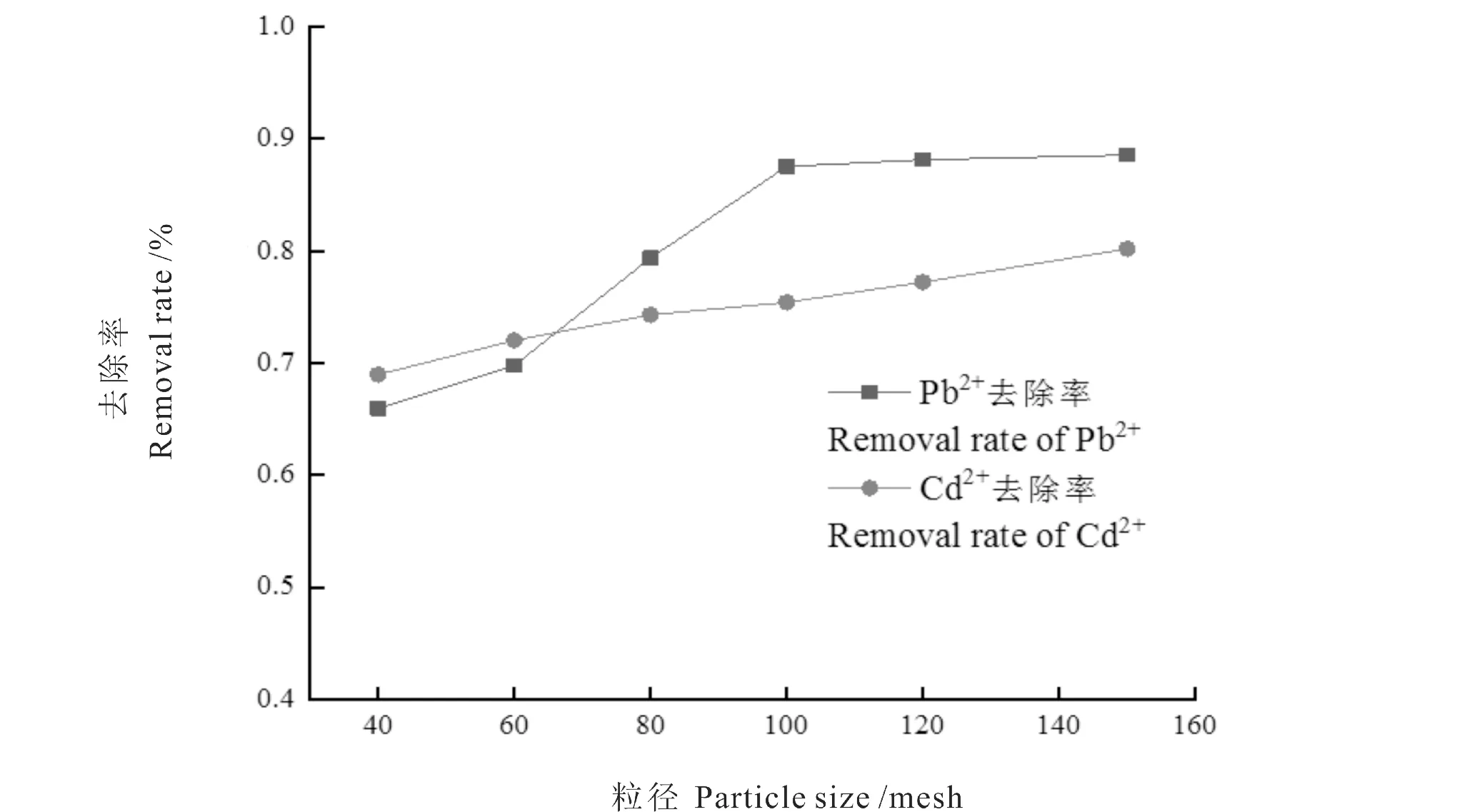
图3 花生壳的粒径对Pb2+和Cd2+去除率的影响Fig.3 Effect of peanut shell particle size on the removal rate of Pb2+and Cd2+
2.1.4 初始浓度的影响
从图4可见,去除率取决于重金属离子的初始浓度。去除率随Pb2+和Cd2+浓度的增加而降低,其中Pb2+去除率变化不大,而Cd2+去除率降低显著。对于一定量的花生壳,重金属离子的吸附活性位点是有限的,重金属离子浓度较低时,吸附能力较强的活性中心优先被占据,而随着初始浓度的增加,药液中总的重金属离子也增加,由于强吸附活性位点达到饱和状态,此时再占据活性较弱的吸附中心,因此更多的重金属离子在较高浓度药液中未被吸附,而导致较低的吸附率[21-22]。另外,也可能是由于静电排斥作用和重金属离子之间竞争吸附有限的活性位点,以及在较高重金属离子浓度下Pb2+或Cd2+的活度系数较低所造成[23-24]。从图中还可看出,随着重金属离子浓度的增加,Pb2+的去除率远高于Cd2+,说明Pb2+与花生壳的吸附反应能力强于Cd2+,吸附剂对Pb2+的选择性、吸附亲和性优于Cd2+,同时Pb2+与Cd2+之间还存在竞争吸附且两种离子的吸附相互干扰。
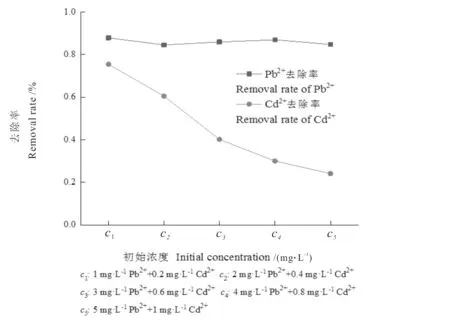
图4 初始金属离子浓度对Pb2+和Cd2+去除率的影响Fig.4 Effect of initial metal ion concentration on the removal rate of Pb2+and Cd2+
2.1.5 不同农林废弃物对重金属的吸附能力的影响
从图5 可知,三种农林废弃物对药液中的Pb2+和Cd2+去除效果存在差异,但去除率均在55%以上,总的吸附性能为:花生壳>稻壳>玉米芯,其中,花生壳对Pb2+和Cd2+的吸附效果最好,分别达87.56%和75.44%,可能是花生壳的比表面积较大,或含有的吸附活性位点较多,因此花生壳有更好的吸附性能。
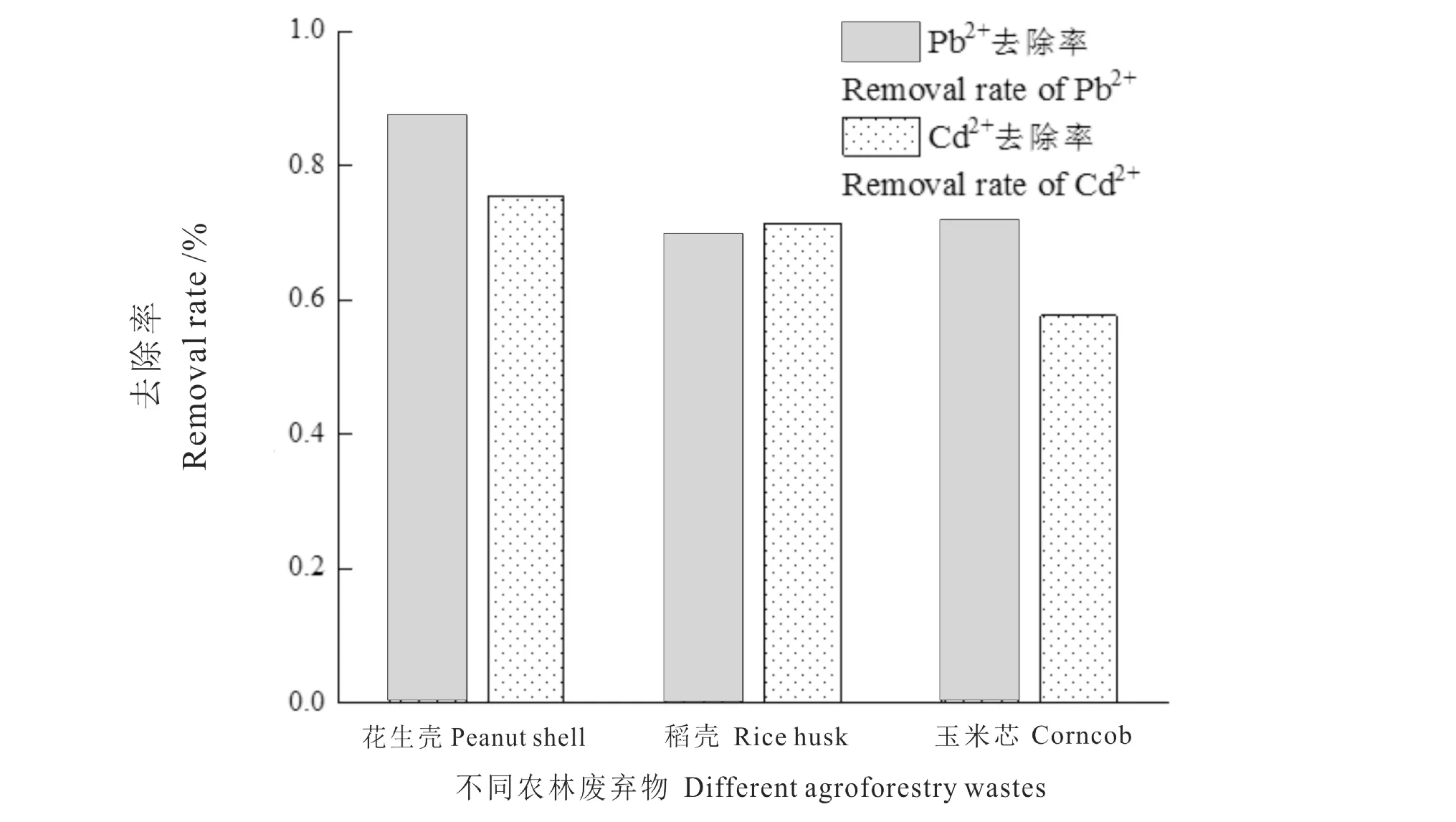
图5 不同农林废弃物对Pb2+和Cd2+的吸附能力比较Fig.5 Comparison of the adsorption capacity of different agroforestry wastes for Pb2+and Cd2+
2.2 吸附前后药液主要化学成分的变化结果与分析
2.2.1 含固量
分别准确移取吸附重金属前后的白芍药液25.00 mL于已恒量的蒸发皿,水浴浓缩至干后转至烘箱于105℃干燥至恒量,称质量。结果显示,经过花生壳吸附后,白芍药液含固量由0.023 17 g/m L变为0.022 16 g/m L,含固量减少4.586%,说明吸附重金属后,药液含固量略有减少。
2.2.2 色谱条件
Hypersil Gold C18色谱柱(4.6 mm×250 mm,5μm);流动相:乙腈(A)和0.05%磷酸水溶液(B);检测波长为230 nm;柱温35℃;流速1 mL/min;进样量10μL;采集时间65 min。采用梯度洗脱,程序见表1。
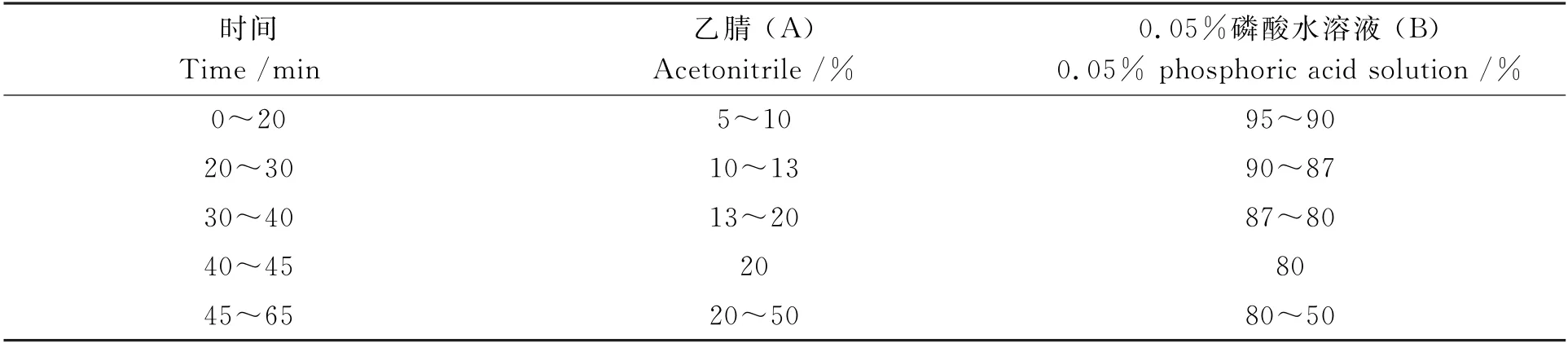
表1 梯度洗脱程序Table 1 Gradient elution procedure
2.2.3 芍药苷含量的测定
准确称取芍药苷对照品适量,分别加甲醇定容,制成1 mL 含0.063、0.315、0.630、1.050和2.100 mg的对照品溶液。分别准确移取10μL注入HPLC,测定峰面积。以浓度为横坐标,峰面积为纵坐标,进行线性回归处理。芍药苷的线性回归方程为y=0.226 4x-5.905,R2=0.999 7。图6为芍药苷对照品的HPLC图。

图6 芍药苷对照品的HPLC图Fig.6 HPLC chromatogram of paeoniflorin reference substance
吸附重金属前后的白芍药液,经0.22μm 的微孔滤膜过滤后,准确移取10μL注入HPLC,测定药液中主要有效成分芍药苷的含量。结果表明,吸附重金属前后,白芍药液中芍药苷的含量分别为1 884.355 1 mg/L和1 819.443 5 mg/L,仅损失了3.44%,这说明花生壳对白芍药液中芍药苷没有明显的吸附作用。
2.2.4 吸附前后的HPLC图谱分析
吸附重金属前后的HPLC图谱见图7。为了考察吸附重金属前后,白芍药液中主要的化学成分变化情况,对色谱图中各主要色谱峰(主要色谱峰的数量和峰面积)进行比较。
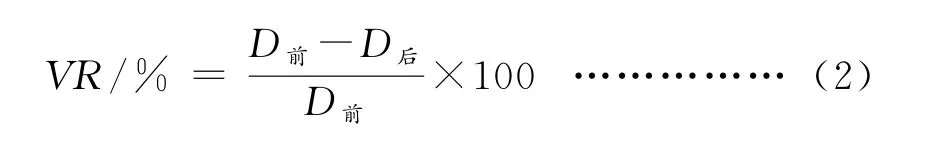
式中,VR/%表示吸附重金属前后保留时间或峰面积的变化率,D前表示吸附前保留时间或峰面积的数值,D后表示吸附后保留时间或峰面积的数值。
表2可知,花生壳吸附白芍药液重金属前后的HPLC图谱中,各主要色谱峰数量和峰面积都没有明显变化(仅有一些次要的色谱峰的峰面积发生明显改变,如8号峰、10号峰)。结合含固量(损失4.586%)考虑,表明白芍药液经花生壳处理重金属后,其主要的化学成分未有明显改变。
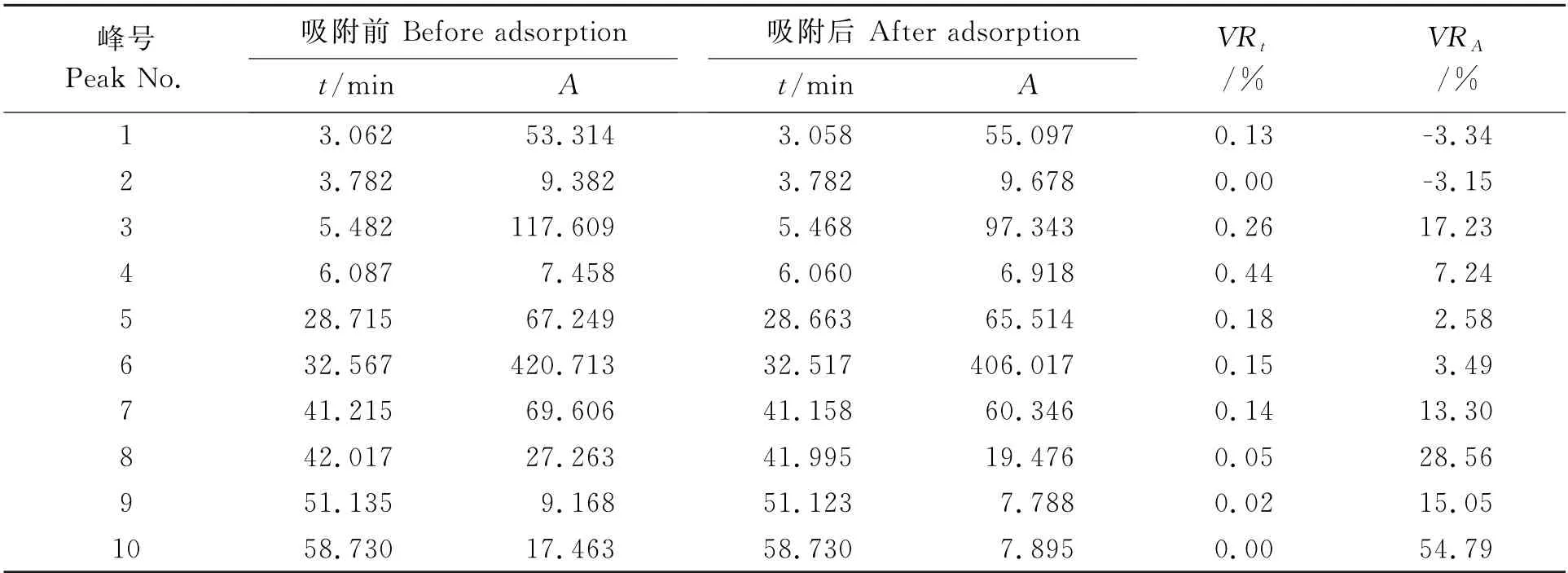
表2 吸附Pb2+和Cd2+前后白芍药液共有峰保留时间和峰面积的变化Table 2 Changes of retention times and peak areas of common peaks from aqueous extract of Paeoniae Radix Alba before and after adsorption of Pb2+and Cd2+
2.3 吸附机理
2.3.1 红外光谱分析
花生壳吸附白芍药液中Pb2+和Cd2+前后的红外光谱见图8。花生壳表面含有丰富的含氧官能团。3 409 cm-1吸收峰为O-H 伸缩振动峰,提示有醇类和酚类物质,这也表明花生壳中存在纤维素和木质素,有利于吸附重金属离子[25]。2 925 cm-1处的峰为花生壳中木质素结构中甲基和亚甲基的C-H 伸缩振动峰[26]。1 649 cm-1的峰归属于酮基中C=O特征伸缩振动峰。1 512 cm-1的峰来自于木质素的芳香环的C=C伸缩振动峰。1 426 cm-1的峰是羧基中C-O 伸缩振动引起。1 099 cm-1处的峰为半纤维素和纤维素的C-OH 伸缩振动峰[27]。在1 000 cm-1以下吸收峰比较复杂,不易确定某种官能团的伸缩振动[28]。吸附前后,花生壳的红外光谱的谱带基本保持不变,表明官能团没有发生变化。但是吸附后,O-H 和C-H 振动峰,分别向低波数移动了约4 cm-1和1 cm-1,酮基中C=O和C-OH 振动峰分别向高波数移动了约4 cm-1和1 cm-1;而且在1 400~3 500 cm-1之间的振动峰强度有所增强,可能吸附后,这些官能团的相对含量增多[29]。因此,对比吸附前后的波数和峰强,可知花生壳中的O-H、C-H、C=O、C=C、C-O 基团是花生壳吸附重金属离子的主要官能团。
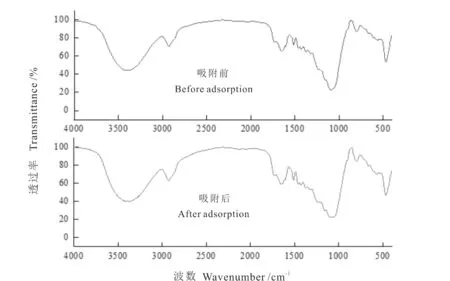
图8 花生壳吸附Pb2+和Cd2+前后的红外光谱Fig.8 FTIR spectra of peanut shell before and after adsorption of Pb2+and Cd2+
2.3.2 扫描电镜分析
SEM 常用于观察物质的微观结构。从图9可知,吸附重金属后的花生壳表面形态与吸附前的花生壳略有不同。在相同倍率(2 500倍)下,吸附前,花生壳表面分布着不规则的和不同大小的孔径,表面相对光滑;但是吸附重金属后,其表面变得略微粗糙,这可能是因为重金属离子吸附在花生壳表面并浸渍到花生壳内部。这与Shan等通过热解花生壳制备生物炭处理重金属前后的形态类似[30]。

图9 花生壳吸附Pb2+和Cd2+前后的SEM 图Fig.9 SEM morphologies of peanut shell before and after adsorption of Pb2+and Cd2+
2.3.3 X 射线衍射分析
XRD分析可用于研究物质的物相和晶体结构。吸附重金属前后的花生壳XRD图谱见图10。从图中可以看出,吸附前的花生壳XRD图谱与吸附后的花生壳基本相同,在2θ=22°和16°分别有一个主峰和次峰,这2个衍射峰是纤维素的特征峰。主峰代表排列比较规则的“结晶”纤维素结构,次峰代表有序度较低的“无定形”纤维素结构[31]。结晶度是指结晶纤维素的量与样品物质(包括结晶和无定形纤维素)总量的比值。通过Jade 9分析,发现花生壳结晶度为44.31%,吸附后的花生壳结晶度略微降低至43.67%,这可能是因为纤维素结构中的羟基氢键被打破,导致结晶度降低[32]。
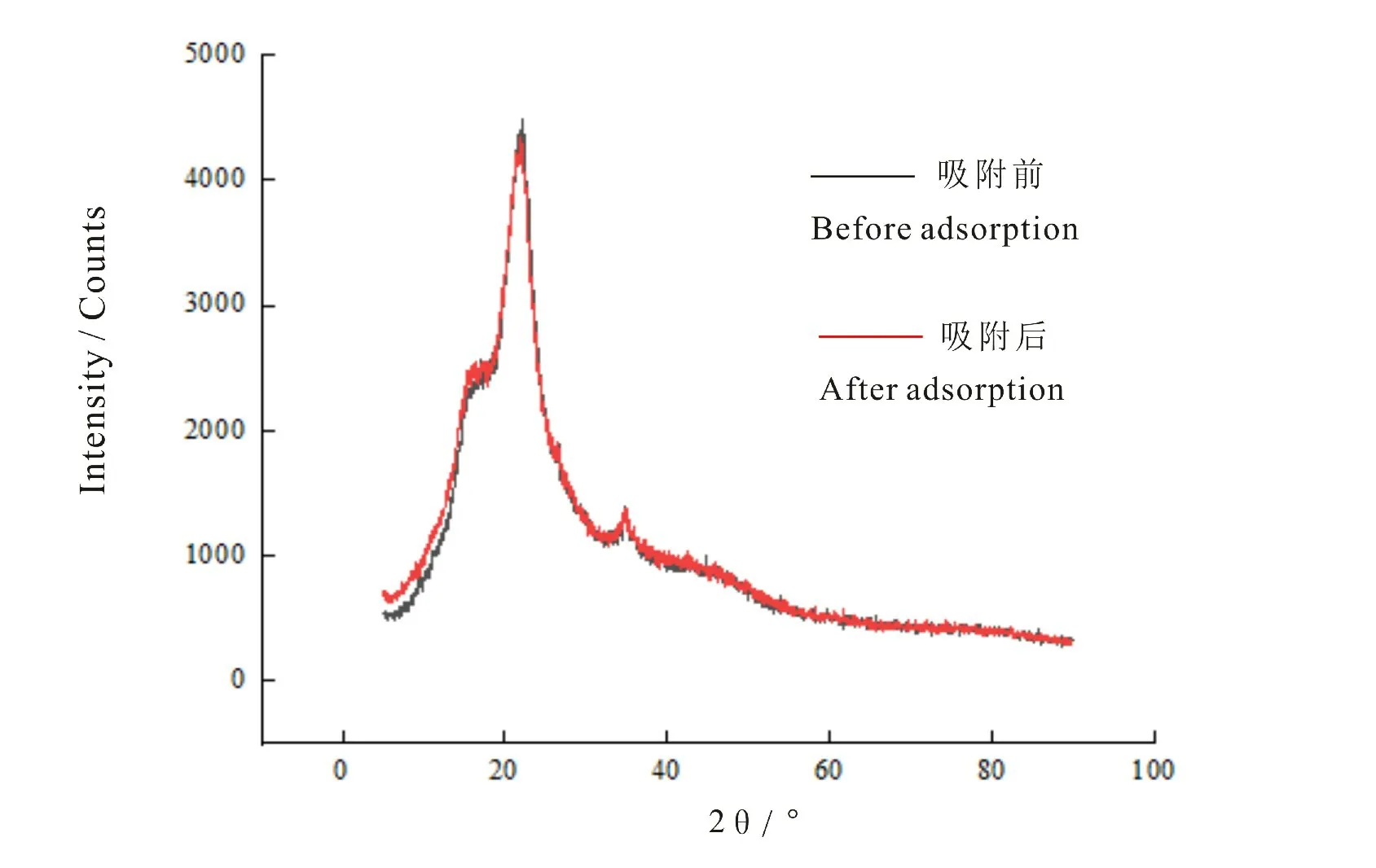
图10 花生壳吸附Pb2+和Cd2+前后的XRDFig.10 X-ray diffraction patterns of peanut shell before and after adsorption of Pb2+and Cd2+
花生壳吸附重金属离子的机理非常复杂,通过FTIR、SEM 和XRD 分析可知,其机理可能主要包括物理吸附和化学吸附。其中,物理吸附主要包括表面和孔道内部的吸附、表面沉淀、扩散等;化学吸附主要包括表面络合和离子交换[30,33]。其吸附机理见图11。
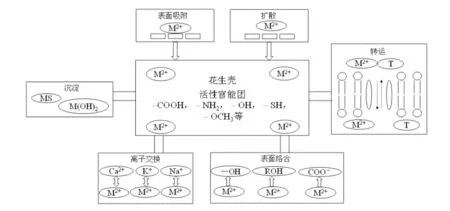
图11 花生壳的吸附机理[30,33]Fig.11 The mechanism of adsorption by peanut shell
3 结论
本文首次采用花生壳吸附中药中两种重金属(Pb2+和Cd2+),得出如下结论:
(1) 在p H 5.0的含Pb2+和Cd2+初始浓度分别为1 mg/L和0.2 mg/L的50 mL白芍水提液(100 g/L)中,加入3.8 g 100目的花生壳,室温下振荡(150 r/min)2.5 h,Pb2+和Cd2+的去除率分别高达87.81%和75.42%,药液中残留Pb2+和Cd2+远低于《中国药典》2020版中药重金属的限量标准 (铅≤5 mg/kg,镉≤1 mg/kg)。
(2) 不同农林废弃物对重金属的吸附能力为:花生壳>稻壳>玉米芯。
(3) 吸附重金属前后,药液的含固量、主要成分芍药苷的含量和HPLC图谱均未有明显变化,说明花生壳吸附Pb2+和Cd2+后,不会引起中药中主要化学成分的变化。
(4) 吸附重金属前后的花生壳FTIR 分析表明,花生壳中的O-H、C-H、C=O、C=C、C-O基团是花生壳吸附重金属离子的主要官能团。SEM 分析则表明,花生壳表面可见许多不规则的和不同大小的孔径,吸附后,花生壳表面的光滑程度发生改变,说明花生壳与重金属之间发生了吸附反应。花生壳的XRD 分析显示了纤维素材料的典型光谱,吸附后的花生壳纤维素晶型没有明显变化,但纤维素的结晶度略微降低。
(5) 花生壳对Pb2+和Cd2+的吸附主要为物理吸附和化学吸附。
本研究所采用的花生壳具有经济、环保和安全等特点,是一种去除中药重金属的有效吸附剂,且不会引入新的杂质以及污染中药,实现了农林废弃物的资源化再利用。
