可吸收抗菌胆道支架的制备及其生物相容性研究
2022-12-01傅俊辉戴晨怡刘烨磊李张辉竺亚斌陆才德
傅俊辉 ,黄 静 ,徐 锐 ,戴晨怡 ,刘烨磊 ,李张辉 ,骆 阳,竺亚斌,陆才德*
(1.宁波大学 医学院,浙江 宁波 315211;2 宁波大学附属李惠利医院,浙江 宁波 315048)
随着组织工程的发展,生物降解可吸收支架已成为医学与材料科学交叉领域的研究热点[1-3].可降解支架主要由聚L-丙交酯(Poly (L-lactide),PLLA)、聚二氧六酮(Polydioxanone,PDO)、聚氨酯(Polyurethane,PU)和可降解镁合金等材料制成,这些可生物降解的支架由于其良好的生物相容性、物理性能、可降解性和可修饰性,在胆道狭窄的治疗和组织修复中发挥了重要作用[4-7].胆道支架的材料从最初的橡胶到现在常用的塑料或自膨胀金属,仍然存在许多缺点[8].例如,塑料支架易堵塞、移位,需要频繁更换;钛合金支架类的金属不仅价格昂贵,更重要的是患者需经二次手术将其取出,增加了患者痛苦和经济负担.生物可降解胆道支架(Biodegradable Biliary Stent,BDBS)安全有效且无需更换,提供了治疗胆道疾病的新方向与新方法,具有广阔的应用前景.
理想的BDBS 应具备以下特性[9]: (1)降解性.降解产物可排放或吸收,不会在人体中积累.(2)良好的生物相容性.支架及其降解产物必须无毒、不致畸,不会引起凝血、溶血、免疫排斥.(3)支架必须具有良好的物理特性,具有与金属支架相同的膨胀率和径向力.(4)可修饰性.可以将药物分子或细胞装载在支架表面或者内部,以达到治疗的目的.Siiki 等[10]在猪模型中比较了金属和PLLA 胆道支架治疗胆道狭窄的蛋白表达水平,结果是蛋白表达有很大的不同,提示了不同愈合机制的胆道组织.Tannimoto 等[11]也评估了在猪胆总管端吻合模型中由聚乳酸-ε 己内酯共聚物制备的BDBS,期间未发生不良事件,术后6 个月,支架自然降解.然而,PLLA 由于较为僵硬,强度大,且韧性有限,短时间植入后,脆性较大.
胆道支架植入术后再狭窄是另一个重要问题.主要是因为细菌感染和微生物膜的形成[12],容易产生胆泥淤积,造成支架堵塞.如何减少胆道感染,提高支架的通畅度甚至患者生存率[13],都是困扰人们的难题.迄今为止,临床上具有良好生物降解性的抗菌胆道支架还很少[12].
本文基于上述研究背景,设计了一种新型生物可降解支架,由不同质量比的聚(L-丙交酯-coε-己内酯)(poly(L-lactide-co-ε-caprolactone),PLCL)和聚L-丙交酯(Poly (L-lactide),PLLA)混合物制成,并在支架表面涂上聚六亚甲基胍盐酸盐(PHMG),使其具有抗菌和抗再狭窄功能.同时,对它们的理化性质、抗菌活性、生物相容性和通畅性进行体内外研究.
1 材料和方法
1.1 材料及支架准备
文中所需PLCL 购自济南岱罡生物材料有限公司,质量进料比为80:20(丙交酯:己内酯),黏度系数为3.4.PLLA 是由中国科学院宁波材料技术与工程研究所提供,相对分子质量为200 000 D.
支架基材料的制备过程: 将PLCL 与PLLA 按不同质量比例混合(PLCL:PLLA=100:0、75:25、50:50、25:75、0:100),分别命名为P100-0、P75-25、P50-50、P25-75和P0-100.然后将不同质量比例的材料(共2 g)溶于1,4-二氧六烷(20 mL)中,60 ℃下持续溶解24 h.稍冷却后,将溶液均匀倒入在直径为100 mm的玻璃培养皿上,于室温下自然挥发溶剂24 h,最后得到约0.5 mm 厚的薄膜.
从得到的薄膜上切下一个10 mm×10 mm 的矩形薄膜.将薄膜平均分为两边,在每边上对称地开3 个孔,然后在薄膜两端用1,4-二氧六烷将其黏住,形成管状的带孔支架(制作过程中与空气接触的薄膜表面为外表面,与玻璃皿接触的表面为内表面).最后形成的支架外径3.0 mm,内径2.0 mm,支架长度10 mm.
1.2 理化表征
1.2.1 拉伸试验
在PLCL 与PLLA 不同比例制备的薄膜上截下10 mm×60 mm 的矩形长条,用夹具将各种比例的长条夹在1 kN 拉力机(Zwick Roel,德国科唯仪器)上以测试其力学性能.预载为0.01 N,拉伸模量测试速度50 mm·min-1.所有试验重复3 次,最后记录数据,绘制曲线图.
1.2.2 压缩试验
将不同比例薄膜制成的管状有孔支架平行放置在拉力机(Instron 3366,美国)上进行压缩测试,施加压力为100 N,加载速率20 mm·min-1.所有试验重复3 次,最后记录数据,绘制曲线图.
1.2.3 扫描电镜
在扫描电子显微镜(Scanning Electron Microscope,SEM)(Regulus 8230,日本日立)下观察薄膜外表面的表面形貌.
1.2.4 降解试验
选取力学性质与电镜显微形貌表观最佳的共混物P50-50薄膜进行试验.根据Sörensen模型[14],将96.5 mL Na2HPO4(133 mmol·L-1)与3.5 mL KH2PO4(133 mmol·L-1)混合得到100 mL 溶液,制成模拟胆汁液,pH 值为8.4,作为胆道组,PBS (pH 7.2)溶液为对照组.在2 组溶液中各放入3 种不同形状(n=3)、相同质量的薄膜,以便于区分与计算质量.薄膜预先经过紫外灭菌处理,降解环境温度为37 ℃,避光,每周检测溶液的pH 值,当pH 值低于阈值(对照组pH<7,胆道组pH<8)时,更换溶液.分别在7、14、21、28 d 时,取出各组薄膜样本,烘干后称量.计算方式:

式中:m0为样品的初始质量;md为某天的质量.
同时,用SEM 观察28 d 时外表面与内表面的形貌.
1.3 抗菌测试
选用力学性能和显微形貌最佳的P50-50薄膜作为试验样品,P100-0作为对照.2 组薄膜制成直径为6 mm 的小圆片,其中一组浸泡在1%的PHMG/去离子水(10 mL)中,另一组浸泡在去离子水(10 mL)中,其中PHMG 纯度>99%,相对分子质量20 000~25 000 D,购于麦克林生化有限公司.涂覆后的样品分别命名为PP100-0和PP50-50.
以往资料显示,胆管细菌感染相关的细菌主要有金黄色葡萄球菌(S.aureus)、大肠杆菌(E.coli)、肺炎克雷伯菌(K.pneumonia)、粪肠球菌(E.faecalis)和铜绿假单胞菌(P.aeruginosa)[15-18].因此本试验采用下列菌种的国际标准菌株: 金黄色葡萄球菌(ATCC25933)、大肠杆菌(ATCC25922)、肺炎克雷白杆菌(ATCC700603)、粪肠球菌(ATCC29212)、铜绿假单胞菌(ATCC27853).
首先进行抑菌圈试验.取直径100 mm 的无菌培养皿,倾入经高压灭菌后的牛肉膏蛋白胨培养基20 mL,冷凝后制成平板.取700µL 稀释后的菌液于培养基表面,使菌液均匀展开,至菌液完全覆盖于培养基表面,制成含菌平板.将对照组(P100-0、PP100-0)与试验组(P50-50、PP50-50)圆片分别贴放在含菌平板的4 个方位.放入37 ℃培养箱中培养24 h 后取出观察,用游标卡尺精确测量每个圆片周围抑菌环直径的大小(mm),测3 次取平均值.根据文献[19]标准,将抑菌环直径>7 mm 的样本认作有抑菌作用,整个操作在超净台中进行,防止杂菌污染.所有试验重复3 次.
本研究还测试了包覆样品PHMG 的释放特性.首先将1 mg·mL-1的PHMG/PBS溶液在紫外分光光度计(U3010,日本日立)下测出最适吸光度(波长为203 nm).之后以1 mg·mL-1为起始质量浓度,依次对半稀释,用紫外分光光度计测定波长在203 nm处的吸光度值,绘制PHMG 标准曲线.
将上述包覆PHMG 的小圆片PP50-50置于PBS(10 mL)中,环境温度37 ℃,测定吸光度与时间的关系,根据标准曲线得到相应的PHMG浓度,并绘制浓度随时间的释放曲线.所有试验重复3 次.
1.4 体内试验
ICR 小鼠(6 周龄)和SD 大鼠(2 月龄)由宁波大学医学院实验动物中心提供.所有动物试验均遵循宁波大学伦理委员会的指导原则进行.
将ICR 小鼠随机分为4 组,每组9 只(n=3).所有小鼠采用异氟烷吸入麻醉.以P100-0和PP100-0为对照的P50-50和PP50-50样品(5 mm×8 mm)植入动物背部皮下.分别在7、14、28 d 后,对动物进行过量麻醉处死,收集标本进行进一步评估.
由于缺乏可行原位试验的大型动物,本研究设计了十二指肠置管的动物模型,研究支架的通畅性,为支架在动物体内的通畅性、移位性和生物相容性提供一些有价值的参考.在SD 大鼠十二指肠内植入聚合物支架(包覆聚PHMG 和不包覆PHMG).每组9 只大鼠分别在7、14、28 d 时过量麻醉后处死,观察各组大鼠十二指肠状态.然后收集十二指肠和支架进行以下试验.
1.5 组织学和免疫荧光分析
标本用PBS 进行冲洗,4%多聚甲醛固定,OCT(Sakura,美国)包埋,-20 ℃下用切片机(Leica CM1950,德国)切成4~6 μm 的组织切片,采用HE染色,观察标本形态特征.另一方面,用抗CD11b作为一抗进行免疫荧光染色(CD11b 常用于标记分化后的单核细胞、巨噬细胞、NK 细胞等免疫细胞).最后用Image J 软件对结果进行处理.
1.6 统计分析
所有试验数据均以“均数±标准差(SD)”表示.采用SPSS 23.0 软件进行统计学分析,采用单因素方差分析或t检验(n≥3),P<0.05 为差异具有统计学意义.
2 结果
2.1 材料力学性能
拉伸和压缩测试的结果如图1 所示.由图可见,在这些共混物中,P50-50在拉伸和压缩试验中具有最高的强度和应变能力,而聚合物P0-100(PLLA)和P100-0(PLCL)表现较差.P0-100虽然具有较好的应变能力,但其强度却较弱.同样,P100-0的强度和应变能力都较低,抗压性能也是最差的.

图1 不同比例的拉伸—应变(a)及压缩—应变(b)曲线
电子显微镜下观察与空气接触的表面(外表面)形貌(图2).由图可见,P100-0的表面结构比较平坦光滑,而P50-50和P0-100的表面结构比较不均匀,突出部分较多,在高倍下显示较多孔隙.表面粗糙的材料预计更有利于细胞附着和生长.由此可见,P50-50具有优良的力学性能和形貌粗糙度,因此选择其作为接下来的研究主体.

图2 在扫描电镜下薄膜外表面的形貌
2.2 降解特性
在28 d 的过程中,样品P50-50在模拟胆汁中表现出较大的质量损失(19.6%±0.67%),而在PBS 中几乎没有损失(图3).其原因可能与胆汁的碱性环境有关,并且粗糙的表面结构也加速了液体的浸润,从而促进了聚合物的降解.电镜结果也同样显示(图4),2组与空气接触的表面(T.A)几乎没有变化,但胆道组出现少量孔隙.并且胆道组在接触玻璃皿的表面(T.G)腐蚀较严重,而对照组仍较为平整.2 组均无断裂或分离.因此,在整个试验中,P50-50的质量虽然有所降低,但仍能很好地保持原来的状态和功能.
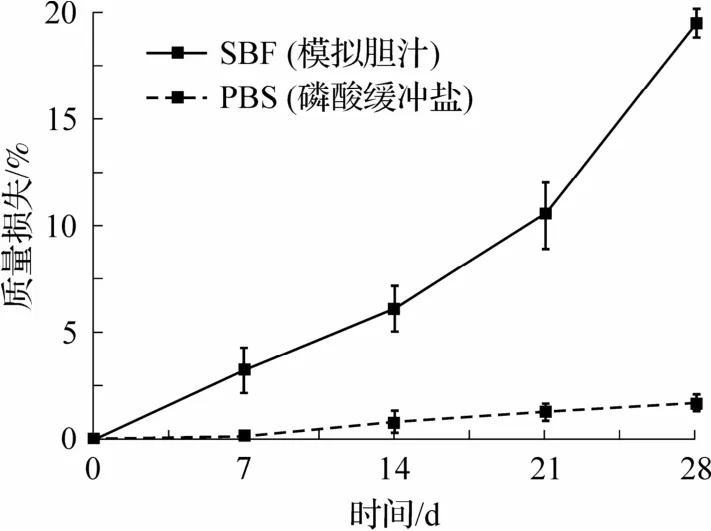
图3 样品质量损失随时间的变化

图4 第28 天扫描电镜观察薄膜的表面形貌(P50-50)
2.3 抗菌活性
抑菌圈结果显示,PP50-50和PP100-0抑菌活性均优于未覆盖聚六亚甲基胍盐酸盐的材料(图5),并且抑菌圈直径均在7.0 mm 以上,表明PP50-50和PP100-0对上述5 种细菌均有较好的抗菌效果.从统计学分析来看,PP50-50对金黄色葡萄球菌和铜绿假单胞菌的抑菌效果显著优于PP100-0(P<0.05,图6).
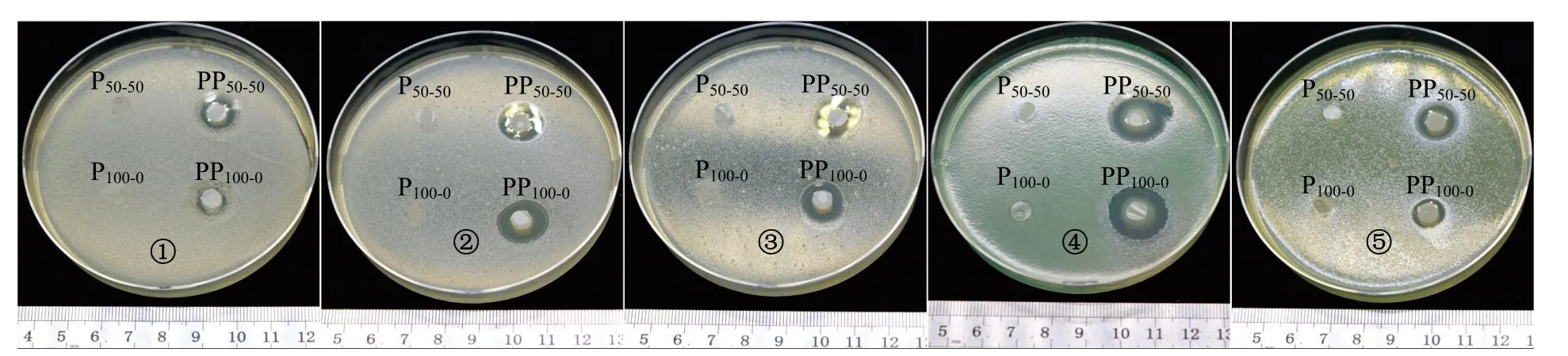
图5 各菌种的抑菌圈示意图

图6 各组抑制圈直径对比
从PHMG 释放量和抗菌活性连续性两个方面考察材料的释放特性(图7).结果表明,P50-50释放出的PHMG 浓度在24 h 时达到峰值,之后出现显著下降,并在336 h 基本保持不变(图8).这些结果表明,PHMG 在开始阶段是持续释放.24 h 后,P50-50在PHMG 中的释放和再吸附达到平衡,最终释放浓度达到稳定状态.
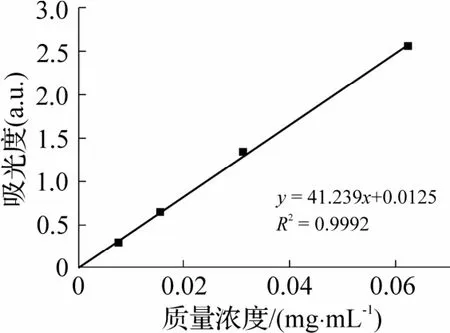
图7 PHMG 标准曲线

图8 P50-50 上PHMG 的释放曲线
2.4 生物相容性研究
将2 对P100-0和PP100-0、P50-50和PP50-50分别植入小鼠背部皮下,探究其生物相容性.结果如图9 所示,在7~28 d 中,各组创面逐渐修复.28 d 时的皮肤几乎完全痊愈,只有在剃完毛后观察到有轻微的疤痕痕迹.整个恢复期未见溃疡或脓肿发生,小鼠均未发生死亡.PHMG 涂覆组与未涂覆组间无明显差异.说明本试验所用的材料安全无毒.

图9 小鼠皮下实验结果(由上至下分别为创面概览、组织观察及组织切片HE 染色结果)
取下标本后,植入材料与组织无黏连,材料无破损及裂解,仍呈透明状.与正常组织相比,植入材料周围的皮肤组织在7 d 时稍模糊,暴露的结缔组织较多,血管略不清.14、28 d 时,各组材料与组织的接触面变为清晰,材料周围结缔组织减少,变为澄清,可见明显的血管纹路,并且无异物反应.
HE 染色结果显示,与正常组织相比,各标本7 d 时炎症细胞浸润明显,但无水肿及坏死的表现.14 d 时炎症减轻,28 d 时炎症明显减轻,并趋于正常.P100-0组和P50-50组在7~28 d 时的结果与PP100-0组和PP50-50组的结果相似.但相对而言,PP100-0和PP50-50植入的组织在28 d 时比P100-0和P50-50植入的组织更清晰,血管纹路更明显.
2.5 大鼠肠道通畅性试验
选用PP50-50制成的支架置入大鼠十二指肠内,如图10 所示,以P50-50制成的支架为对照,测试其通畅性、支撑性及是否会发生移位.在试验过程中,没有老鼠死亡.大鼠进食正常,表明大鼠未发生肠梗阻.各组肠壁均未发生溃破及穿孔,置管处肠段略宽于正常肠段,取下置管处肠段时,观察到管子未发生形变(图中箭头所指),未断裂及裂解.由此可见管子在肠内也具有一定支撑性,且强度足够,能较好地维持之前状态,且不易突破肠壁组织.游离完周边结缔组织后,可观察到相对于7 d 和14 d时的肠壁组织恢复较好,已具有较完整的形态,无溃疡,只有少量充血.并且,PP50-50置入后的组织比P50-50置入后的组织更正常,充血更少.

图10 大鼠十二指肠内置入支架
收集组织进行切片并HE 染色,P50-50和PP50-50标本肠壁周围黏膜组织在7 d 时均表现出明显的炎症浸润,且出现少数异形巨细胞.但在14 d 时较正常组织炎症有所减少,并且未发现异形巨细胞.以上试验也同样证明了材料具有良好的生物相容性.7 d 与14 d 时,均可以看见明显的支架轮廓,证明支架可以在肠内具有良好支撑性.然而,支架在术后28 d 消失.由于降解试验中的P50-50在28 d 内不可能完全降解或只发生部分裂解,因此我们猜测可能是由于十二指肠的强酸性环境可能会加速固定的缝线裂解,还有一种可能是因为大鼠肠道蠕动较为剧烈而发生移位.
各标本进行免疫荧光染色,观察组织恢复情况.28 d 时虽未找到材料,但仍取十二指肠肠段进行免疫荧光测试.标本用CD11b抗体标记,反映炎症浸润情况.荧光强度在7 d 最高,14 d 减弱,28 d未检测到(图11),荧光强度的半定量分析也证实此结果(图12),但各天数时P50-50与PP50-50的荧光强度并没有统计学上的差异(P>0.05).这证实了研究材料作为体内支架具有良好的生物相容性.
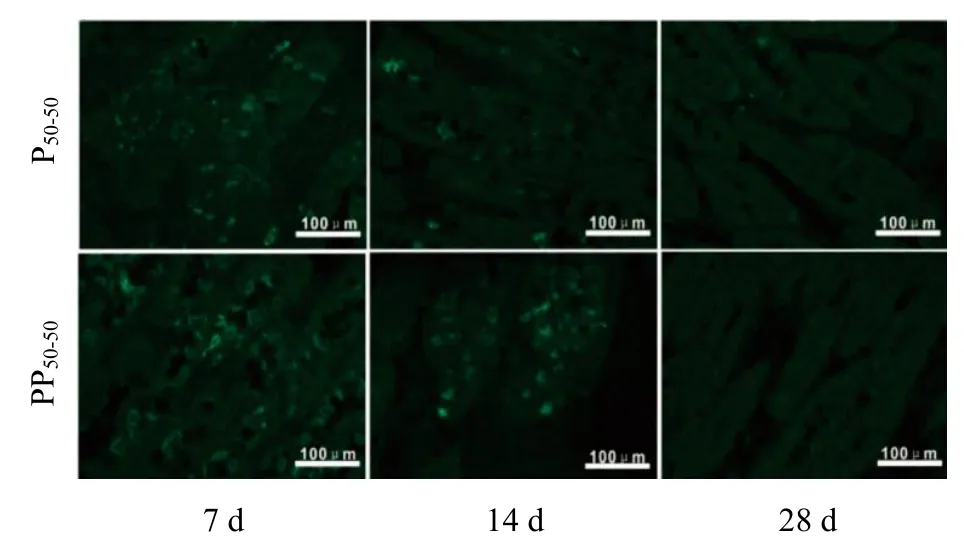
图11 以抗cd11b 为一抗进行免疫荧光染色
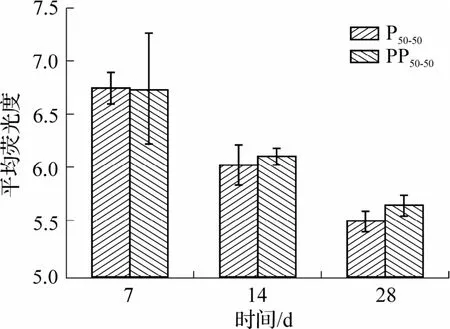
图12 免疫荧光平均荧光强度的半定量结果
3 讨论
本研究将PLCL 和PLLA 按不同质量比例混合,对其理化性质进行测试.材料的拉力测试与支架的压缩测试的结果显示,P50-50薄膜及其制备成的支架力学性能均是最好的,相比于P100-0和P0-100,强度和延展性都得到了提升.并且研究中的支架采用了开孔处理,相信这些小孔能有利于组织与支架的黏附,可增加支架的通畅性,阻止再狭窄的情况发生.本研究中的力学性能检测原因有以下三点:(1)PLCL 作为一种非晶态聚合物,其结构中仍然含有少量PLLA 晶区,与结晶聚合物PLLA 混合后形成较均相体系,强度高于单纯PLCL;(2)PLLA完整的晶区对非晶聚合物PLCL 有增强作用;(3)非晶聚合物破坏了结晶聚合物PLLA 完整的晶区,对其有增韧作用,加强了其延展性.因此,本研究中得到了一种力学性能更为出色的生物可降解材料.电镜下的形貌与PLLA 相似,表面结构并没有较大改变,因此也有理由相信该材料适合于细胞的黏附与增殖,具有良好的生物相容性.
降解性能一直是考察生物可降解胆道支架的重点.日本之前的2 项研究中,在猪胆管内放置的PLCL支架均在6个月后降解消失[11,20];Girard等[14]制作的PLA-PEG-PLA 支架在体外模拟胆汁中降解,1 个月损失了20%的质量,3 个月时损失了85%的质量.文中样品P50-50在模拟胆汁中28 d 时损失了19.6%±0.67%的质量,但是试验结束后材料并没有裂解,表面甚至只有较小细纹.因此,在整个试验中,P50-50质量虽然有所降低,但仍能很好地保持原来的状态和功能,使动物在胆道完全修复之前能维持其通畅性.
目前普遍认为细菌黏附、生物膜形成和胆泥淤积是支架发生再阻塞的主要原因.一项回顾性研究表明,接受胆道支架植入术的患者在术后3 周到31 个月内发生胆道感染的概率高达25.5%,胆道感染使患者发生胆道再狭窄的概率从2.3%增加到了13.1%[21].所以开发理想的抗菌型胆道支架具有重要意义.PHMG 是一种带正电荷的胍类聚合物,可以与细菌细胞膜上带负电荷的羧酸盐、磷酸盐和其他物质发生静电作用,增加细胞膜的通透性,从而导致细菌死亡[22].我们试验中的PHMG 有着出色的抗菌效果,但是过度的抗菌能力不可避免地会导致PHMG对正常组织细胞的毒性,但我们设计的支架表面PHMG量极少,所以在皮下及肠内对正常组织细胞毒性较少.出于安全考虑,之后我们可以进一步对PMHG涂层进行修饰,如泊洛沙姆及透明质酸[23],以减少PHMG 的细胞毒性.PHMG 的释放试验也证实,虽然PHMG 只是简单涂覆在材料表面,但抗菌效果依然十分理想.并且后续可以加入纳米缓释的载药载体来达到想要的释放可控效果.
采用小鼠皮下植入的方法测试了材料的生物相容性.植入28 d内,2对材料(P100-0、PP100-0和P50-50、PP50-50)只表现出轻微的炎症反应,伤口没有化脓及溃烂,皮下组织也没有其他异常反应.并且PP100-0和PP50-50在28 d时与组织接触面的恢复情况要好于P100-0和P50-50,这也证明涂覆PHMG 的材料具有良好抗菌性能,且生物相容性也十分良好.
胆道支架时常也被应用于胆肠吻合术中,以防止吻合口狭窄,此时支架的一部分会暴露在十二指肠管腔内,与十二指肠黏膜接触;此外,与十二指肠内的食糜长期接触易造成支架阻塞,导致胆汁的引流不畅.因此可将P50-50和PP50-50制备成的支架置入大鼠十二指肠内,来检测该环境下支架的通畅性及与十二指肠黏膜的生物相容性.从HE染色结果来看,低倍与高倍镜下观察到的结果一致,炎症也只发生在初期,之后便消退.免疫荧光染色的结果也证实了此点.图10 箭头所指为支架所在位置,切片时由于支架与组织的力学性能相差悬殊,在染色操作时用流水冲洗处理组织切片,易使支架残片与组织分离,而被水流冲走,导致脱片.但即便如此,依旧可以清晰地看见支架轮廓,说明支架的力学性能足以支撑肠管使其扩张.遗憾的是在28 d 时未找到支架,我们猜测是由于试验所用缝线太过脆弱,在肠内酸性环境中发生腐蚀,而使支架脱落;又或许因为肠道本身的蠕动较为剧烈,导致支架脱落.参考自膨胀金属胆道支架与自膨胀生物可降解支架[24],支架可以引入自膨胀体系,一定程度上减少发生移位的可能性.总之,该支架在大鼠十二指肠内具备良好的通畅性,并具有良好的生物相容性.
本研究首次将PLCL 与PLLA 混合用于胆管支架的制作,经最大拉伸性、横向支撑力、表面形貌、体外降解性等基本表征,得到性能优良的PP50-50抗菌性可降解的胆道支架.同时,开展了支架在体内生物相容性及十二指肠内通畅性的研究.在力学性能、降解性、组织相容性及通畅性等方面,该支架均展现出了优异性能,是比较理想的胆道替代支架.
