共存Fe3+对水中腐殖酸/牛血清蛋白臭氧氧化过程的影响
2022-12-01吴冰滢张文皓张智琦曾边浩高华生
吴冰滢 ,张文皓 ,张智琦 ,曾边浩 ,李 兵 ,高华生*
(1.宁波大学 土木工程与地理环境学院,浙江 宁波 315211;2.浙江富莱迪环境设备有限责任公司,浙江 宁波 315031)
随着我国经济社会的快速发展和人们对生活品质需求的不断提高,饮用水入户水质已经不足以完全满足用户的用水需求[1].正常情况下,经自来水厂处理后的饮用水能够达到甚至优于国家的水质标准,而出厂的高品质饮用水在输配过程中仍可能存在被二次污染的风险[2-4].天然有机物(Natural Organic Matter,NOM)是典型的供水二次污染物,一般可分为腐殖质和非腐殖质两类,前者包括腐殖酸(Humic Acid,HA)和富里酸(Fulvic Acid,FA)等有机物,后者则包括蛋白质和氨基酸等有机物[5].我国新版《生活饮用水卫生标准》(GB 5749-2022)的颁布实施,意味着饮用水水质要求做到用户龙头水达标.因此,有关单位应该加大研发力度,探寻绿色安全的饮用水末端净化技术.
臭氧高级氧化技术能有效氧化水体中的有机微污染物,且其氧化过程几乎不产生副产物,被广泛应用于饮用水深度处理中[6].姬广雪等[7]对基于臭氧的高级氧化技术去除饮用水源腐殖质类NOM的研究作了综述,指出了存在的问题及未来发展的方向.与此同时,为解决臭氧对有机物的选择性氧化及低利用率等问题,催化臭氧氧化技术应运而生并不断发展[8].Beltrán 等[9]研究了铁型催化剂分别以均相和非均相形式对臭氧氧化水中草酸的催化效果及其反应机理,发现在均相催化中,臭氧与草酸的反应动力学为一级,而在非均相催化中,其反应动力学级数取决于臭氧进气浓度.Malvestiti等[10]的研究表明金属离子的添加可在臭氧氧化微污染物时实现同步消毒,抑制细菌再活化,从而减少臭氧消耗.杨艳丽等[11]研究发现Mn2+通过催化溶解在水中的臭氧产生氧化性更强的羟基自由基(·OH),使HA 的去除率从58.0%提高至82.3%,且Mn2+的最佳投加量为0.50 mg·L-1.Wang 等[12]综述指出包括Fe3+在内的多种金属离子在水处理领域的均相催化机理主要有两种,一是促进臭氧分解生成·OH,氧化各种有机物;二是与有机分子结合形成络合物,然后被臭氧和其他氧化物氧化.但目前学者们对Fe3+催化臭氧氧化机理的研究未考虑Fe3+对污染物自身产生的影响,从而导致其催化相态可能由均相转向非均相.鉴于此,在臭氧氧化过程中,Fe3+与污染物间相互作用的研究是非常有必要的.
本文以管道腐蚀产物Fe3+与供水典型腐殖质类和蛋白质类二次污染物为研究对象,从污染物的荷电和聚集特性及其与Fe3+间的作用出发,探究Fe3+在臭氧氧化污染物过程中产生的影响,以期通过臭氧高级氧化技术对饮用水进行管网末端治理,减轻二次污染对入户水质的影响,保障二次供水水质.
1 材料与方法
1.1 试验材料
腐殖质类污染物储备液: 称取1.0 g 腐殖酸(上海源叶生物)固体粉末溶解于0.10 mol·L-1的NaOH溶液,连续搅拌24 h 后用HCl 调节溶液pH 值至7.0±0.5,经0.45 μm 微孔滤膜过滤并定容至1 000 mL,最终得到浓度为40.00 mg·L-1的HA 储备液,置于4 ℃冰箱中保存.
蛋白质类污染物储备液: 称取50.0 mg 牛血清蛋白(Bovine Serum Albumin,BSA,上海捷瑞生物)固体粉末溶解于pH=7.0 的NaH2PO4/Na2HPO4缓冲溶液中,连续搅拌12 h 至充分溶解并定容至1 000 mL,即得到浓度为50.00 mg·L-1的BSA储备液,置于4 ℃冰箱中保存.
Fe3+储备液: 称取482.7 mg FeCl3·6H2O (上海阿拉丁)固体粉末充分溶解于去离子水中,并定容至1 000 mL,即得到浓度为100.00 mg·L-1的Fe3+储备液,置于4 ℃冰箱中保存.
试验用水: 将上述HA 和BSA 储备液分别用去离子水稀释至所需浓度,然后投加不同浓度的Fe3+,配制得到试验用水.
1.2 试验方法
由于《生活饮用水卫生标准》(GB 5749-2022)中对CODMn和Fe3+浓度的限值分别为3.00 mg·L-1和0.30 mg·L-1,故分别选择5.00 mg·L-1的HA 溶液和BSA 溶液及0.10~1.00 mg·L-1的Fe3+投加量范围来模拟一定程度二次污染的市政自来水,并在反应温度为(30±0.5)℃,水样pH 值为7.0±0.5 的条件下进行臭氧氧化试验,臭氧投加量通过调节臭氧发生器的放电功率来控制.
臭氧氧化HA 的试验为每隔10 min 取一次样,氧化BSA 的试验分别在溶液通入臭氧后的第5、10、20、30、45 和60 min 取一次样(其中在探究Fe3+投加量影响试验中增设第90 min 的取样时间).
臭氧氧化试验装置如图 1 所示,臭氧由ZCO-10 型臭氧发生器(广东中辰)产生,内置制氧单元,产生的臭氧通过曝气头以分散小气泡形式进入装有1 000 mL 水样的恒温水浴反应器中进行反应,过剩的臭氧通入碘化钾溶液尾气吸收,最后经排气管排到室外.

图1 臭氧氧化试验装置示意
1.3 分析方法
用紫外可见光分光光度计(北京普析)测定UV254表示HA 浓度(R2=0.999,y=0.0286x+0.0004),测定UV595(考马斯亮蓝染色法)表示BSA 浓度(R2=0.999,y=0.0354x+0.0414);用Zeta 电位纳米粒度仪(英国马尔文)测定溶液Zeta 电位和颗粒平均粒径;用碘量法(CJ/T 322-2010)测定气相臭氧浓度.
2 试验结果
2.1 Fe3+共存条件下有机污染物的臭氧氧化
2.1.1 臭氧投加量对有机污染物氧化效果的影响
不同臭氧投加量下,溶液中HA和BSA的去除效果如图2 所示.在整个反应过程中HA 去除率随臭氧投加量的增大明显提升,而BSA 去除率的提升并不明显.持续氧化60 min 后,投加1.92、3.12和6.00 mg·L-1臭氧的溶液中HA 与BSA 的去除率分别为45.3%、53.2%、61.9%与9.8%、12.0%、13.8%.值得注意的是,臭氧对BSA 的氧化效率远低于HA,这可能是因为蛋白质分子中的肽键难以被氧化,导致只有小部分BSA 分子能被臭氧氧化去除.综合考虑提高氧化效率和降低净化工艺成本以便于实际应用,后续试验中选择3.12 mg·L-1的臭氧投加量.
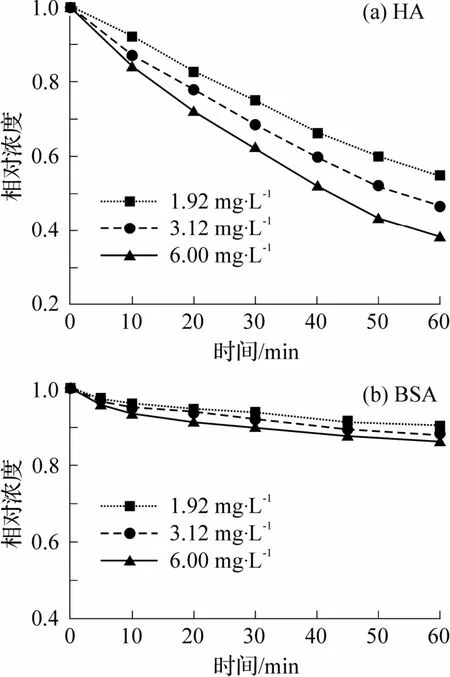
图2 臭氧投加量对污染物氧化效果的影响
2.1.2 Fe3+投加量对有机污染物氧化效果的影响
不同Fe3+投加量下,臭氧氧化HA和BSA的结果如图3 所示.

图3 Fe3+投加量对污染物氧化效果的影响
由图3(a)可知,随着反应的进行,HA 的去除率持续提升.但令人意外的是,Fe3+催化臭氧氧化HA的现象并没有出现,氧化过程中HA 的去除率随Fe3+投加量的增大反而降低.投加 0.10~1.00 mg·L-1的Fe3+后,经过70 min的氧化,HA的去除率分别为56.1%、54.7%、52.5%和46.0%,均低于不投加Fe3+情况下57.6%的去除率.与Fe3+投加量对臭氧氧化HA 的影响结果不同,从图3(b)中可以发现,氧化过程中BSA 的去除率随Fe3+投加量的增大而升高.在不投加Fe3+的情况下,BSA 的氧化速率相对缓慢,90 min 的氧化时间仅去除了12.4%的BSA;而在投加0.10~1.00 mg·L-1的Fe3+后,经过90 min 的氧化,BSA 的去除率分别可达14.7%、17.8%、24.4%和40.0%,其去除率较单独臭氧氧化有明显提升.
2.2 Fe3+对有机污染物聚集特性的影响
从上述试验结果中可以看出,臭氧对HA 和BSA的氧化效率大不相同,且Fe3+对两种污染物的氧化也存在不同影响.由于Fe3+是自来水中常见的管道腐蚀产物金属离子之一,故本节试验对HA 和BSA 的特性及Fe3+对其聚集特性产生的影响展开进一步研究.
2.2.1 有机污染物的荷电与聚集特性
不同浓度污染物体系的Zeta 电位如图4 所示.从图4 中可以看出,在1.00~5.00 mg·L-1浓度范围内,HA 溶液的Zeta 电位由-10.6 mV 降至-29.2 mV,体系稳定性有所提升;BSA 溶液的Zeta 电位由-16.7 mV 升至-14.4 mV,体系稳定性有所降低.整体来看,不同浓度下,HA 溶液的Zeta 电位变化幅度较大,而BSA 溶液的Zeta 电位则较为稳定,变化幅度较小.
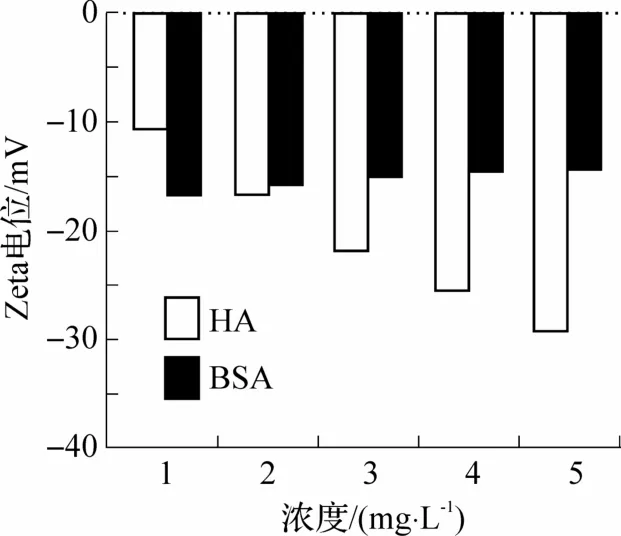
图4 污染物浓度对溶液Zeta 电位的影响
不同浓度污染物体系的颗粒平均粒径如图5所示.HA 溶液的颗粒平均粒径随其浓度的增大而减小;BSA 溶液的颗粒平均粒径随其浓度的增大而增大.究其原因,可能是由于溶液的Zeta 电位绝对值越大,分子间的斥力越大,分子间的氢键作用减弱,使HA 的自凝聚程度降低,导致其颗粒平均粒径减小[13].

图5 污染物浓度对颗粒平均粒径的影响
2.2.2 Fe3+投加量对臭氧氧化前后污染物体系Zeta电位的影响
不同Fe3+投加量下,臭氧氧化前后两种污染物溶液的Zeta 电位如图6所示,其中两种溶液的初始浓度均为5.00 mg·L-1.

图6 Fe3+投加量对臭氧氧化前后污染物体系Zeta电位的影响
从图6 可以看出,HA 溶液和BSA 溶液的初始Zeta电位分别为-29.2 mV和-14.4 mV,这表明两种污染物溶液均表现出了不稳定性.随着Fe3+投加量的增加,两种污染物溶液的Zeta 电位均随之升高,这表明投加Fe3+能够进一步破坏其稳定性.不难发现,HA 溶液的Zeta 电位在Fe3+投加量为0.10~1.00 mg·L-1范围内未发生电位逆转;而Fe3+投加量在0.10~0.20 mg·L-1范围内,BSA 溶液能够达到Zeta 电位零点并发生电位逆转.此外,臭氧氧化还能减小两种污染物溶液的Zeta 电位绝对值,使其体系趋向于不稳定,这可能是因为污染物表面的净电荷有所减少.
Fe3+作为一种常见的混凝剂,在过程中能与带负电的污染物颗粒吸附电中和,使颗粒表面的负电荷数量降低,导致其Zeta 电位逐渐升高.在达到Zeta 电位零点前,颗粒与Fe3+发生吸附电中和,溶液的Zeta 电位绝对值随Fe3+投加量的增大而减小,其稳定性不断遭到破坏;在达到Zeta 电位零点并发生电位逆转后,溶液的Zeta 电位绝对值随Fe3+投加量的增大而增大,颗粒表面正电荷过多,凝聚的胶体颗粒会因静电斥力增大,产生“胶体保护”作用而发生再稳现象[14].
2.2.3 Fe3+投加量对臭氧氧化前后污染物体系粒度的影响
不同Fe3+投加量下,臭氧氧化前后两种污染物溶液的平均粒径如图7 所示,其中两种溶液的初始浓度均为5.00 mg·L-1.

图7 Fe3+投加量对臭氧氧化前后污染物体系颗粒平均粒径的影响
从图7 中可以看出,投加Fe3+后,HA 溶液和BSA 溶液的颗粒平均粒径较投加前的193 nm 和202 nm 都有不同程度的增大,这说明该过程中Fe3+会与污染物颗粒结合,导致其平均粒径增大,但BSA 溶液的颗粒平均粒径在整个Fe3+投加范围内均未明显增大,而HA 溶液的颗粒平均粒径在投加1.00 mg·L-1的Fe3+后明显增大.另外,臭氧氧化可以在一定程度上减小两种污染物溶液的颗粒平均粒径.
3 讨论
3.1 Fe3+对臭氧氧化BSA 的催化作用
臭氧可以直接氧化BSA,也可以通过产生·OH的方式进行间接氧化,如图8 所示.推断Fe3+作为催化剂能够明显提高臭氧氧化BSA 效率的原因可能是溶解在水中的臭氧除了小部分以分子态形式直接与BSA 反应,更多的是在Fe3+催化作用下产生·OH 进行间接氧化,Fe3+的存在能使溶液中的臭氧分子发生反应[15-16]:

图8 Fe3+催化臭氧氧化BSA 的机理示意图
Fe3++O3+H2O→FeO2++·OH+O2+H+,
FeO2++H2O→Fe3++·OH+OH-.
如上式所示,Fe3+催化臭氧产生·OH 和中间产物 FeO2+,随后具有强反应活性的氧化中间体FeO2+还可继续引发·OH 的生成.
3.2 Fe3+与HA 间的凝聚作用
根据本研究的试验结果,Fe3+对臭氧氧化BSA有明显催化效果,而对HA 则未产生催化作用.推测Fe3+对臭氧氧化HA未产生催化作用可能存在以下两方面原因: (1)投加Fe3+后,部分Fe3+充当混凝剂的角色与HA 颗粒结合,而这些结合后的颗粒平均粒径增大,比表面积减小使其更不容易被臭氧氧化[17],如图9 所示;(2)HA 溶液浓度随氧化时间的增加逐渐降低,而HA 溶液的Zeta 电位由-29.2 mV升至-10.6 mV,Zeta电位绝对值随其浓度的增大而减小,HA 溶液稳定性大幅降低,更易与Fe3+混凝.以上两点负面作用与Fe3+催化臭氧产生·OH 的正向作用相互抵消,导致HA 的去除率不如Fe3+投加前.

图9 Fe3+影响臭氧氧化HA 的示意图
由于HA 颗粒与Fe3+结合后平均粒径增大,故可考虑通过沉淀或过滤的方法将饮用水中的管道腐蚀产物Fe3+与腐殖质类二次污染物协同去除.
4 结论
试验通过探究Fe3+对水中腐殖酸/牛血清蛋白两种典型有机污染物臭氧氧化过程的影响,得到以下结论:
(1)腐殖酸的去除率随臭氧投加量增加的提升较牛血清蛋白明显.在持续氧化60 min 后,两者去除率最高分别达61.8%与13.8%,臭氧氧化牛血清蛋白的效率远低于腐殖酸.臭氧氧化可降低两种污染物溶液的Zeta 电位绝对值及其颗粒平均粒径.
(2)Fe3+的存在能催化臭氧氧化牛血清蛋白,其去除率由17.6%最高可升至40.0%,但对腐殖酸的臭氧氧化效果存在一定的不利影响,这是由于腐殖酸本身的荷电和聚集特性,以及其相较于牛血清蛋白与Fe3+间更明显的混凝作用,导致Fe3+催化臭氧氧化腐殖酸的效果被抵消.
(3)在饮用水的末端治理中,腐殖质类二次污染物因其与Fe3+间的凝聚作用,可通过增设过滤单元去除,而蛋白质类二次污染物的去除可利用Fe3+对臭氧氧化的催化作用得到强化.
