元素“位—构—性”的关系及元素综合推断的模型探究
2022-11-30福建王书红
福建 王书红
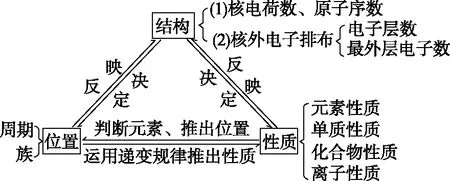
一、元素“位-构-性”的关系
元素在周期表中的位置,反映了元素的原子结构和元素的性质,而根据元素的原子结构又可推测它在元素周期表中的位置和性质,三者之间的关系如图所示。
二、元素推断题三种常见类型及解题思路
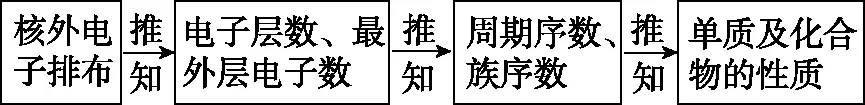
1.类型一 根据元素原子的核外电子排布推断元素
(1)解题的一般思路
以原子结构、核外电子排布特征为突破口推测元素,是元素推断题的重要类型之一。题目通常以文字叙述的形式给出元素原子的核外电子排布、位置关系等关键信息。解题时可结合短周期元素的原子结构,利用核外电子的排布三大规律即最外层电子规律、“阴三、阳四”规律、“阴上、阳下”规律对元素进行合理的推断。推断思路为:
(2)核外电子的排布三大规律
①最外层电子规律

最外层电子数(n)3≤n<8n=1或2n>次外层电子数元素在周期表中的位置ⅢA族~ⅦA族ⅠA族、ⅡA族、Ⅷ族、副族、0族元素氦第二周期(Li、Be)除外
②“阴三、阳四”规律:某元素阴离子最外层电子数与次外层电子数相等,该元素位于第三周期;若为阳离子,则位于第四周期。如Cl-、Ca2+最外层电子数与次外层电子数相等,则Cl位于第三周期,Ca位于第四周期。
③“阴上、阳下”规律:核外电子排布相同的离子,电性相同则在同周期;电性不同则阳离子位于阴离子的下一周期。如O2-、Na+电子层结构相同,则Na位于O的下一周期。
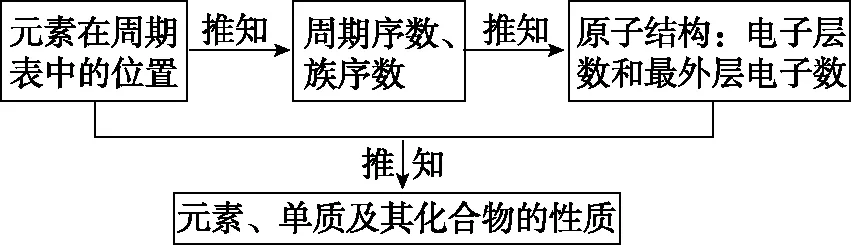
2.类型二 根据元素在周期表中的位置,推测元素及化合物的化学式
(1)解题的一般思路
近几年考试的热点问题是以文字描述给出元素在周期表中的相对位置并给出由它们组成的最新科研成果中化合物的结构,以此来推测元素种类;以图像形式给出改变原子序数时原子半径(离子半径)递变规律及改变原子序数时元素化合价递变规律,以此来推测元素种类。解答此类题目时,首先是确定信息元素在周期表中的位置,然后以此为“坐标原点”,结合所给化合物中元素的成键特点及元素在周期表中的相对位置关系推测其他未知元素。其解题的一般思路为:
(2)主族元素的成键特点
①能形成简单阴阳离子的元素一般为ⅠA、ⅡA、ⅥA、ⅦA族活泼的金属或者非金属元素;
②从形成共价键的个数推断:

族序数ⅣAⅤAⅥAⅦA成键个数4321
3.类型三 根据元素单质或化合物的特性推断元素
(1)解题的一般思路
利用元素及其化合物特殊组成与特殊性质推断题,是近几年高考的热点题型,题目一般通过文字叙述提供某些元素及其化合物的相关性质(如能腐蚀玻璃、黄绿色气体等),解题时抓住这些关键特性,首先确定其为何种元素,然后以此为突破口,推知其他未知元素。其解题的一般思路为:

(2)主族元素常见的某些特殊性质
①H:原子半径最小的元素;气体单质密度最小的元素;元素原子的原子核中只有质子没有中子的元素;原子序数、电子层数、最外层电子数都相等的元素。②C:形成化合物种类最多的元素;单质是自然界中硬度最大的物质的元素;气态氢化物中氢的质量分数最大的元素。③O:地壳中含量最多的元素;短周期非金属氢化物的沸点最高的元素;氢化物在通常情况下呈液态的元素。④Cs:最活泼的金属元素;最高价氧化物对应水化物碱性最强的元素;阳离子的氧化性最弱的元素。⑤Na:焰色反应呈黄色的元素;短周期金属元素中与水反应最剧烈的单质对应的元素。⑥F:气态氢化物最稳定的元素;只有负价而无正价的元素。⑦Li:单质密度最小的金属元素。⑧Al:最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素。⑨S:元素的气态氢化物和它的最高价氧化物对应水化物发生氧化还原反应的元素。⑩存在同素异形体的元素:C、P、O、S。
类型一 根据元素原子的核外电子排布推断元素
【例1】(2021·全国甲卷)W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍。W和X的单质常温下均为气体。下列叙述正确的是
( )
A.原子半径:Z>Y>X>W
B.W与X只能形成一种化合物
C.Y的氧化物为碱性氧化物,不与强碱反应
D.W、X和Z可形成既含有离子键又含有共价键的化合物
【答案】D
【解题思路】W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍,则分析知,Z的最外层电子数为偶数,W和X的单质常温下均为气体,则推知W和X为非金属元素,所以可判断W为H元素,X为N元素,Z的最外层电子数为1+5=6,Y的最外层电子数为3,则Y为Al元素,Z为S元素。电子层数越多的元素原子半径越大,同周期元素原子半径依次减弱,则原子半径:Y(Al)>Z(S)>X(N)>W(H),A错误;W为H元素,X为N元素,两者可形成NH3和N2H4,B错误;Y为Al元素,其氧化物为两性氧化物,可与强酸、强碱反应,C错误;W、X和Z可形成(NH4)2S、NH4HS,两者既含有离子键又含有共价键,D正确。
【例2】(2020·全国Ⅱ卷)一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
( )
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
【答案】D
【解题思路】一种由短周期主族元素形成的化合物,具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大,且总和为24,根据图示,W形成1个共价键,且原子序数最小,故W为H元素,Z为+1价阳离子,Z为 Na元素,Y形成3个共价键,Y为N元素,24-1-11-7=5,X为B元素。A.该化合物中,H、B、N之间形成共价键,正确;B.Na单质既能与水反应生成氢氧化钠和氢气,也能与甲醇反应生成甲醇钠和氢气,正确;C.N的最高价氧化物的水化物(HNO3)为强酸,正确;D.B的氟化物BF3中B原子最外层只有6个电子,不满足8电子稳定结构,错误;故选D。
【例3】(2019·全国Ⅰ卷)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是
( )
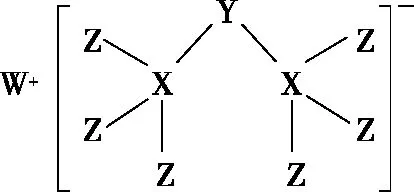
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
【答案】D
【解题思路】W、X、Y、Z为同一短周期元素,可能同处于第二或第三周期,观察新化合物的结构示意图可知,X形成四个共价键,可能为C或 Si。若X为C,则Z核外最外层电子数为C原子核外电子数的一半,即为3,对应B元素,不符合成键要求,不符合题意,故X为Si元素,W能形成+1价阳离子,可推出W为Na元素,Z核外最外层电子数为Si原子核外电子数的一半,即为7,可推出Z为Cl元素。Y能与2个Si原子形成共价键,另外得到1个电子达到8电子稳定结构,说明Y原子最外层有5个电子,进一步推出Y为P元素,即W、X、Y、Z分别为Na、Si、P、Cl元素。WZ为NaCl,其水溶液呈中性,A项错误;元素非金属性:Cl>P>Si,B项错误;P的最高价氧化物的水化物为H3PO4,是中强酸,C项正确;P原子最外层有5个电子,与2个Si原子形成共价键,另外得到1个电子,在该化合物中P元素满足8电子稳定结构,D项错误。
类型二 根据元素在周期表中的位置,推测元素及化合物的化学式
【例4】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是
( )
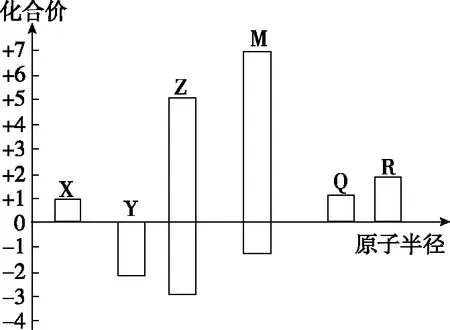
A.Q的M层电子数为1
B.X、Y、Z三种元素组成的化合物可能是盐或碱
C.简单离子半径:M->Q+>R2+
D.Z与M的最高价氧化物对应的水化物均为强酸
【答案】D
【例5】W、X、Y、Z是4种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和氖原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是
( )
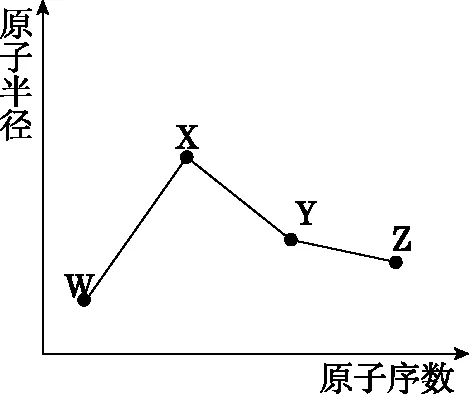
A.X的非金属性是同周期中最强的
B.对应气态氢化物的稳定性:Y>Z
C.对应简单离子半径:X>W
D.Z的单质能与X的最高价氧化物对应的水化物反应
【答案】D
【解题思路】由条件可知,W的原子序数是8,则W是氧元素,又因为W、X、Y、Z的原子序数递增,原子半径X最大,且X和氖原子的核外电子数相差1,故X是钠元素,Y的单质是一种常见的半导体材料,则Y是硅元素,Z的非金属性在同周期元素中最强,则Z是氯元素,据此分析解题。A.由分析可知,X为Na元素,故其金属性是同周期中最强的,错误;B.由分析可知,Y为Si元素,Z为Cl元素,同一周期从左往右元素的非金属性逐渐增强,对应的气态氢化物的稳定性也逐渐增强,故Z>Y,错误;C.氧离子和钠离子具有相同的核外电子排布,核电荷数Na>O,故对应简单离子半径:W>X,错误;D.Z的单质即Cl2能与X的最高价氧化物对应的水化物即氢氧化钠反应,正确。
类型三 根据元素单质或化合物的特性推断元素
【例6】(2020·全国Ⅲ卷)W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。下列叙述正确的是
( )
A.非金属性:W>X>Y>Z
B.原子半径:Z>Y>X>W
C.元素X的含氧酸均为强酸
D.Y的氧化物水化物为强碱
【答案】D
【解题思路】根据题干信息可知,W、X、Y、Z为原子序数依次增大的短周期元素,化合物XW3与WZ相遇会产生白烟,则XW3为NH3,WZ为HCl,所以W为H元素,X为N元素,Z为Cl元素,又因为四种元素的核外电子总数满足X+Y=W+Z,则Y的核外电子总数为11,Y为Na元素,据此分析解答。Na为金属元素,非金属性最弱,非金属性Y
【例7】(2021·1月浙江卷)现有4种短周期主族元素X、Y、Z和Q,原子序数依次增大,其中Z、Q在同一周期。相关信息如表:

元素相关信息X最外层电子数是核外电子总数的一半Y最高化合价和最低化合价之和为零Z单质为淡黄色固体,常存在于火山喷口附近Q同周期元素中原子半径最小
下列说法正确的是
( )
A.常温时,X单质能与水发生剧烈反应
B.Y与Q元素组成的YQ4分子,空间构型为正四面体
C.Y、Z、Q最高价氧化物对应水化物的酸性依次减弱
D.第五周期且与Q同主族元素的单质在常温常压下呈液态
【答案】B
【解题思路】X原子的最外层电子数是核外电子总数的一半,由于最外层电子数不超过8个,因此X只能是第二周期的Be;Y元素的最高化合价和最低化合价之和为零,位于第ⅣA族,Y是C或Si;Z单质为淡黄色固体,常存在于火山喷口附近,因此Z是S;Q是同周期元素中原子半径最小,且Z和Q位于同一周期,因此Q是Cl,据此解答。Be的金属性弱于Mg,常温时镁和冷水不反应,因此Be单质不能与水发生剧烈反应,A错误;Y与Q元素组成的CCl4或SiCl4分子,空间构型均为正四面体,B正确;Y、Z、Q三种元素的非金属性逐渐增强,非金属性越强,最高价含氧酸的酸性越强,则最高价氧化物对应水化物的酸性依次增强,C错误;第五周期且与Cl同主族元素的单质是碘,在常温常压下呈固态,D错误;故选B。
