人脐带间充质干细胞外泌体对大鼠骨折愈合的影响及其作用机制研究
2022-11-30张鹤令景青玲宗群川
张鹤令,景青玲,宗群川
(青海大学附属医院 创伤骨科,青海 西宁 810001)
骨折愈合受成骨能力、力学环境、血供等多种因素影响,愈合延迟或不愈合将严重影响患者肢体功能恢复及生活质量。因此,探寻促进骨折愈合的有效方式在创伤骨科备受关注[1]。间充质干细胞(mesenchymal stem cell,MSC)来源的外泌体(Exosomes,Exos)是一种由细胞分泌的细胞外囊泡,富含生长因子和细胞因子,是介导细胞间通讯,传递基质与癌细胞间物质的重要运输载体,其通过转运miRNA、mRNA、脂质及特异性蛋白,参与内环境与细胞间的信号传递、物质运输,并通过调节受体细胞中相关基因的表达影响其生理行为。相较于骨髓MSC,人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hucMSC)具有来源丰富、无伦理争议、免疫原性低及提取方便等优势,因而成为Exos 的主要来源之一[2-3]。有体外实验发现,hucMSC-Exos 对小鼠成骨前体细胞的增殖与分化具有促进作用,提示其在骨折治疗方面的潜能[4]。目前,有学者鉴定出多种信号通路参与成骨,其中Wnt/β-catenin 信号通路是骨稳态的关键调节剂,激活该通路可显著降低骨吸收并促进骨形成,β-catenin 可通过结合核内转录因子改变DNA 结构,启动下游Runt 相关转录因子2(Runt-related transcription factor 2,Runx2)等靶向基因转录,促进成骨细胞增殖及分化。本研究选取小鼠前成骨细胞MC3T3-E1 制备外泌体,复制股骨干骨折大鼠模型进行体外及体内实验,观察hucMSCExos 对其愈合的影响,并探讨Wnt/β-catenin 信号通路在该过程中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF 级SD 大鼠40 只,雄性,8 周龄,体重(300±20)g,购自北京安凯毅博生物技术有限公司,实验动物生产许可证号:SCXK(京)2017-0006,实验动物使用许可证号:SYXK(青)2021-0002]。本研究经医院动物伦理委员会批准。
1.1.2 主要试剂hucMSC(上海雅吉生物科技有限公司),小鼠前成骨细胞MC3T3-E1(赛业生物科技有限公司),Wnt/β-catenin 信号通路抑制剂XAV939(美国MedChem Express 公司),兔抗人肿瘤易感基因101(tumor susceptibility gene 101,TSG101)、浮舰蛋白-1(Flotillin-1)、CD9、β-catenin、p-β-catenin、糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK-3β)、Runx2一抗(美国AbMART 公司)。
1.1.3 主要仪器JEM-2100Plus 透射电子显微镜(日本电子株式会社),数字化X 线摄片机(美国Hologic 公司),vivaCT40 型MicroCT(瑞士SCANCO Medical AG 公司),TECELF 3200 力学实验仪器(美国Endura 公司),SZX10 显微镜(日本Olympus 株式会社)。
1.2 外泌体制备
hucMSC 培养于L-15 培养基中[含10%胎牛血清(fetal bovine serum,FBS)、1%双抗],取第3 代hucMSC,培养于高糖DMEM 培养液中(含10%FBS),待融合至75%,更换为无外泌体FBS 血清培养48 h,弃上清液,移至离心管,充分洗涤,离心弃沉淀,再次离心,4℃过夜,取沉淀即为hucMSC-Exos。取hucMSC-Exos 10 μL,滴至载样铜网,静置2 min,滤纸去浮液,1%磷钨酸溶液染色5 min,透射电镜观察hucMSC-Exos形态。
取hucMSC-Exos 50 μL,离心弃上清液,冰上裂解,离心取上清液,移至离心管,蛋白定量试剂盒定量,加入上样缓冲液,沸水浴变性5 min。每孔40 μg上样,电泳转膜,封闭2 h,加入兔抗人TSG101、Flotillin-1、CD9 一抗(1∶500),4℃孵育过夜,洗涤后加入山羊抗兔二抗(1∶2 000),室温孵育2 h,Western blotting 检测hucMSC-Exos 膜表面特异性标志蛋白,凝胶成像系统分析。
将成骨细胞按2×103个/孔的密度接种于96 孔板,用含体积分数为10%的FBS、1%双抗的α-MEM培养液,在37℃,5%二氧化碳CO2条件下培育,待细胞铺满80%左右时胰蛋白酶消化传代,取第3 代细胞。将细胞分为空白组、干预组,空白组用无外泌体的FBS 配置α-MEM 培养液,干预组在α-MEM 培养液中加入10 mg/L FBS 外泌体。两组均设5 个复孔,培养箱中培养24 h、48 h 和72 h,加入新制备的0.5g/L MTT 溶液,每孔20 μL,继续培养4 h,离心弃上清液,每孔加入DMSO溶液150 μL,振荡10 min,继续培养2 h,吸取上清液,用酶标仪测定490 nm 处的光密度(optical density,OD)值。
1.3 动物分组与处理
1.3.1 骨干骨折模型的复制腹腔注射麻醉大鼠,常规备皮,保持右侧卧位。取右下肢股外侧切口,剥离外皮,纵向切开浅层与深层筋膜层,顺股外侧肌间隔进行钝性分离,暴露股骨干。在股骨中段前方最高点位置锯缺损至骨髓腔(3 mm),形成股骨中段横行骨折,沿髓腔插入克氏针直到贯穿整个股骨髓腔,固定骨折,剪除多余克氏针,将远端埋在骨皮质下。常规缝合、抗感染。术后即刻拍摄X射线片,以股骨中段斜形或横形骨折,骨折端内固定效果理想,未发生明显移位为骨干骨折模型复制成功[5]。
1.3.2 干预方法40 只大鼠复制股骨干骨折模型,成功30只,随机分为对照组、外泌体组、复合组,各10 只。将水凝胶作为hucMSC-Exos 的载体,hucMSCExos 100 μg 溶于PBS 缓冲液50 μL 中。骨折后7 d,对照组经皮从骨折断端注射PBS 缓冲液50 μL、水凝 胶100 μL 至骨髓腔,cMSC-Exos 组同法注射hucMSC-Exos 100 μg、水凝胶100 μL 至骨髓腔[6]。复合组同法注射hucMSC-Exos 100μg、水凝胶100 μL至骨髓腔,腹腔注射Wnt/β-catenin 信号通路抑制剂XAV939 DMSO 溶液5 mL(XAV939 剂量为1 mg/只)[7]。对照组、外泌体组腹腔注射DMSO溶液5 mL。
1.4 MicroCT扫描
干预后2周、4周行MicroCT扫描。采用CTAn软件定量分析,计算骨小梁数量(trabecular number,Tb.N)及骨体积分数(bone volume/total volume,BV/TV)。
1.5 生物力学测试
末次MicroCT 扫描后,颈椎脱臼处死大鼠,剥离左下肢股骨,骨水泥固定两端,采用力学实验仪器行四点弯曲实验,记录最大载荷、最大载荷恢复率。
1.6 苏木精-伊红染色观察大鼠骨痂组织病理变化及组织学评分
处死大鼠后,取骨折上下各5 mm×5 mm 骨痂组织,行常规苏木精-伊红(hematoxylin-eosin staining,HE)染色,光镜下观察骨折愈合情况。组织学评分标准:0 分,骨折两端界限清晰,无骨膜反应;1 分,骨折两端界限明显,轻度骨膜反应;2 分,骨折两端界限模糊,可观察到少量骨痂;3 分,骨折两端界限接近于消失,可观察到大量骨痂;4 分,骨折两端无界限,骨痂填满。
1.7 Western blotting 检测大鼠骨痂组织βcatenin、p-β-catenin、GSK-3β、Runx2蛋白的表达
取骨折位置骨痂组织40 mg,加入生理盐水充分研磨匀浆,RIPA 裂解,4℃离心,取上清液,定量蛋白,取微量蛋白样本,混合4 倍体积上样缓冲液,加热变性蛋白,离心取上清液,行凝胶电泳分离,湿法转膜,5% 脱脂牛奶封闭2 h,加入兔抗大鼠βcatenin、p-β-catenin、GSK-3β、Runx2 一抗(1∶500),低温摇床过夜,加入二抗(1∶2 000)常温孵育2 h,洗膜后经ECL 发光、暗室显影,以GAPDH为内参,凝胶成像系统分析。
1.8 统计学方法
数据分析采用SPSS 21.0 统计软件。计量资料以均数±标准差()表示,比较用单因素方差分析或重复测量设计的方差分析,两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 外泌体鉴定结果
透射电镜观察显示,Exos 大小、分布不均,表现为类圆形或圆形环状结构,具有双圆盘结构囊泡,直径30~200 nm,符合Exos 特征。Western blotting 结果显示,与全细胞蛋白裂解物比较,获取的hucMSCExos 膜表面富含特异性标志蛋白TSG101、Flotillin-1、CD9。见图1、2。

图1 hucMSC-Exos形态(透射电镜×70 000)
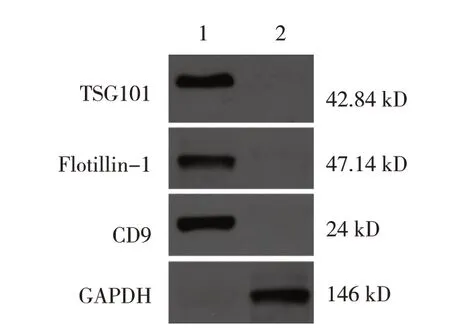
图2 hucMSC-Exos膜表面特异性标志蛋白的表达
2.2 3组大鼠不同时间点Tb.N、BV/TV的变化
对照组、外泌体组、复合组大鼠干预后2 周、4 周的Tb.N、BV/TV 比较,采用重复测量设计的方差分析,结果:①不同时间点Tb.N、BV/TV 有差异(F=23.584 和31.267,均P=0.000);②3 组大鼠Tb.N、BV/TV 有差异(F=85.512 和54.796,均P=0.000),与对照组、复合组相比,外泌体组Tb.N 较多,BV/TV 较高,促进骨折愈合效果相对较好;③3 组大鼠Tb.N、BV/TV 变化趋势有差 异(F=19.417 和25.461,均P=0.000),见表1。
表1 3组大鼠不同时间点Tb.N、BV/TV比较(n=10,)
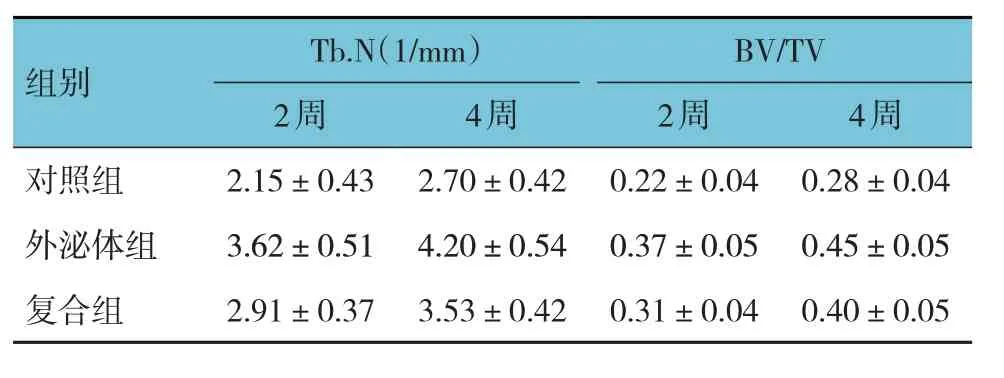
表1 3组大鼠不同时间点Tb.N、BV/TV比较(n=10,)
2.3 3组大鼠最大载荷、最大载荷恢复率比较
对照组、外泌体组、复合组大鼠最大载荷、最大载荷恢复率比较,经方差分析,差异均有统计学意义(P<0.05);外泌体组最大载荷、最大载荷恢复率高于对照组和复合组。见表2。
表2 3组大鼠最大载荷、最大载荷恢复率比较(n=10,)
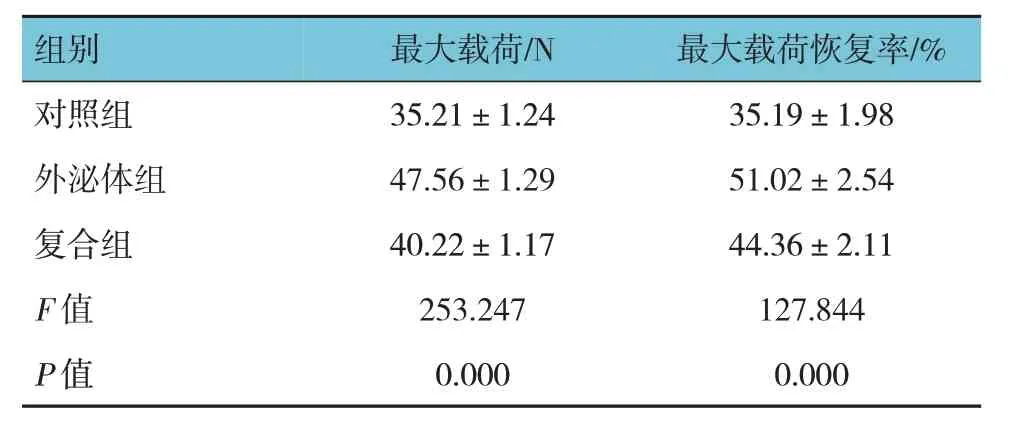
表2 3组大鼠最大载荷、最大载荷恢复率比较(n=10,)
2.4 大鼠骨痂组织病理变化及组织学评分比较
对照组骨小梁不具明显的方向性,成骨不活跃,骨小梁增粗不明显;外泌体组骨折断端可观察到较多的骨性骨痂,骨小梁部分成熟,且有明显矿化,且与应力方向一致,排列有序;复合组可观察到生成较多软骨性及纤维性骨痂,在软骨性骨痂边缘有较多钙化,有骨外膜下成骨,并形成骨小梁,间隙中毛细血管丰富。见图3。
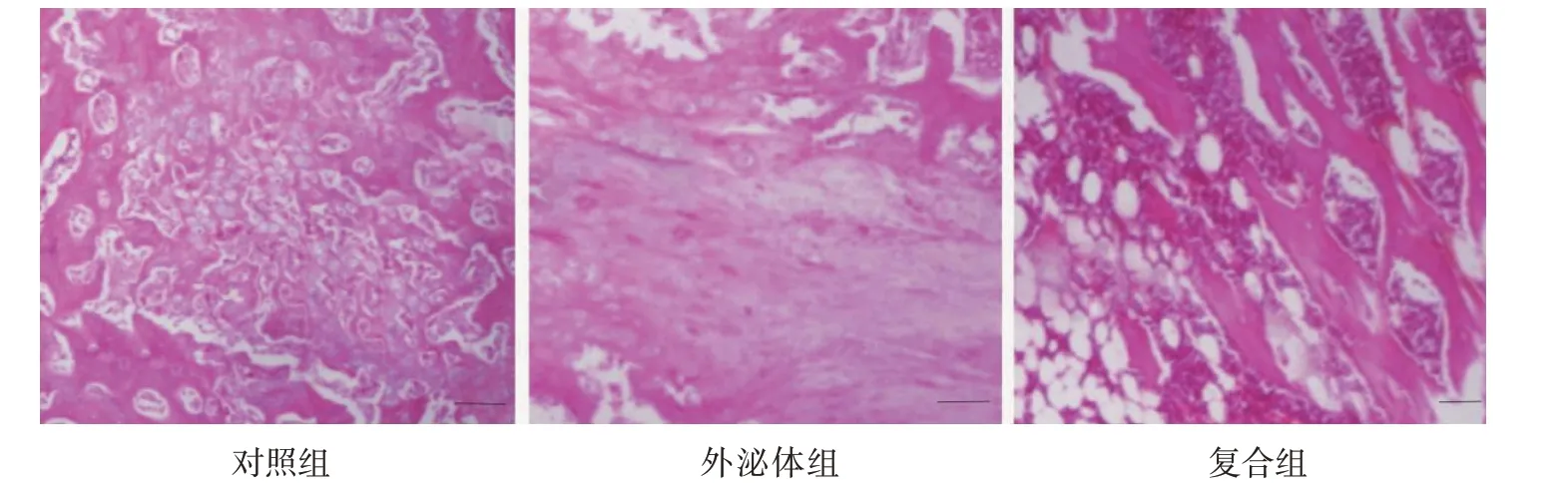
图3 3组大鼠骨痂组织病理切片(HE染色×40)
对照组、外泌体组、复合组大鼠骨痂组织组织学评分分别为(1.68±0.37)分、(2.47±0.52)分、(3.08±0.63)分,经方差分析,差异有统计学意义(F=18.380,P=0.000);与外泌体组比较,对照组组织学评分降低(P<0.05),复合组组织学评分升高(P<0.05)。
2.5 3 组大鼠骨痂组织p-β-catenin/β-catenin、GSK-3β、Runx2蛋白相对表达量比较
对照组、外泌体组、复合组大鼠骨痂组织p-βcatenin/β-catenin、GSK-3β、Runx2 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:与对照组比较,外泌体组pβ-catenin/β-catenin、Runx2蛋白相对表达量升高(P<0.05),GSK-3β 蛋白相对表达量降低(P<0.05);与外泌体组比较,复合组p-β-catenin/β-catenin、Runx2 蛋白相对表达量降低(P<0.05),GSK-3β 蛋白相对表达量升高(P<0.05)。见表3。
表3 3组大鼠骨痂组织p-β-catenin/β-catenin、GSK-3β、Runx2蛋白相对表达量比较(n=10,)
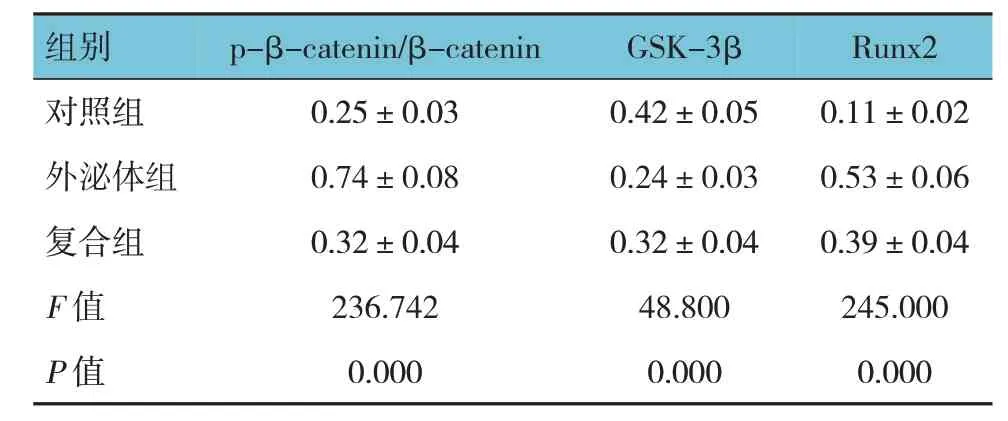
表3 3组大鼠骨痂组织p-β-catenin/β-catenin、GSK-3β、Runx2蛋白相对表达量比较(n=10,)
3 讨论
股骨干骨折是临床常见的成人骨折类型,尽管骨组织拥有很强的愈合力,但仍有10%左右的患者存在股骨干骨折延迟愈合或不愈合问题,进而导致骨骼畸形、肢体缩短、永久性残疾等并发症[8]。随着组织工程技术的不断进步,以hucMSC 移植为代表的细胞移植成为治疗骨折的新型方式。然而有研究发现,外源性hucMSC 移植后并未直接参与损伤组织的修复、再生过程,而是通过旁分泌效应如分泌Exos 参与组织修复[9-10]。
Exos 是直径30~150 nm 的囊泡样小体,触发适应性及先天性免疫应答风险小,无致瘤性,且具有性质稳定、可长期存储的优势,其与干细胞功能类似,在心血管疾病、骨科疾病、神经系统疾病及肝病等领域均取得了较大成就[11-13]。hucMSC-Exos 注入骨髓腔周可释放促软骨细胞增殖及促基质合成因子,可调节微环境平衡,促进软骨修复与再生[14]。此外,hucMSC-Exos 中含有丰富的酶类,可改善生物能量代谢、调节细胞数量,并通过调控免疫系统恢复细胞内稳定结构[15]。ZHANG等[16]研究表明,Exos 作为细胞间通讯的重要参与者,通过促进骨生成和血管生成,对骨不连的治疗发挥关键作用。LIANG等[17]研究证实,骨髓MSC 外泌体可促进软骨细胞稳态重建,减少软骨细胞凋亡,并减少炎症组织中巨噬细胞聚集,下调炎症因子水平达到抗炎效果。本研究结果显示,与对照组比较,外泌体组干预后2 周、4 周Tb.N 增加,BV/TV、最大载荷、最大载荷恢复率升高,提示hucMSC-Exos 可促进股骨干骨折大鼠骨折愈合,并提高骨痂生物力学性能。
Wnt/β-catenin 信号通路是调控细胞生长及分化的经典途径,与骨生成代谢关系密切,在该通路中β-catenin 是具有正向调节作用的核心蛋白,GSK-3β是其负向调控酶,可促进β-catenin 磷酸化,p-βcatenin 与DNA 亲和蛋白结合形成复合体,从而调控下游靶基因,参与骨代谢过程[18-19]。近年来,以Wnt/β-catenin 信号通路为靶点,治疗骨折的体内动物实验研究已获得一定进展[20-22]。LIU等[23]研究发现,激活Wnt/β-catenin 信号通路可促进成年和老年雄性小鼠干骺端骨折愈合,其骨痂组织中成骨细胞数量增加,且活性亦随之增强。此外有学者发现,激活Wnt/β-catenin 信号通路可通过诱导血管生成和细胞分化,促进小鼠骨折愈合,提示该通路在成骨分化及骨形成中发挥重要作用[24]。本研究结果显示,与对照组比较,外泌体组骨痂组织p-β-catenin/βcatenin、Runx2 蛋白相对表达量升高,GSK-3β 蛋白相对表达量降低,且在hucMSC-Exos 的基础上增加Wnt/β-catenin 信号通路抑制 剂XAV939将减弱hucMSC-Exos 对骨折愈合的促进作用,提示Wnt/βcatenin 信号通路在骨折大鼠中活性降低,hucMSCExos 可能通过激活Wnt/β-catenin 信号通路发挥作用。
综上所述,股骨干骨折大鼠骨髓腔内注射hucMSC-Exos 对骨折愈合具有促进作用,其作用机制可能与激活Wnt/β-catenin 信号通路有关。
