一种基于BALB/c背景由膳食麸质引起的乳糜泻小鼠模型的构建及其评价
2022-11-30宋东筱任正楠潘礼龙
宋东筱,任正楠,潘礼龙,孙 嘉,*
(1.江南大学食品学院,江苏 无锡 214122;2.江南大学无锡医学院,江苏 无锡 214122)
麸质是小麦、大麦、黑麦和其他相关谷物中含有的一种结构蛋白复合物,麦醇溶蛋白是麸质的组成成分,代表了一类在麸质相关疾病中具有最常见病因作用的蛋白质[1-2]。部分人群对麸质先天性过敏,当他们摄入含麸质的食品时,麸质会激发免疫反应,引起相关的自身免疫性疾病,其中最常见的疾病是乳糜泻[3]。在乳糜泻过程中,麸质蛋白作为刺激物会激活小肠黏膜的先天性和适应性免疫反应,导致淋巴细胞和单核细胞浸润、隐窝增生和小肠绒毛萎缩,进而导致小肠上皮层以及固有层发生变化[4],乳糜泻引起的黏膜损伤通常涉及小肠的近端部分(十二指肠)[5]。其中隐窝增生和绒毛萎缩使小肠黏膜的表面积大量减少,导致对营养物质、维生素和矿物质吸收不良,从而进一步影响机体其他组织和器官的功能,并且还会引发贫血、骨质疏松及皮疹等多种不同的临床症状[6-7]。乳糜泻在世界范围内很常见,早期的流行病学研究认为乳糜泻是一种常见于欧洲和北美洲的高加索血统个体疾病[8],但近年研究发现,在其他地区乳糜泻的发病率也很高,全球的患病率约为1%[9]。乳糜泻在中国曾被认为极为罕见,但是近几年乳糜泻病例报道逐渐增多,并且已有研究发现中国人群具有很高的乳糜泻易感基因携带率[10];此外,在中国小麦已经成为仅次于大米的第二大消费主食,尤其是在我国的北方地区,所以中国居民患乳糜泻的风险远比原先预计的高,应当引起人们重视,提高对乳糜泻及其对健康潜在影响的认识[11-12]。目前全世界范围内还没有针对乳糜泻的药物治疗方法,乳糜泻目前公认的唯一干预方法是终生严格坚持无麸质饮食[13],即不能摄入含有小麦、黑麦或大麦及其衍生物的麸质食物或药物,因为即使少量的麸质也可能会激活乳糜泻患者的免疫反应,导致严重的后果。然而,小麦粉和麸质蛋白等经常作为配料广泛应用于各种食品中,并且无麸质的食品或作物在贮存、运输和加工过程中也经常容易受到麸质的污染,以上情况都造成乳糜泻患者在日常生活中很难完全避免摄入麸质,导致乳糜泻非常容易出现病症反复,并且长期无麸质饮食也会影响患者的社会交往活动[14],加重患者的心理与经济负担[15]。此外,与相应的含麸质食品相比较,由无麸质原材料制成的食品通常在营养、质地和感官特性等方面都有着较大差距[16]。因此,探寻新的治疗方法或药物用于辅助或替代无麸质饮食干预是必要的,而动物实验验证是新的治疗方法或药物在用于临床之前能够保证其有效性和安全性的必经步骤,所以成功建立乳糜泻动物模型是研究新的治疗方法或相关功能性食品的前提和关键。
BALB/c小鼠易发Th2型免疫反应,目前已经广泛用于各种食物过敏原敏感的动物模型中[17],故本实验通过饲喂无麸质饲料连续3 代以上得到麸质不耐受的BALB/c小鼠,再通过饲喂含麸质饲料并辅以腹腔注射和脚掌注射麦醇溶蛋白刺激构建乳糜泻模型,并通过检测乳糜泻相关的指标来评价该模型的可行性,研究该小鼠模型在病理表观、肠道屏障和免疫反应等方面的表现,并与临床乳糜泻特征进行比较,以期为未来乳糜泻新的潜在治疗措施的研究或相关功能性食品的开发提供参考。
1 材料与方法
1.1 动物、材料与试剂
本实验使用的动物为BALB/c雌性小鼠购于上海斯莱克实验动物有限公司(生产许可证号:SCXK(沪)2022-0004),饲养于江南大学医学院实验动物中心无特定病原体级屏障环境中,饲养环境保持12 h/12 h循环照明、室温22~26 ℃、相对湿度40%~60%。在正式实验开始之前,所有小鼠都维持无麸质饲料饲养,选择繁育至少3 代以上的6~8 周龄小鼠进行正式实验。无麸质饲料AIN-76A购于美国Research Diet公司。含麸质饲料则是在无麸质饲料配方的基础上添加2.5 g/kg的麸质蛋白[18],定制于无锡市枫泊生物公司。全部动物实验均由江南大学动物伦理委员会批准(批准号:JN.No20190630b0480830[186]),并遵循国家、国际动物实验伦理原则开展。
醇溶蛋白、弗氏完全佐剂、麸质蛋白 美国Sigma公司;TRIzol试剂、Super Script II逆转录酶 加拿大Invitrogen公司;实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qPCR)引物、焦碳酸二乙酯(diethyl pyrocarbonate,DEPC) 上海生工生物工程公司;SYBR Green Supermix染料 翌圣生物科技(上海)有限公司;ZO-1抗体、β-actin抗体 武汉爱博泰克生物科技有限公司;ZO-2抗体 美国Proteintech公司;Occludin抗体 美国Bimake公司;Claudin-1抗体、组织转谷氨酰胺酶(tissue transglutaminase,tTG)活力测定试剂盒 英国Abcam公司;小鼠连蛋白试剂盒南京博研生物科技有限公司。
1.2 仪器与设备
ST40R冷冻离心机、GO全波长酶标仪 美国Thermo Fisher Scientific公司;1150H组织石蜡包埋机、PM2245莱卡手动轮转切片机 德国莱卡公司;Pannormic Midi切片电子扫描仪 匈牙利3Dhistech公司;Scientz-48高通量组织研磨机 宁波新芝生物科技股份有限公司;FluorChem FC3凝胶成像分析系统 美国ProteinSimple公司。
1.3 方法
1.3.1 构建动物模型
将6~8 周的无麸质饲料饲养至少3 代以上的BALB/c小鼠随机分为正常组(Control组)和模型组(CeD组),每组6~8 只。所有动物均饲养于江南大学医学院实验动物中心SPF级屏障环境。实验开始的第1天将CeD组的饲料换为麸质含量为2.5 g/kg的含麸质饲料,Control组则继续饲喂无麸质饲料;在实验的前3 周,通过腹腔注射分别给予CeD组每只小鼠含有150 μg麦醇溶蛋白的0.2 mL 0.01 mol/L磷酸盐缓冲溶液(pH 7.4),每周两次,在第4周,给予CeD组每只小鼠后脚掌注射乳化有50 μg麦醇溶蛋白的弗氏完全佐剂50 μL两次(第1天和第4天各注射一次)。在实验的第31天,向小鼠体内注射致死剂量的戊巴比妥钠并快速收集新鲜的血液和十二指肠等。血液样本在4 ℃、3 000×g条件下离心15 min,取上清液,得到血清样品。血清和组织样本均保存于-80 ℃冰箱中。
1.3.2 小鼠十二指肠组织病理学检测
收集一段新鲜的十二指肠组织,将其放入提前备好的质量分数4%多聚甲醛溶液中,避光固定24~36 h,脱水,石蜡包埋,随后将包有组织的蜡块切成5 μm厚的组织切片,然后采用苏木精-伊红(hematoxylin-eosin,HE)染色法观察组织形态。将组织切片放入60 ℃的烘箱中烘烤2 h,用二甲苯进行脱蜡,依次将切片放入体积分数100%、95%、90%、80%、70%乙醇溶液中进行复水。随后用苏木精进行染色,染色时间为30 s左右,染色结束后放于流水下进行冲洗15~20 min,冲去多余苏木精,然后放入体积分数1%盐酸-乙醇溶液中分化7 s左右,随后再次将切片放入流水中冲洗,直到组织变为蓝色,最后将切片放入伊红染液中进行复染。随后,将染色后的切片依次置于70%、80%、95%、95%、100%乙醇溶液及二甲苯中进行透明处理。随后用中性树脂进行封片,置于通风处风干后,在显微镜下观察小鼠十二指肠组织病理变化,根据绒毛长度和隐窝深度比值(villous length/crypt depth,V/C)对十二指肠组织的受损情况进行评价。
1.3.3 酶联免疫吸附试验
小鼠十二指肠tTG活力和连蛋白含量的测定根据酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒说明书进行。
1.3.4 总RNA提取与qPCR测定
采用TRIzol法来提取小鼠十二指肠中的总RNA。首先称取适量的十二指肠组织加入1 mL TRIzol中,然后在高通量组织破碎仪中进行破碎,加入三氯甲烷进行抽提,12 000×g离心15 min后取上清液,随后加入等体积的异丙醇沉淀RNA,12 000×g离心15 min,得到羽毛状的固体沉淀,用体积分数75%乙醇溶液(经RNA酶抑制剂DEPC处理并灭菌的超纯水配制)清洗3 次沉淀,用DEPC水将沉淀溶解。使用Super Script II逆转录酶进行逆转录得到cDNA。以cDNA为模板,骨架蛋白β-actin为内参,Fast SYBR Green Master Mix混合体系,进行qPCR实验,反应总体系为20 μL,包括0.5 μL正向序列引物、0.5 μL反向序列引物(引物设计如表1所示)、10 μL的SYBR Green Supermix染料、2 μL cDNA和7 μL无菌水。qPCR反应设置的扩增程序为95 ℃预热5 min;95 ℃持续15 s,60 ℃持续60 s,反应40 个循环。按照基因相对表达水平2-ΔΔCt来计算目的基因(TGM2、Tjp1、Tjp2、Ocln、Cldn1、Il15、IFNG、Il4、Il6、Il17A、Il18、Il27、Il12、CD4、CD19、CD138和CD68)以及相对管家基因(Actb)的表达水平。

表1 qPCR使用的特异性引物Table 1 Specific primers used for qPCR
1.3.5 肠道通透性的测定
通过测定荧光素异硫氰酸酯-葡聚糖(fluorescein isothiocyanate-dextran,FITC-Dextran)质量浓度来表征小鼠的肠道通透性。小鼠处死前,进行禁食4 h处理,随后每只小鼠灌胃500 mg/kgmb的FITC-Dextran,灌胃4 h后将小鼠处死,避光快速收集血液,3 000×g离心15 min得到血清。使用多功能酶标仪在激发波长492 nm、发射波长525 nm条件下测定吸光度。通过连续稀释FITC-Dextran溶液绘制标准曲线,并根据标准曲线方程换算出血清中的FITC-Dextran质量浓度,血清中的FITC-Dextran质量浓度越大,说明小鼠肠道通透性越高。
1.3.6 免疫印迹实验
将适量的十二指肠组织放入蛋白裂解液(按蛋白裂解液与抑制剂体积比100∶1分别加入磷酸酶抑制剂和蛋白酶抑制剂)中进行组织破碎,随后在14 000×g、4 ℃条件下离心15 min,取上清液得到蛋白溶液,用BCA蛋白浓度试剂盒测定蛋白浓度,根据测得的蛋白质量浓度以确定上样液体积(总上样量为30 μg)。得到的蛋白样品经过SDS-PAGE分离后,电转印到硝酸纤维素膜上,用质量分数5%脱脂乳溶液封闭后,分别用ZO-2、Claudin-1和Occludin蛋白的抗体孵育过夜。随后用相应的辣根过氧化物酶偶联抗体室温孵育1.5 h,显色后置于Bio-Rad凝胶成像系统中曝光观察。
1.4 数据处理与分析
数据表示为平均值±标准差。双尾t检验(t-test)用于评估各组之间的显著性差异,数据使用统计学软件GraphPad Prime 7进行统计分析。
2 结果与分析
2.1 麸质引起的与乳糜泻相关的表观指标的变化
乳糜泻的典型表观指标是十二指肠绒毛长度缩短、隐窝增生以及tTG活力增加和转谷氨酰胺酶2(transglutaminase,TG2)含量及其抗体含量显著增加[19]。利用HE染色法观察小鼠十二指肠的组织形态(图1A),与Control组比较,CeD组小鼠的绒毛长度明显缩短。CeD组小鼠V/C值较Control组高度显著降低(P<0.001)(图1B),说明小鼠的十二指肠组织形态受到破坏。TG2是一种普遍表达的蛋白质,具有多种功能,包括酶促、细胞黏附、细胞信号传导和G蛋白活性。TG2与多种人类疾病有关,包括几种神经退行性疾病、癌症和乳糜泻[20]。TG2表达量显著升高也是乳糜泻发生的标志之一,并且TG2在肠道中的激活是乳糜泻发病机制的核心[21],在TG2作用下,麦醇溶蛋白肽会发生脱酰胺作用。脱酰胺的麦醇溶蛋白肽与抗原呈递细胞相结合,增加麦醇溶蛋白的免疫原性,促进抗原呈递细胞发挥功能,加强先天免疫反应对上皮的破坏。小鼠十二指肠组织中tTG活力和TGM2mRNA相对表达量结果和预期一样,与Control组相比,CeD组小鼠的tTG活力和TGM2mRNA相对表达量都极显著和高度显著增长(P<0.01、P<0.001)。以上结果与人类乳糜泻临床症状一致,说明该模型能够很好地模拟人类乳糜泻病理学的发展。
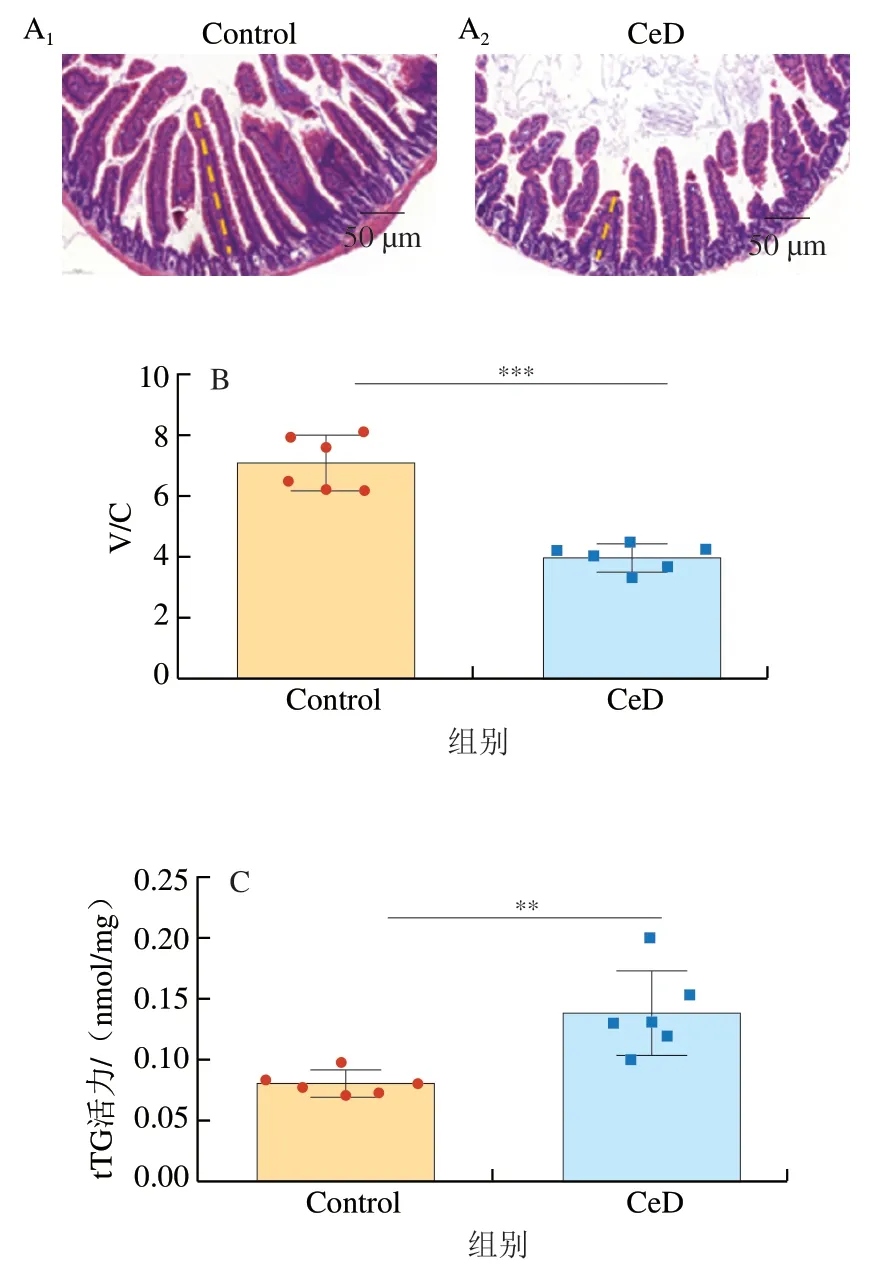
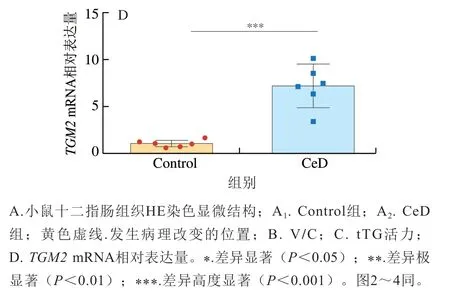
图1 麸质引起的与乳糜泻相关表观指标的变化Fig. 1 Changes in apparent indexes of celiac disease caused by gluten
2.2 麸质引起的小鼠肠道屏障的损伤
肠道屏障在保护生物体免受病原体侵害和维持体内稳态等方面发挥着至关重要的作用[22-23]。有研究表明,很多肠道疾病都会导致肠道屏障功能的损伤,而屏障功能的损伤会进一步加剧肠道疾病,乳糜泻就是其中一种。临床研究发现,乳糜泻患者的肠道屏障往往都会受到一定的破坏,乳糜泻患者会出现肠道通透性增加[24-25]、紧密连接蛋白表达下降[26]和连蛋白表达显著上升[27]等症状。本实验通过给小鼠灌胃FITC-Dextran,然后检测小鼠血清中FITC-Dextran质量浓度来评价小鼠的肠道通透性,如图2A所示,与Control组小鼠相比,CeD组小鼠的血清FITC-Dextran质量浓度显著增加(P<0.05),说明大量FITC-Dextran从肠道渗透进入血液中,小鼠的肠道通透性增加,小鼠的肠道屏障受到破坏。此外,本实验通过Western-blot和qPCR分别检测了紧密连接蛋白Claudin-1(Cldn1)、Occludin(Ocln)、ZO-1(Tjp1)和ZO-2(Tjp2)在蛋白水平和基因水平上的表达情况,以进一步探究CeD组小鼠的肠道屏障功能受损情况。CeD组小鼠Tjp1、Tjp2、Ocln、Cldn1mRNA相对表达量紧密连接蛋白的相对表达量在基因水平和蛋白水平上均显著降低(P<0.05、P<0.001、P<0.01)(图2B~F),紧密连接蛋白表达水平的降低会造成细胞间通透性增加,使肠腔内的细菌、毒素等物质可穿透肠黏膜进入其他组织、器官或循环系统,发生细菌或毒素移位,导致疾病[28]。最后,连蛋白是唯一已知的细胞间紧密连接的生理调节剂,其表达量上调会导致屏障功能丧失,造成饮食和微生物抗原不受控制地流入肠道固有层[29]。如图2G所示,CeD组的连蛋白质量浓度高度显著升高(P<0.001),进一步表明了小鼠的肠道通透性受到破坏。以上指标的改变都与乳糜泻中肠道屏障的改变相印证,表明该模型在肠道屏障受损方面可以很好地用于模拟临床上的乳糜泻病症。
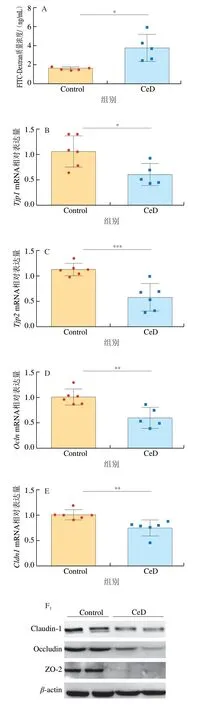
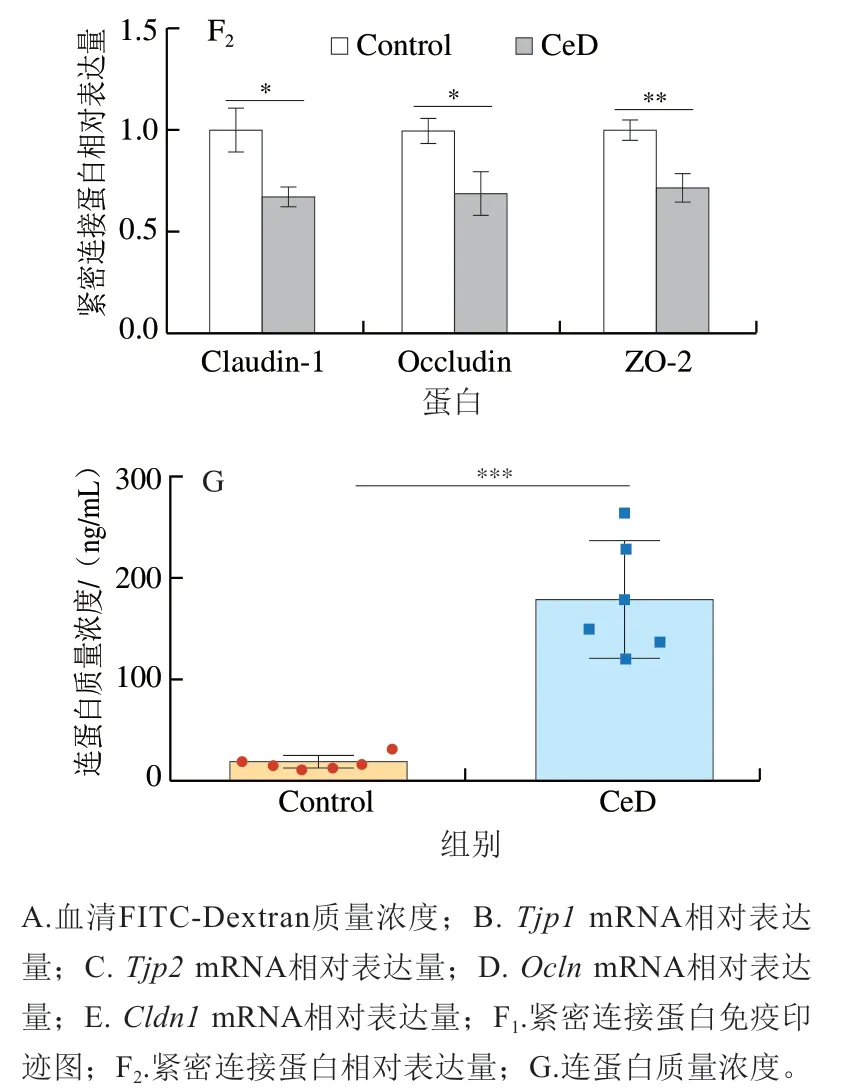
图2 麸质引起小鼠肠道屏障的损伤Fig. 2 Gluten caused damage to the intestinal barrier in mice
2.3 麸质引起的小鼠炎症因子的变化
乳糜泻的发生除了会导致肠道屏障和肠道病理变化,麸质也会刺激肠道内的各种细胞释放不同的炎症因子,形成局部的免疫反应[19,30]。细胞因子通过对T细胞和其他免疫效应物的影响参与增强或抑制免疫反应[31]。麦醇溶蛋白通过诱导肠上皮细胞中一氧化氮合酶来驱动氧化应激,以一氧化氮的产生为特征,促进tTG产生和上皮细胞中危险信号的表达,并通过固有层树突状细胞刺激白细胞介素(interleukin,IL)-15的激活和分泌。IL-15作用于上皮内淋巴细胞(intraepithelial lymphocytes,IELs),促进干扰素(interferon,IFN)γ产生和提高细胞毒性[32]。IL-15和IFN-γ都是乳糜泻发生的标志性炎症因子。如图3A、B所示,与Control组相比,CeD组中的Il15、IFNGmRNA相对表达量高度显著升高(P<0.001),与对临床患者的研究结果[33]一致。IL-18是一种促炎细胞因子,在免疫防御中具有重要作用,IL-18能够促进辅助性T(helper T,Th)1细胞发育,在乳糜泻患者的小肠黏膜中高表达[34]。IL-6是一种多效细胞因子,主要由固有层髓系细胞产生以应对肠道损伤,在炎症反应中具有重要作用,并介导先天和适应性免疫反应[35-36]。IL-4是Th2型细胞因子,主要参与Th2免疫反应。高水平表达的IL-17A是Th17细胞的特征,而IL-27可以刺激Th17细胞的生长发育,目前已发现Th17免疫反应参与了乳糜泻中炎症的发生[37]。以上细胞因子都已被发现在乳糜泻患者的十二指肠中表达量会显著升高,并且IL-6和IL-18是乳糜泻发生的重要因素,经qPCR检测得到的结果也与临床试验结果[33]一致,相比Control组,CeD组的Il4、Il6、Il17A、Il18以及Il27mRNA相对表达量(图3C~G)都出现了极显著或高度显著升高(P<0.01、P<0.001)。如图3H所示,CeD组的Il12mRNA相对表达量与Control组比较差异不显著(P>0.05),这也与临床试验结果一致,因为尽管IL-12在其他肠道炎症过程中是IFN-γ的主要诱导剂,但是研究发现在活动性乳糜泻中IL-12并不会高表达[38]。结果表明,该模型可以很好地用于模拟临床乳糜泻在炎症发生时炎症因子的变化。
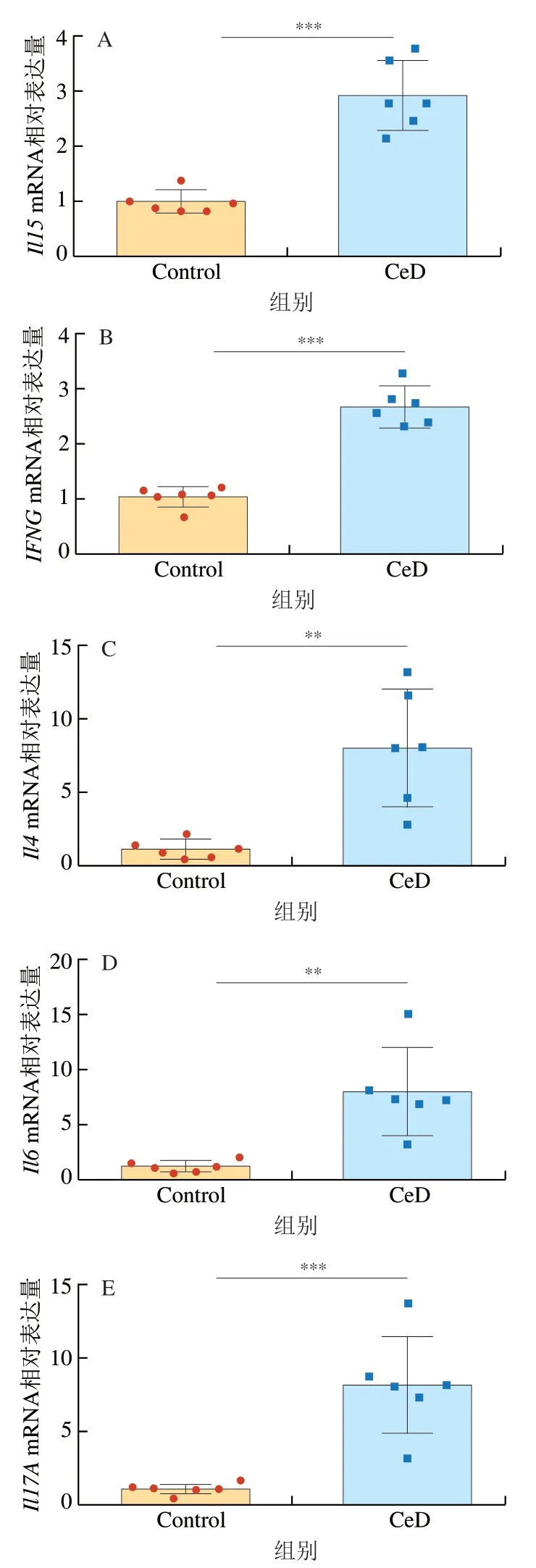
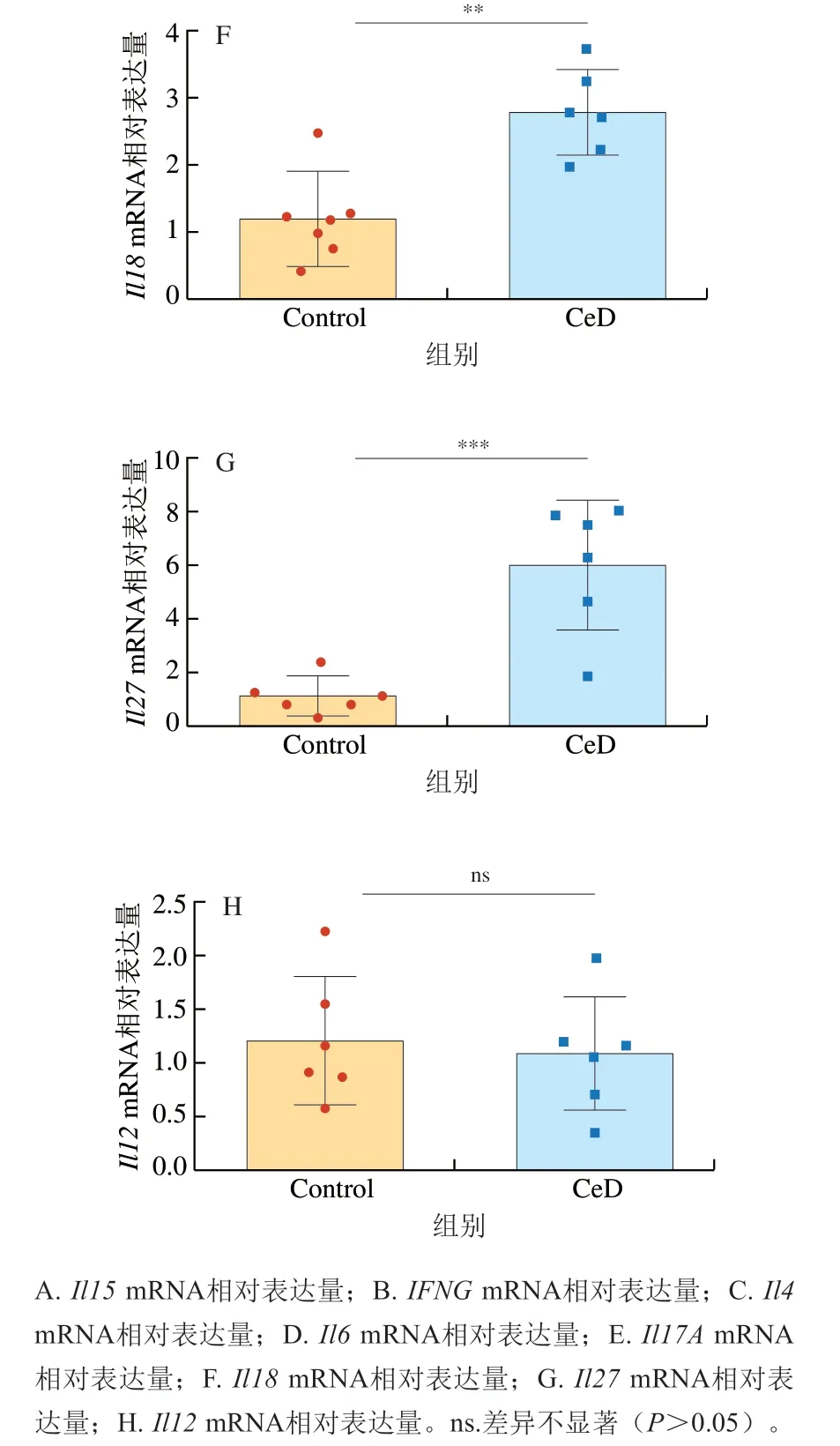
图3 小鼠十二指肠组织相关炎症因子的水平Fig. 3 Levels of inflammatory factors associated with celiac disease in mouse duodenal tissue
2.4 麸质引起的小鼠免疫细胞的变化
麸质蛋白进入肠道后,在十二指肠的固有层中,TG2选择性地使麸质蛋白脱酰胺,激活CD4+T细胞,这种识别麸质肽的CD4+T细胞在乳糜泻发病机制中起关键作用,在临床乳糜泻病人的十二指肠中,麸质特异性的CD4+T细胞数量显著增加并且会长期存在[39]。CeD组小鼠的CD4mRNA相对表达量高度显著高于Control组(P<0.001)(图4A),说明小鼠十二指肠中CD4+T细胞显著增加。B细胞和浆细胞可以作为乳糜泻肠壁中谷蛋白肽的呈递细胞,同时浆细胞可以产生抗TG2和抗麦醇溶蛋白的抗体[40],并且浆细胞有助于将免疫细胞聚集到肠道的炎症部位[41],研究表明,这两种细胞在乳糜泻病人的十二指肠中都显著增加,在乳糜泻中最主要的B细胞和浆细胞的标记物主要是CD19和CD138[41-42]。如图4B、C,与Control组相比,CeD组的小鼠十二指肠组织中CD19mRNA相对表达量显著增加(P<0.05),CD138mRNA相对表达量极显著增加(P<0.01),说明小鼠十二指肠中的B细胞和浆细胞数量都显著增加。巨噬细胞是免疫反应的关键调节剂和效应器,可以抵御病原体或有毒的内源性成分,并充当其他免疫细胞的抗原呈递细胞[43],巨噬细胞数量在活动性乳糜泻中出现显著增加[44]。与Control组相比,CeD组的小鼠十二指肠组织中的CD68mRNA相对表达量高度显著增加(P<0.001)(图4D),这说明小鼠十二指肠中巨噬细胞数量显著增加。以上免疫细胞在乳糜泻中都发挥着重要作用,是乳糜泻发生不可缺少的因素,这些细胞标记物的变化都与临床上的乳糜泻病人病理变化相同,说明该实验模型在免疫方面也可以很好地用于模拟乳糜泻。
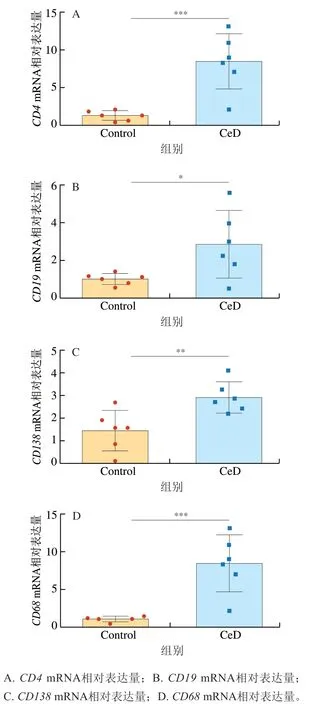
图4 小鼠十二指肠组织相关免疫细胞标记物的相对表达水平Fig. 4 Relative expression levels of inflammatory factors associated with celiac disease in mouse duodenal tissue
3 讨 论
动物实验是验证新的治疗方法或药物有效性及安全性的必经步骤,因此开发能够模拟临床上乳糜泻病人的症状的动物模型也是目前乳糜泻的研究热点。目前还没有能够完全模拟临床上乳糜泻症状的动物模型,各种动物模型都只能模拟乳糜泻发病过程中的一部分症状。BALB/c小鼠是一种倾向主导Th2型免疫反应的品系,目前已被广泛用于构建多种食物过敏动物模型。通过流行病学的研究和观察发现,当坚持无麸质饮食时,乳糜泻患者的病情进入缓解期,而当乳糜泻患者开始重新摄入麸质食物时,病情又会复发,这确定了麸质在乳糜泻发病机制中的关键作用。同时有研究证明,将低麸质饮食改为富含麸质的饮食之后,人们患乳糜泻的概率会增加[45]。本实验先以无麸质饲料饲喂BABL/c小鼠,从小鼠的饮食中消除麸质,使小鼠对麸质产生不耐受,从而加剧小鼠对摄入麸质的免疫反应,引发肠病,并且为了使这种不耐受更加敏感,采用了连续无麸质饲养3 代以上的小鼠。
在建造乳糜泻模型时,还需要考虑麸质的摄入方式。常见的摄入外源物质的方式有口服、灌胃、腹腔注射和皮下注射等,其中口服和灌胃与人类摄入麸质的途径是最相似的,但是这两种方法容易使小鼠产生口服耐受,影响造模效果;腹腔注射、肌肉注射和皮下注射等虽然可以避免口服耐受,但是与人类摄入麸质的方式有一定差异;因此,在本研究中选择了口服麸质(添加在小鼠饲料中)并辅以腹腔和肌肉(脚掌)注射的致敏方式,以期在避免口服耐受的同时,保证摄入的方式与人类摄入麸质的途径相似。此外,为增强抗原的免疫原性,加强免疫效果,缩短造模时间,本实验采用了弗氏完全佐剂作为免疫佐剂来加强小鼠的免疫反应。
十二指肠的绒毛长度缩短、隐窝增生是诊断乳糜泻发生的金标准。研究发现,与Control组相比,CeD组小鼠的小肠绒毛长度明显缩短,V/C值也高度显著降低(P<0.001),TGM2mRNA相对表达量高度显著升高(P<0.001),tTG活力极显著增大(P<0.01),在表观层面上可以判定模型构建成功。体外实验研究发现,麦醇溶蛋白会刺激小鼠的肠细胞释放连蛋白,而连蛋白会调节小鼠紧密连接蛋白之间的连接和排布,影响小鼠的肠道通透性,所以连蛋白质量浓度的增加和肠道通透性的升高也可以看做是乳糜泻发生的一个重要指标。通过测定肠道通透性、紧密连接蛋白相对表达量和连蛋白质量浓度,发现CeD组小鼠的肠道屏障受到了明显的破坏。进一步确定模型构建成功。
乳糜泻是一种自身免疫性疾病,所以模型构建是否成功,小鼠体内炎症因子和免疫细胞的变化情况也是非常重要的判定指标。用qPCR检测相关的炎症因子和免疫细胞的表面标记物的基因表达情况,与Control组相比,CeD组中小鼠体内的多种促炎性因子的基因相对表达量均极显著或高度显著升高(P<0.01、P<0.001),同时在乳糜泻免疫过程中起着重要作用的CD4+T细胞、巨噬细胞、浆细胞和B细胞的表面标志物水平也都显著增长,从而能够确定该模型在免疫方面也可以用于模拟人类临床上的乳糜泻。
4 结 论
本研究通过无麸质饮食饲养小鼠3 代以上,饲喂含麸质的饲料30 d,辅以腹腔和肌肉注射麦醇溶蛋白进行刺激,可以使小鼠的十二指肠绒毛长度明显缩短、V/C值显著减小,同时会破坏小鼠的肠道屏障,增加小鼠肠道通透性。此外,TG2、IL-15和IFN-γ这3 种乳糜泻发生的标志性产物对应mRNA(TGM2、Il15和IFNG)的相对表达量都高度显著增加(P<0.001)。十二指肠中与乳糜泻发病机制有关的免疫因子以及产生免疫因子的细胞数量均显著增加,与乳糜泻临床病人的病理特征一致。结果表明,该小鼠模型可以用于模拟乳糜泻疾病在临床上的组织病理学特征和常见生物标志物的表达,可应用于未来乳糜泻潜在的治疗措施(如改善肠道环境、阻断炎症反应等方法)研究中或与之相关的功能性食品的开发中。
目前乳糜泻的研究进展还比较缓慢,主要原因之一是当前关于乳糜泻的研究模型较少,并且已有的动物模型都还不能完全模拟人体内乳糜泻的发病过程,现有的模型都只能模拟部分症状,这些模型可以对乳糜泻的相关特征进行分离,有助于帮助理解每个特定因素在乳糜泻的病理机制中的作用,并且可以为开发乳糜泻新的治疗方法提供思路,但是这也是目前乳糜泻动物模型依然存在的缺陷,所以如何构建出更全面的乳糜泻动物模型仍是未来乳糜泻研究关注的重点之一。
