局部氧疗联合重组牛碱性成纤维细胞生长因子合并负压引流技术应用在慢性难愈性创面的疗效
2022-11-30白子烨王怀谷张莉朱坤崔雷韩娜王硕
白子烨 王怀谷 张莉 朱坤 崔雷 韩娜 王硕
蚌埠医学院第一附属医院整形外科(安徽 蚌埠 233004)
慢性创面的概念是指经过正规治疗持续3个月以上情况无明显改善[1]。现临床上更多地将其定义为各种因素导致的经过4周以上规范治疗仍未痊愈进而出现病理性炎症的创面。其发生机制复杂,各种病理状态导致慢性伤口发展,主要继发于动脉或静脉功能不全、糖尿病、皮肤压力过大、异物存在、感染以及放射性溃疡等[2]。慢性难愈性创面主要为高龄患者和患有内分泌疾病的患者,其住院周期长,住院费用高昂成为关键难题,给患者以及家庭都带来巨大的经济负担和心理负担。局部氧疗(local oxygen therapy)是一种直接作用于创面,效果显著的治疗方式,成本低且不良反应少。负压封闭引流技术(vacuum sealing drainage,VSD)在治疗慢性创面上发展较为成熟,经过持续负压可有效清除创面坏死组织,预防感染,加速创面愈合。重组牛碱性成纤维细胞生长因子(recombinant bovine basic fibroblast growth factor,rbbFGF)可对上皮细胞、真皮细胞、成纤维细胞、血管内皮细胞等产生刺激,其对创面修复过程的几个阶段均有不同程度的促进作用,促使创面毛细血管增多,增加血液流量,进而改善创面微循环,对创面愈合起到一定积极作用[3]。有研究显示,局部氧疗能改善创面的基础环境,为创面愈合提供了良好的基础,rb-bFGF应用于创面能明显提高创面愈合率,缩短其愈合时间。结合国内外文献VSD联合局部氧疗合并rb-bFGF应用在慢性难愈性创面修复中的具体效果报道较少。本文就VSD联合局部氧疗合并rb-bFGF效果与VSD联合生理盐水治疗效果作对比分析,为临床治疗提供参考,报告如下。
1 资料与方法
1.1 一般资料选取2020年10月至2021年10月蚌埠医学院第一附属医院整形烧伤科收治的40例慢性难愈性创面,按照随机数字表法将40例患者分为对照组和观察组。两组患者入院相关临床资料比较差异均无统计学意义(P>0.05),见表1。本研究已获得患者及家属知情同意,并签署知情同意书,研究方案获得蚌埠医学院第一附属医院医学伦理委员会批准(批件号:2020KY045)。
表1 两组患者一般临床资料比较Tab.1 Comparison of general clinical data of two groups of patients±s
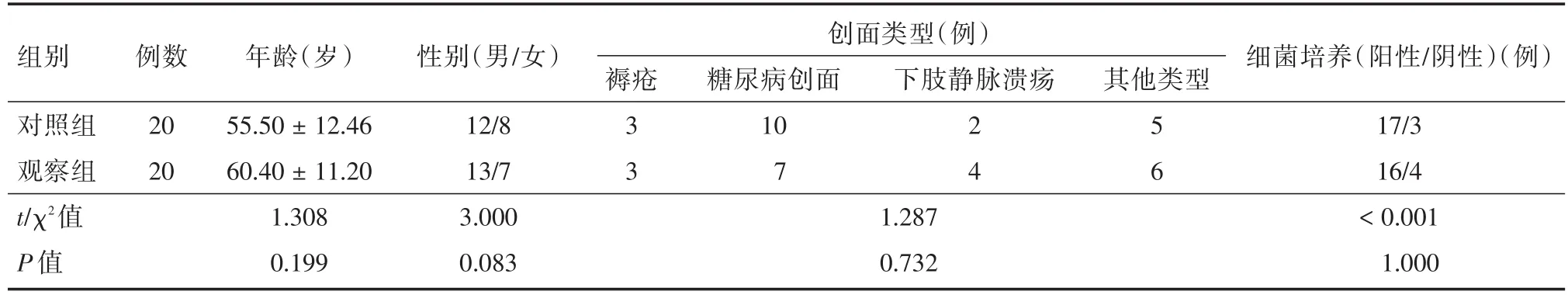
表1 两组患者一般临床资料比较Tab.1 Comparison of general clinical data of two groups of patients±s
组别对照组观察组t/χ2值P值例数20 20年龄(岁)55.50±12.46 60.40±11.20 1.308 0.199性别(男/女)12/8 13/7 3.000 0.083下肢静脉溃疡创面类型(例)褥疮 其他类型3 3糖尿病创面10 7 2 4 5 6 1.287 0.732细菌培养(阳性/阴性)(例)17/3 16/4<0.001 1.000
1.2 纳入标准与排除标准
1.2.1 纳入标准(1)年龄18~82岁;(2)符合慢性难愈创面的诊断标准:创面经常规换药清创治疗4周以上无好转迹象或加重者;(3)病情稳定无明显手术禁忌者。
1.2.2 排除标准(1)依从性差、数据删失(病历资料缺失或失访)的患者;(2)研究过程中出现过敏不良反应或其他严重不良事件者;(3)有精神或者认知功能障碍患者;(4)近期服用抗凝药物或者免疫抑制剂的患者;(5)处于妊娠期、哺乳期的妇女;(6)创面面积>100 cm2、下肢严重坏疽的患者;(7)患有免疫系统疾病以及血液系统疾病等影响创面愈合疾病的患者;(8)恶性肿瘤导致的溃疡。
1.3 方法入院后均行手术治疗,患者入手术室麻醉满意后,彻底暴露创面,常规碘伏消毒铺巾。用组织剪修剪创面,彻底将创面的分泌物及坏死肉芽组织清除,并去除坏死的皮缘,用刀柄将创面刮至出血,用双氧水、生理盐水、碘伏、生理盐水反复清洗伤口后蘸干,酒精擦拭创缘周围皮肤。对照组彻底清创后予以VSD(采用广州市快康医疗器械有限公司,由聚乙烯醇明胶海绵材料、三通及单通接口、生物透性贴膜、负压引流装置组成)。修剪VSD敷料与创面相一致的形状,覆盖在创面上或部分置于创面空腔内(创面存在空腔时),敷料一侧存在引流管与聚乙烯明胶海绵内引流管相连,对创面周围皮肤酒精擦拭后,用贴膜盖在敷料及引流管、冲洗管上,确保VSD处于密封状态。引流管接至负压吸引装置,设置负压为125 mmHg,保持负压封闭引流状态。联合生理盐水持续负压冲洗引流7 d后,打开VSD敷料,若创面有肉芽组织生长达到修复标准,则进行取皮植皮或皮瓣修复术,若创面达不到修复条件,则更换敷料继续负压引流,直到创面达到修复条件。观察组采用VSD联合局部氧疗合并rb-bFGF溶液灌洗创面治疗,局部氧疗的采用双孔鼻氧管,将其置入聚乙烯明胶海绵内,用贴膜盖在敷料及无菌氧气管、引流管、冲洗管上,确保VSD处于密封状态。引流管接至负压吸引装置,设置负压为125 mmHg,无菌吸氧管连接中心吸氧,氧气流量2 L/min,24 h不间断给氧。保持负压封闭引流状态。rb-bFGF溶液配置:500 mL生理盐水加入1支rb-bFGF,浓度配比为420 IU/100 mL(国药准字S200400001珠海亿胜生物制药有限公司规格:21 000 IU/5 g/支)。每天通过引流管向创面注入rb-bFGF溶液,待溶液与创面充分浸润30 min后重新开始负压引流,同时对创面实施持续冲洗。与对照组相同,7 d后打开VSD敷料,若创面内的肉芽组织的生长情况达到修复标准,则进行取皮植皮或皮瓣修复术,若创面达不到修复条件,继续上述方法直至创面达到修复标准。两组均针对创面细菌培养结果予以抗感染治疗。
1.4 观察指标
1.4.1 住院时间及住院费用对两组患者住院时间及住院费用比较。
1.4.2 临床疗效对两组患者进行临床疗效判定,临床疗效判定标准:治疗后临床表现及症状明显缓解,且创面愈合率≥80%提示为显效,治疗后临床表现及症状在一定程度上有所缓解,且创面愈合率约在50%~80%为有效,治疗后创面扩大,组织坏死,创面愈合率≤50%,则判定为无效。
1.4.3 NRS疼痛评分采用NRS疼痛数字分级法(NRS)对两组患者术前及术后7、14 d进行疼痛评分,数字分级法用0~10代表不同程度的疼痛,0为无痛,10为剧痛。疼痛程度分级标准为:0:无痛;1~3:轻度疼痛;4~6:中度疼痛;7~ 10:重度疼痛。
1.4.4 HE染色观察炎性细胞浸润取两组患者术前及术后7 d同一部位创面组织,比较两组创面组织炎性细胞数量变化。
1.4.5 创面组织中VEGF以及HIF-1α的表达水平通过柱状图比较两组患者术前及术后7、14 d创面组织中VEGF以及HIF-1α的表达。留取两组患者术前及术后7、14 d创面中心同一部位肉芽组织1份,放入4%多聚甲醛内固定24 h。固定好的组织经全自动脱水机脱水,包埋,切片(4~5 μm)后行免疫组化染色。
1.5 统计学方法使用SPSS 22.0软件对数据进行统计分析。对数据进行正态分布检验,两组符合正态分布的计量资料对比采用独立样本t检验,两组不符合正态分布的计量资料对比采用非参数检验;两组计数资料对比采用χ2检验;不同时间点的NRS评分、VEGF、HIF-1α对比采用重复测量方差分析。当P<0.05时认为差异有统计学意义。
2 结果
2.1 两组住院时间及住院费用比较对照组平均住院时间(34.75±12.01)d,观察组平均住院时间(27.50±8.91)d;对照组平均住院费用(33 218.28±15 904.49)元,观察组平均住院费用(24 283.97±7 455.95)元;观察组住院时间与住院费用均明显低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组住院时间及住院费用对比Tab.2 Comparison of hospitalization time and hospitalization costs between the two groups±s

表2 两组住院时间及住院费用对比Tab.2 Comparison of hospitalization time and hospitalization costs between the two groups±s
例数20 20组别对照组观察组t/Z值P值住院时间(d)34.75±12.01 27.50±8.91-2.168 0.037住院费用(元)33 218.28±15 904.49 24 283.97±7 455.95-2.299 0.021
2.2 两组患者临床疗效比较对照组的总有效率为65%,观察组的总有效率为95%,观察组的总有效率明显高于观察组总有效率,差异有统计学意义(P<0.05)。见表3。

表3 两组临床疗效对比Tab.3 Comparison of clinical efficacy between the two groups例
2.3 两组患者NRS疼痛评分比较不同时间测量的NRS评分差异有统计学意义(F=96.665,P<0.05);并且时间与组别存在交互作用(F=16.034,P<0.05);组别间方差分析结果差异有统计学意义(F=5.205,P=0.028),即两组处理因素对NRS评分具有显著影响。进一步做简单效应分析显示,术后7 d和术后14 d,两组NRS评分均明显低于术前(P<0.05),且观察组术后14 d NRS评分明显低于术后7 d(P<0.05);两组在术后7 d和术后14 d,组间对比差异有统计学意义(P<0.05)。见表4。
表4 两组患者NRS疼痛评分比较Tab.4 Comparison of NRS pain scores between the two groups of patients±s
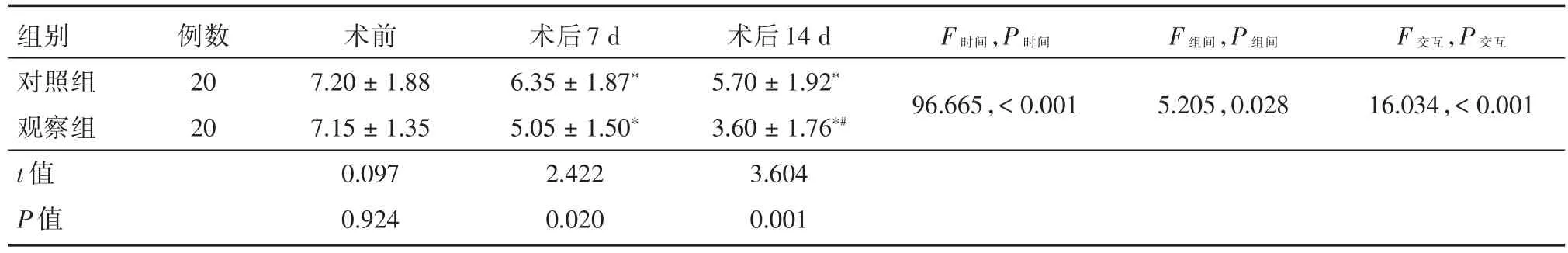
表4 两组患者NRS疼痛评分比较Tab.4 Comparison of NRS pain scores between the two groups of patients±s
注:与术前比较,*P<0.05;与术后7 d比较,#P<0.05
F时间,P时间F组间,P组间F交互,P交互组别对照组观察组t值P值例数20 20 96.665,< 0.0015.205,0.02816.034,< 0.001术前7.20±1.88 7.15±1.35 0.097 0.924术后7 d 6.35±1.87*5.05±1.50*2.422 0.020术后14 d 5.70±1.92*3.60±1.76*#3.604 0.001
2.4 两组创面组织炎性细胞数量变化两组患者分别于第一次以及第二次手术时,取创面同一部位皮缘组织作HE染色。对照组以及观察组第一次创面组织炎症反应明显,炎性细胞数量均较多。对照组常规治疗后,炎症细胞数量视野中有所减少。观察组经过联合治疗后,炎性细胞数量减少较对照组更加明显,且再上皮化率较高,见图1。
2.5 两组患者创面组织VEGF以及HIF-1α的阳性染色AOD值比较不同时间测量的VEGF差异有统计学意义(F=303.243,P<0.05);并且时间与组别存在交互作用(F=10.931,P<0.05);组别间方差分析结果显示差异有统计学意义(F=31.107,P<0.05),即两组处理因素对VEGF具有显著影响。进一步做简单效应分析显示,术后7 d和术后14 d,两组VEGF均明显高于术前(P<0.05),且两组术后14 d VEGF均明显高于术后7 d(P<0.05);两组在术后7 d和术后14 d,组间对比差异有统计学意义(P<0.05)。见表5。不同时间测量的HIF-1α差异有统计学意义(F=706.431,P<0.05);并且时间与组别存在交互作用(F=52.863,P<0.05);组别间方差分析结果显示差异有统计学意义(F=143.397,P< 0.05),即两组处理因素对 HIF-1α具有显著影响。进一步做简单效应分析显示,术后7 d和术后14 d,两组HIF-1α均明显低于术前(P<0.05),且两组术后14 d HIF-1α均明显低于术后7 d(P<0.05);两组在术后7 d和术后14 d,组间对比差异有统计学意义(P<0.05)。见表6。
表5 两组患者创面组织VEGF阳性染色AOD值比较Tab.5 Comparison of AOD values of VEGF positive staining in wound tissue of two groups of patients±s

表5 两组患者创面组织VEGF阳性染色AOD值比较Tab.5 Comparison of AOD values of VEGF positive staining in wound tissue of two groups of patients±s
注:与术前比较,*P<0.05;与术后7 d比较,#P<0.05
F时间,P时间F组间,P组间F交互,P交互组别对照组观察组t值P值例数20 20 303.243,< 0.00131.107,< 0.00110.931,< 0.001术前0.21±0.02 0.22±0.02-1.673 0.103术后7 d 0.36±0.06*0.47±0.12*-3.598 0.001术后14 d 0.51±0.08*#0.66±0.08*#-5.564<0.001
表6 两组患者创面组织HIF-1α阳性染色AOD值比较Tab.6 Comparison of AOD values of HIF-1α positive staining in wound tissue of two groups of patients±s

表6 两组患者创面组织HIF-1α阳性染色AOD值比较Tab.6 Comparison of AOD values of HIF-1α positive staining in wound tissue of two groups of patients±s
注:与术前比较,*P<0.05;与术后7 d比较,#P<0.05
F时间,P时间F组间,P组间F交互,P交互组别对照组观察组t值P值例数20 20 706.431,< 0.001143.397,< 0.00152.863,< 0.001术前0.31±0.02 0.31±0.02-0.657 0.515术后7 d 0.26±0.02*0.18±0.02*15.094<0.001术后14 d 0.18±0.03*#0.11±0.02*#8.049<0.001
2.6 典型病例观察组患者,女,62岁,因骶尾部创面不愈合2个月余诊断为骶尾部压疮Ⅳ级,在院外对症处理换药后创面继续坏死不愈合至我院。入院完善相关检查后,可见骶尾部一直径约5 cm圆形创面,创面内空腔较大,创面皮缘颜色较红,创缘基底脓性分泌物覆盖伴脓性渗出,腐臭味及痛觉明显,感染重且渗液多,无法封闭创面,与患者及家属沟通病情后,在局麻下行骶尾部创面坏死组织清创+VSD术,术后采用持续创面局部氧疗联合rb-bFGF灌洗,术后7 d打开VSD,此时创面在治疗后有明显改善,感染基本控制,渗液较之前减少,创面内肉芽组织较新鲜,放置第二次VSD,持续创面局部氧疗联合rb-bFGF灌洗,术后7 d打开VSD,可见大量肉芽组织填满创面,可直接行取皮植皮术封闭创面,术后伤口愈合良好,创面治疗显效(图2)。
3 讨论
慢性难愈性创面的治疗一直是临床上的难题,其通常具有细菌感染,缺氧,缺少生长因子,脓性及坏死组织难以清除等特点而无法愈合,普通的换药无法解决。大多数慢性难愈性创面是继发于血管性疾病以及内分泌疾病、褥疮等,是一种长期消耗性疾病,有着较高的致残率和致死率[4],具有覆盖多学科、病情迁延、容易复发、治疗时间长、难度大、费用高、致残率较高等特点,对患者有着极大的影响[5]。近年来,随着医学技术的发展以及治疗方法的创新,修复慢性难愈性创面的方法也越来越多样化,如负压创面治疗技术、新型敷料应用、富血小板血浆和外源性表皮生长因子应用、高压氧舱、干细胞移植、组织工程材料等。但大部分治疗方法费用昂贵,对患者造成较大的经济负担。
慢性难愈性创面的发生机制复杂,创面愈合过程是一个动态的过程,包括出血、炎症反应、肉芽组织形成和组织重塑四个阶段,但此过程可能在各种因素作用下被破坏,形成病理性炎症反应,最终导致慢性难愈创面。对于局部氧疗作为慢性难愈性伤口的辅助治疗一直存在争议,尚未有明确的机制。临床上采用的大多是高压氧疗,但是高压氧舱费用高昂,同时有多种禁忌症以及不良反应。在生理条件下,创面恢复需要大量氧气,创面会形成低氧微环境,低氧会刺激组织再生,但是在病理条件下,长时间的低氧状态导致低氧应答受损,低氧会成为慢性难愈性创面不能愈合的重要因素[6]。在过去的几十年里,有不少案例表明局部氧疗对加速慢性伤口愈合有促进作用[7-13]。局部氧疗(TOT)可以定义为通过连续扩散或加压系统将氧气局部应用于受伤组织。有研究提出伤口延缓愈合的主要原因是血管断裂面的低氧血症,理论上能改善创面局部缺血、缺氧状态的措施都有利于创面的愈合,局部氧疗可以直接作用于创面表面增加局部创面的氧含量,改善受损细胞的低氧分压,促进组织愈合[14]。氧气刺激巨噬细胞以及中性粒细胞的产生,中性粒细胞和巨噬细胞通过产生强大的活性氧(ROS)来清除伤口细菌及其他物质。活性氧的生成需要大量的能量和氧气,导致局部细胞耗氧量显着增加,即没有足够的氧气,细菌将无法被彻底清除。创面愈合的级联反应几乎每一步都需要氧气,慢性创面的典型特征是缺氧,其创面中心的氧分压通常低于正常再生过程所发生的酶促反应所必需的氧分压的临界阈值,血供差、慢性炎症、细菌过多等都会导致慢性缺氧。氧气是许多生化反应的限速底物,在能量产生和细胞代谢中起着至关重要的作用[15]。王健楠等[16]通过动物实验研究发现,负压吸引的基础上加用局部给氧治疗相比单纯负压吸引,明显缩短愈合时间。以上研究也从侧面佐证了本研究的结论。rb-bFGF是一种多功能细胞生长因子,在不同程度上促进创面愈合。其作用机制是通过刺激创面内失活的巨噬细胞,释放内源性生长因子,激活休眠的修复细胞,加速创面愈合[17]。
缺氧诱导因子1(HIF-1)是一种碱性螺旋-环-螺旋-PAS结构域转录因子,在机体对低氧浓度或缺氧应答中至关重要。它由两个亚基组成:氧调节的α-亚基和组成型表达的β-亚基。在氧浓度正常情况下,HIF-1α特定位置脯氨酰残基羟基化后会立即引起泛素化,接着便是亚基蛋白酶体降解。反之,在低氧条件下,HIF-1以细胞特异性表达方式调控数百个基因的转录。HIF-1在缺氧条件下充当了许多缺氧诱导基因的主要调节因子,HIF-1α正是HIF-1的活性亚基——即HIF-1发挥功能的主要部分。HIF-1α上调参与糖代谢、红细胞生成、铁转运、血管张力控制和血管生成的基因。研究发现,HIF-1/VEGF信号通路对血管新生具有重要调控作用。低氧状态下,HIF-1诱导启动VEGF的转录,HIF-1可在短时间内使VEGF增加30倍。而局部氧疗可以增加活性氧的产生,活性氧是调节VEGF产生和多种细胞反应的信号分子,可诱导VEGF的释放[18-20],VEGF刺激血管生成促进创面愈合。慢性创面长期处于缺血缺氧,早期急性创面可能会刺激HIF-1α启动低氧状态的调节系统,使VEGF短时间内表达增加。长期局部创面低氧,会导致VEGF调控血管生成障碍,导致创面迁延不愈。虽然急性、短期缺氧确实可以刺激血管生成,但慢性缺氧不仅会阻碍血管生成,还会阻碍生长因子上调、细胞信号传导和细菌杀灭所必需的活性氧的相关生成。
血管生成是促进创面愈合的基础,应用重组牛碱性成纤维细胞生长因子(rb-bFGF)刺激失活的巨噬细胞,由其释放内生性的生长因子,加速愈合过程,加快新生血管增生速度,保证创面组织的血供,使创面从炎症状态更快达到可植皮修复或者皮瓣修复的条件。局部氧疗从根本上可使创面长期缺氧得到改善,观察组术后7、14 d HIF-1α表达明显减少,VEGF表达增加较对比组也更加明显。而本研究发现观察组打开后创面血供较好且有丰富的新生肉芽组织,可以认为局部氧疗联合重组牛碱性成纤维细胞生长因子可促进血管生成和细胞生长,促进组织修复,同时联合使用VSD可以更好的封闭创面,吸收创面的渗出液,有利于创面液体平衡,减少细菌生成,本文研究的是VSD与局部氧疗以及rb-bFGF灌洗的联合使用,多种方法新型联合的应用使得患者无论在住院时间、住院费用,还是在治疗总有效率都优于对照组,从组织学角度观察,观察组创面组织HE染色观察炎性细胞表达明显减少。观察组创面组织VEGF及HIF-1α免疫组化染色提示,VEGF表达量增高较对照组更明显,HIF-1α表达量减少幅度较对照组也更明显。根据上述可得出,这种新型联合治疗对可促进慢性难愈性创面修复,提高临床治疗效果。
LAVERY等[21]在2020年提出向伤口输送氧气一直是慢性创面管理的一个巨大挑战,包括胶原合成、细胞增殖、细胞分化和新血管形成以及限制细菌感染在内的整个伤口愈合过程中发挥着至关重要的作用。YAO等学者[22]提出应用rb-FGF后3周伤口完全闭合的发生率显著增加68%,伤口完全闭合的时间缩短了24%。本研究结合国内外最新的局部氧疗系统应用,并联合生长因子灌洗,再次在临床中证明,VSD与局部氧疗以及rbbFGF灌洗这种治疗方法在慢性难愈性创面中的治疗发挥着重要的作用,这种新型联合治疗更加以患者的立场为出发点,在节省费用且降低住院时间的同时加快创面愈合。但是,由于患者数量有限,VSD联合局部氧疗和VSD联合rb-bFGF分别作用于创面的效果尚不明确,此外如何让给予创面氧供方法尚无统一标准,不同氧气的浓度对于创面的愈合有无差异也尚不明确,这也是本研究的不足之处。因此,在随后的研究中将继续完善和补充,VSD联合局部氧疗和VSD联合rb-bFGF分别作用于创面的效果,研究根据不同的创面类型选择不同的供氧方式,不同浓度的氧气对于创面愈合的影响。
