miR-let-7c通过介导精原干细胞分化改善小鼠精子质量的作用机制
2022-11-30王明萨如拉王超奇燕贞
王明 萨如拉 王超奇 燕贞
内蒙古民族大学附属医院1生殖医学中心,2男科实验室,3泌尿外科(内蒙古 通辽 028000);4海南医学院(海口 571199)
精子的形成是哺乳动物生殖系统中一个复杂的发育过程,由精原干细胞(spermatogonial stem cells,SSCs)分化而成[1]。SSCs能够维持干细胞池的自我更新使精子连续分化分裂,表现在啮齿动物生精上皮细胞克隆排列,通过分子标记(例如,ID4、GFRa1、PLZF、SALL4等)可评估睾丸SSCs维持精子发生的水平[2]。SSCs对精子发生至关重要,但仅占成年小鼠睾丸总细胞的0.02%~0.03%[3]。由于它是唯一能够将遗传信息传递给下一代的干细胞。因此,它们是基因改造实验的有前途的资源。其次,生命过程中的自我更新和SSCs的分化能力可用于阐明导致精子发生的信号通路。最后,SSCs的全能性可分化为所有细胞系[2,4]。因此,SSCs可用于生殖医学中治疗不孕症以及非免疫排斥性疾病[5]。
最近有研究[6]表明,微小 RNA(microRNA,miRNA)是一类内源性单链RNA分子(18-25个核苷酸),参与不同的细胞过程,包括自我更新、增殖、分化和凋亡。它们与靶mRNA的3'非翻译区(untranslated region,UTR)结合,导致靶mRNA的核酸内切裂解或翻译抑制[7]。多项研究发现miRNA可以调节SSCs增殖和分化之间的平衡,认为miRNAs是精子发生的重要调控元件[8-9]。例如,在SSCs中miRNA-100的高表达通过STAT3促进其增殖[9]。此外,SSCs的自我更新受miRNA-10b 和miRNA-322 的调节[2,10]。miRNA-202 对细胞周期调节因子和RNA结合蛋白的抑制导致精原干细胞的存活[11]。有研究指出miR-let-7家族与精原细胞自我更新相关的基因的调控相关[12]。但是,单个miRNA对于调节SSCs的功能和分子机制的必要性值得进一步研究。
1 材料与方法
1.1 主要耗材和仪器氯胺酮、注射用环磷酰胺(美国Sigma-Aldrich公司);青霉素和链霉素、PBS、DNase(美国Sigma-Aldrich公司);Ⅳ型胶原酶(美国Gibco公司);透明质酸酶、台盼蓝(美国Sigma-Aldrich公司);一抗ID4和Thy1、二抗FITC山羊抗兔IgG H&L(美国CST公司);白血病抑制因子(美国Sigma公司);碱性成纤维细胞生长因子(美国Peprotech公司);β-巯基乙醇、神经胶质细胞系衍生神经营养因子、miR-let-7c抑制剂(美国Sigma-Aldrich公司);Lipofectamine 2000、Opti-MEM(美国Invitrogen公司);TRIzol试剂(美国Invitrogen公司);逆转录试剂盒(日本Takara公司);GoTaq qPCR Master Mix(美国Promega公司);ABI7500 PCR扩增仪(美国Applied Biosystems公司);倒置显微镜(日本Olympus公司);4%多聚甲醛、Triton X-100、山羊血清(美国Sigma-Aldrich公司);cKit、FITC、DAPI(英国Abcam公司);荧光显微镜(日本Olympus公司);TriPure Isolation试剂(德国Roche公司);SDS-PAGE(美国BioRad Laboratories公司);PVDF膜(德国Roche公司);GAPDH、GFRα1、PLZF和ID4一抗、HRP偶联山羊抗兔二抗(英国Abcam公司)。
1.2 SSCs分离SPF级Balb/c雄性(3~6 d龄)和Balb/c雄性裸鼠(5~6周龄,体质量20~22 g)各40只购自北京华阜康生物科技股份有限公司,合格证号:SYXK(京)2019-0022,伦理审查编号:NM-LL-2022-07-19-1。参照之前的方法[13],进行SSC的分离。简而言之,Balb/c小鼠使用0.05 mg/kg氯胺酮麻醉;然后取出的睾丸立即转移到含有PBS的培养皿中。在无菌条件下,用1%青霉素和链霉素的PBS洗涤样品。切碎的睾丸转移到含有5 μg/mL DNase、1 mg/mLⅣ型胶原酶和1 mg/mL透明质酸酶的消化培养基中。然后在37℃和5%CO2下孵育20 min。每5分钟轻轻移去上层悬浮液。以1 500g离心5 min。使用相同的消化培养基纯化细胞沉淀15 min。最后,使用血细胞计数器,0.04%台盼蓝评估细胞的活力。
1.3 SSCs纯度测定参照之前的方法[14],使用ID4和Thy1标记细胞,使用流式细胞术进行纯度测定。简而言之,将1×105个细胞在100 μL PBS/FBS和10 μL一抗(ID4和Thy1)中4℃孵育1 h。用PBS洗涤两次后,将细胞在100 μL PBS/FBS和10 μL二抗中4℃孵育1 h。FITC山羊抗兔IgG H&L用作ID4和Thy1的二抗。对照组细胞不与抗体一起温育。最后,细胞保存在冰上的暗室中,通过流式细胞术测定纯度百分比。
1.4 SSCs培养使用含有DMEM培养基培养纯化后的细胞(2×105细胞/cm2),在培养基中加入成分:10%FBS、10 ng/mL白血病抑制因子、10 ng/mL碱性成纤维细胞生长因子、0.1 mmol/L β-巯基乙醇、10 ng/mL神经胶质细胞系衍生神经营养因子、1%青霉素和链霉素。所有培养物在37℃下在5%CO2的加湿培养箱中培养,培养基每2~3 d更换一次。
1.5 细胞转染培养的SSC分为4组:(1)未转染组;(2)miR-let-7c抑制剂组;(3)抑制剂对照组;(4)转染组。处理方式分别为:(1)未转染组:SSC细胞不接受转染处理,正常培养基培养;(2)miR-let-7c抑制剂组:lipofectamine 2000在Opti-MEM转染培养基中将含有miR-let-7c抑制剂的质粒转染至SSC细胞,转染后换正常培养基培养;(3)抑制剂对照组:lipofectamine 2000在Opti-MEM转染培养基中将含有miRNA抑制剂对照物的质粒转染至SSC细胞,转染后换正常培养基培养;(4)转染组:lipofectamine 2000在Opti-MEM转染培养基中处理SSC细胞,后换正常培养基培养。具体的转染方法参照文献[15]收集细胞用于评估蛋白表达的变化。1周后通过平板克隆实验评估SSC的增殖能力。
1.6 qRT-PCR为了验证miR-let-7c转染在SSC中的有效表达,使用qRT-PCR在转染后48 h检测miR-let-7c的表达量。TRIzol试剂用于总RNA提取。然后使用逆转录试剂盒用于合成cDNA。Go-Taq qPCR Master Mix为模板扩增试剂,ABI7500 PCR扩增仪用于检测miR-let-7c扩增表达量。U6 snRNA作为内参基因,通过2-ΔΔCT方法计算miR-let-7c表达量。引物序列如下:miR-let-7c F:5'-AATTCAAAAATGAGGTAGTAGGTTGTATGGTT-3';R:5'-CCGGAACCATACAACCTACTACCTCATTTTTG-3'。U6 F:5'-CTCGCTTCGGCAGCACA-3';R:5'-AACGCTTCACGAATTTGCGT-3'
1.7 SSCs增殖评估转染后,将2×105细胞/cm2SSCs接种到含有10%FBS、1%青霉素链霉素、10 ng/mL白血病抑制因子和10 μg/mL神经营养因子的DMEM中培养,存放在5%CO2、37℃存放1周。使用倒置显微镜测定集落的直径和数量。使用Image J软件对数据进行分析。
1.8 免疫组化SSC用4%多聚甲醛固定、0.1%Triton X-100透化,然后用10%山羊血清封闭1 h。将样品与C-Kit一起孵育24 h,然后与二抗FITC室温孵育2 h。细胞核用DAPI染色。荧光显微镜用于观察载玻片。
1.9 Western blotTriPure Isolation试剂用于提取SSC总蛋白。进行电泳以分离样本蛋白,将蛋白质转移到10%SDS-PAGE和PVDF膜上,并用5%脱脂牛奶封闭。随后,将样本与针对GFRα1、PLZF和ID4的一抗在4℃下孵育过夜。加入适当的二抗HRP偶联山羊抗兔后,将PVDF膜孵育2 h。最后,使用增强的化学发光评估蛋白质的表达。
1.10 在体实验Balb/c裸鼠适应性饲养5 d后,随机分为对照组、模型组、miR-let-7c抑制剂组、抑制剂对照组,每组10只。模型组、miR-let-7c抑制剂组、抑制剂对照组小鼠按照60 mg/(kg·d)腹腔注射环磷酰胺[16],连续5 d,对照组用等量生理盐水腹腔注射。第6天开始,miR-let-7c抑制剂组、抑制剂对照组小鼠分别给予附睾内注射转染miR-let-7c抑制剂的SSC或miRNA抑制剂对照物的SSC。到第30天,不同组小鼠经过干预后,颈椎脱臼处死小鼠,取双侧睾丸和附睾,参照之前的文献[17]对裸鼠精子浓度、活力及形态分析。
1.11 统计学方法采用GraphPad Prism 7.0软件,数据表示为均数±标准差。使用one-way ANOVA和Tukey post-hoc test分析数据。以P<0.05为差异有统计学意义。
2 结果
2.1 SSCs的鉴定使用流式细胞术分析未分化精原细胞标记物ID4和Thy1的表达,用于鉴定SSCs。SSCs中标记物的表达百分比分别为84.3%和97.4%(图1)。
2.2 评估SSC中miR-let-7c的表达miR-let-7c表达在转染前和转染后48 h使用qRT-PCR进行评估。结果表明,与未转染组相比,miR-let-7c抑制剂组的miR-let-7c表达水平显著降低(t=28.475,P<0.05)。在抑制剂对照组和转染组中没有观察到显著变化(P>0.05,图2)。
2.3 miR-let-7c的抑制诱导了小鼠SSCs的增殖转染1周后,倒置显微镜拍摄集落图像(图3A-F),使用Image J软件测量集落直径和数量。结果显示miR-let-7c抑制剂组的集落直径明显小于其他组(F=49.781,P<0.05),而集落数量与其他组无明显变化(P>0.05,图3G-H)。
2.4 miR-let-7c的抑制诱导了小鼠SSCs的分化c-Kit作为分化标志物在转染后48 h使用免疫细胞化学进行评估。与其他组细胞相比,miR-let-7c抑制剂组中c-Kit分化基因的表达显著增加(F=165.336,P< 0.05,图4)。这表明miR-let-7c的抑制诱导了小鼠SSCs的分化过程。
2.5 miR-let-7c的抑制下调了增殖相关蛋白的表达转染48 h后,Western blot用于研究增殖相关蛋白[(胶质细胞源性神经营养因子a1(glialcelllinederivedneurotrophicfactor a1,GDNFa1)、早幼粒细胞白血病锌指(PLZF,promyelocytic leukemia zinc finger)和分化抑制因子4(inhibitor of differentiation,ID4)]的表达。结果显示,与其他组相比,miR-let-7c抑制剂组中GFRa1、PLZF和ID4的表达显著降低(F=98.556、78.358、91.249,P< 0.05,图5)。
2.6 miR-let-7c的抑制对小鼠生长及精子质量的影响模型组精子质量较对照组显著下降,经miR-let-7c抑制剂转染后精子质量得到了显著恢复;精子浓度、精子活力和正常形态率均有显著提高(F=27.936、52.417、31.582、47.659,P< 0.05,表1)。
表1 不同组小鼠处理后精子质量比较Tab.1 Comparison of sperm quality in different groups of mice after treatment ±s
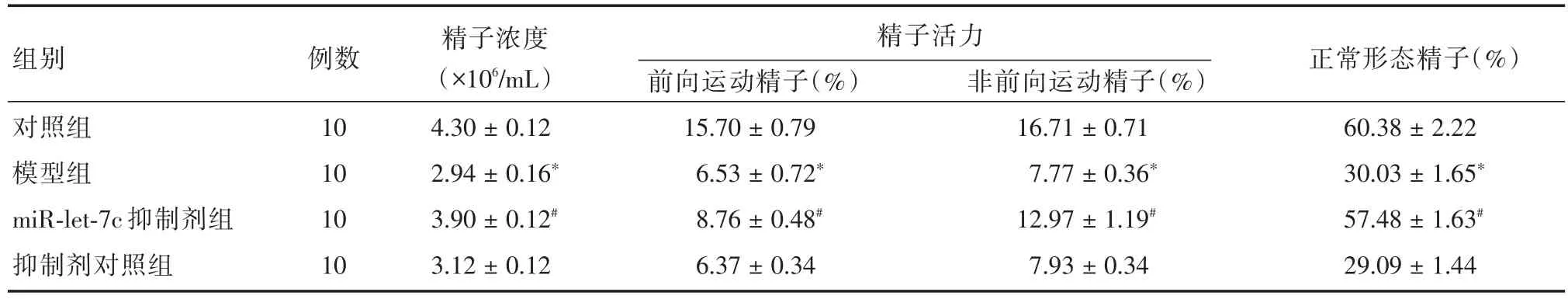
表1 不同组小鼠处理后精子质量比较Tab.1 Comparison of sperm quality in different groups of mice after treatment ±s
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
组别对照组模型组miR-let-7c抑制剂组抑制剂对照组例数10 10 10 10精子浓度(×106/mL)4.30±0.12 2.94±0.16*3.90±0.12#3.12±0.12精子活力前向运动精子(%)15.70±0.79 6.53±0.72*8.76±0.48#6.37±0.34非前向运动精子(%)16.71±0.71 7.77±0.36*12.97±1.19#7.93±0.34正常形态精子(%)60.38±2.22 30.03±1.65*57.48±1.63#29.09±1.44
3 讨论
SSCs在形成和促进精子发生方面发挥着重要作用。精子形成是一个受到高度调控化过程,需要在SSCs的增殖和分化之间获得平衡。这种平衡受内在因素和外在信号的调节,在决定精子的供应和生育能力方面起着关键作用[18]。miRNA对生物过程的调控至关重要,并且通过与其特定mRNA的3'UTR结合而发挥作用。最近的研究表明,多种miRNA可能通过调节靶基因表达促进哺乳动物的精子发生[19]。然而,单个miRNA调控精子形成机制和靶点大多是未知的。几项研究报告称,ID4的表达仅限于精原细胞并且ID4的过表达抑制了干细胞到祖细胞的转变[20]。因此,ID4可用于SSCs的识别和鉴定。Thy-1是Ig超家族的糖基磷脂酰肌醇锚定糖蛋白,已被引入牛、啮齿动物和灵长类动物中作为SSCs的鉴定标志物[21]。在经酶消化和原代培养后,用流式细胞术鉴定了细胞ID4和Thy1的表达比率并检测了该细胞的miR-let-7c基础表达水平,结果表明提取的细胞为SSCs。随后观察了miR-let-7c抑制剂处置后SSCs增殖和分化的改变,表现为miR-let-7c抑制剂可导致SSCs集落直径明显减小。因为SSCs首次出现在小鼠产后3~6 d。ID4在SSCs自我更新或未分化状态的调节中起着关键作用。ID4的表达仅限于As精原细胞,其过表达抑制了干细胞向祖细胞的转变。这些结果与其他研究一致[2,4,10]。
研究表明,在小鼠未分化SSCs中主要检测到GFRα1表达。GFRα1是GDNF的主要受体,被认为是GFRα1/RET信号通路的必要成分[22-23]。GDNF作为维持SSCs不可或缺的因素,通过与GFRα1/RET受体结合发挥作用,并调节参与促进SSCs自我更新或阻止SSCs分化基因的表达。早幼粒细胞白血病锌指PLZF的下调可导致mTORC1激活、GDNF受体(包括GFRa1和RET)的下调、SSCs对GDNF的反应的抑制以及SSCs增殖的抑制。此外,PLZF还直接和间接抑制分化基因c-Kit的表达[24-25]。在本研究中显示,细胞转染后48 h GFRα 1、PLZF和ID4蛋白的表达,GFRα1、PLZF和ID4蛋白的表达下调。这表明miR-let-7c的下调减少了SSCs的自我更新和增殖。
C-kit是Ⅲ类受体酪氨酸激酶的成员,它仅存在于分化的精原细胞中,被认为是精原细胞分化的良好表征的标志物。SSCs从未分化状态到分化状态的转变与Kit/Kitl系统的激活一致[26]。在c-kit激活之后,分化的SSCs将进入减数分裂并开始表达早期减数分裂标志物,包括STRA8、Dmc1和Scp3[27]。在免疫组化结果显示,与其他组相比,转染miR-let-7c抑制剂的SSCs中分化蛋白c-Kit的表达显著增加。表明miR-let-7c的抑制诱导了小鼠SSCs的分化过程。
根据既往研究中所述[17]的小鼠少弱精子症模型,发现模型制备后出现小鼠的精子数量减少、精子活力下降等生殖毒性,这是少弱精子症的具体表现,在此模型的基础上,研究了miR-let-7c的抑制剂对少弱精子症动物模型的治疗效果。结果发现miR-let-7c抑制剂干预30 d后,模型组睾丸组织损伤有所恢复,上述指标均得到了一定程度的改善,这证明转染miR-let-7c抑制剂的SSCs对少弱精子症具有一定的治疗效果。但同时,本研究也存在着局限性,例如应该在更多的鼠源性模型进行试验和验证,还应寻找SSCs的增殖和分化标志物进行验证。
综上所述,miR-let-7c抑制剂可能促进精原干细胞分化并改善小鼠精子质量。在以后的研究中,还会去寻找到类似的miRNA去探索和功能验证。
