不同蓝莓品种根际phoD基因相关土壤解磷细菌群落结构分析
2022-11-30吴叶娇曹成亮蒋瑀霁闾连飞吴文龙蒋继宏李荣鹏
吴叶娇,高 源,曹成亮,蒋瑀霁,闾连飞,吴文龙,蒋继宏,朱 泓*,李荣鹏*
(1.江苏师范大学生命科学学院,江苏省药用植物生物技术重点实验室,江苏 徐州 221116;2.江苏省中国科学院植物研究所,江苏 南京 210018;3.土壤与农业可持续发展国家重点实验室,中国科学院南京土壤所,江苏 南京 210008)
磷(phosphorus,P)是植物所需的重要营养元素之一,在植物生长和发育中起着关键作用[1-2]。土壤中总磷占0.04%~0.10%,其中只有1.00%~2.50%可被植物吸收[3]。土壤解磷微生物在代谢过程中可产生多种酶类(磷酸酶、核酸酶、植酸酶等),使有机磷化合物转化为植物可吸收利用的有效磷[4-5]。解磷细菌是土壤解磷微生物的主要组成部分,它能够在生命活动中产生磷酸酶,将土壤中的有机磷化合物(如卵磷脂和核酸等)分解或降解为有效磷素[6]。磷酸酶分为酸性磷酸酶(acid phosphatase,ACP)和碱性磷酸酶(alkaline phosphatase,ALP),前者由植物和微生物共同产生,后者仅由微生物产生[7]。有研究表明干旱会降低森林土壤ACP活性,而干旱情况下ALP活性仅在冬季降低[8],可见ALP活性在不良环境下更加稳定。进一步研究也表明,土壤微生物产生的ALP在酸性土壤条件下仍具有活性并发挥着重要作用[9-14]。phoD基因是编码细菌ALP的3个同源基因(phoA、phoD、phoX)之一[15-18],在陆地生态系统中普遍存在[16],研究该基因相关的细菌群落可以更好地了解旱地土壤解磷细菌状况。
植物根际土壤作为微生物与根系相互作用的媒介,在微生物和根系共同作用下形成了复杂的土壤微生态系统[19]。有研究表明,根际微生物群落结构通常在不同植物物种之间[20],以及单个物种的不同基因型之间有明显差异[21]。对模式植物拟南芥的研究表明,品种(基因型)介导了对根际相关微生物区系的微弱但可测量的影响[22];而对玉米和蓝莓的研究则表明,根际微生物群落的结构和组成受植物基因型的强烈影响[23-24]。此外,根际微生物多样性和组成也受土壤性质的影响[25-26]。解磷细菌等功能细菌是土壤细菌的重要组成部分,以往的研究多集中在植物种类、根系分泌物和土壤性质对根际总微生物群落的影响,但有关植物基因型和土壤性质对根际解磷细菌群落多样性和组成的影响仍有待进一步研究。
蓝莓(VacciniumasheiReade,简称RB)是一种杜鹃花科越橘属多年生果树[27],种植的地理区域已从美国和加拿大扩展到欧洲、智利中部、新西兰、澳大利亚、日本和中国。我国目前种植蓝莓的省市已达27个,北至黑龙江,南到海南岛,西到青藏高原均有种植[28]。蓝莓为须根系植物,根系深度一般为30~60 cm,其根际土易于收集,因而可作为研究木本植物根际微生物群落的良好对象。本研究收集了12个长期种植的兔眼蓝莓品种的根际土壤样品,利用高通量测序技术分析phoD基因相关的土壤解磷细菌群落结构及其与土壤理化性质间的关系,以期揭示不同蓝莓品种和土壤性质等因素对phoD基因相关的土壤解磷细菌组成的影响。
1 材料与方法
1.1 样品采集
采集地点位于南京市溧水区石头寨村江苏省中国科学院植物研究所蓝莓品种园(119°02′E ,31°65′N),该品种园于1988年首次引入兔眼蓝莓品种并种植至今。蓝莓园土壤类型为黄棕壤,施肥方式为每年冬季穴施羊粪。12个蓝莓品种为:RB1.‘粉蓝’(‘Powderblue’)、RB2.‘巨丰’(‘Delite’)、RB3.‘园蓝’(‘Gardenblue’)、RB4.‘森土里昂’(‘Centurion’)、RB5.‘梯芙兰’(‘Tifblue’)、RB6.‘灿烂’(‘Brightwell’)、RB7.‘顶峰’(‘Climax’)、RB8.‘杰兔’(‘Premier’)、RB9.‘乌达德’(‘Woodard’)、RB10.‘精华’(‘Choice’)、RB11.‘芭尔德温’(‘Baldwin’)、RB12.‘蓝美人’(‘Bluebelle’)。
2019年9月,采集树龄为30 a的12个兔眼蓝莓(RB)品种的根际土壤样品。每株根际土取5个样点,土钻采样深度为0~20 cm。将这5个样点的根际土样本混合成一个样品,每个品种取3株蓝莓根际土,为3个重复。采样时将蓝莓根系表面松软黏结的土壤,即蓝莓非根际土(bulk soil)抖下并收集作为试验对照;用无菌刷子收集50 g紧密黏附的根际土壤,再过4 mm筛子进行均质处理。
1.2 土壤理化性质测定
根据鲁如坤[29]的方法检测土壤理化性质。使用玻璃电极在土壤与水溶液(质量体积比为1∶2.5)中测定土壤pH。采用重铬酸钾氧化-外加热法测定土壤有机碳(SOC)含量,采用微量凯氏法测定土壤总氮(TN)含量,速效氮(AN)通过碱水解扩散法测定,土壤总磷(TP)和速效钾(TK)含量用HF-HClO4消化法测定,速效磷(AP)和钾(AK)含量分别用碳酸氢钠和乙酸铵提取,用钼蓝法测定。采用对硝基酸二钠比色法测定碱性磷酸酶(ALP)活性。105 ℃下将土壤烘干48 h后测定土壤含水率(WC),含水率=(鲜质量-干质量)/鲜质量。
1.3 土壤DNA提取及Illumina测序分析
使用MoBio PowerSoil DNA提取试剂盒(Mobio,Carlsbad,CA,USA)对0.25 g经过均匀化的土壤样品进行DNA提取。使用ABI GeneAmp 9700 PCR仪扩增phoD基因片段,引物为ALPS-F730 (5′-CAGTGGGACGACCACGAGGT-3′)和ALPS-R1101 (5′-GAGGCCGATCGGCATGTCG-3′)[30],扩增片段长度为371 bp左右。PCR 20 μL反应体系:4 μL 5×扩增缓冲液,2 μL dNTPs,0.8 μL ALPS-F730,0.8 μL ALPS-R1101,0.4 μLTaq聚合酶和10 ng 模板DNA,ddH2O补足至20 μL。扩增条件:95 ℃预变性5 min,95 ℃ 30 s、55 ℃ 30 s和72 ℃ 45 s共27个循环,72 ℃延伸10 min,冷却至4 ℃。用2%琼脂糖凝胶电泳检测PCR产物,用AxyPrep DNA凝胶提取试剂盒(Axygen Biosciences,Union City,CA,USA)进行纯化。将每个样品中等量的PCR产物组合成一个单管,在Illumina miseq平台上进行高通量测序。
使用QIIME分析[31]Illumina测序原始数据。去除低质量序列和模糊的测序读数(读数长度<150 bp,模糊碱基,引物错配,>6个均聚物,或平均质量得分<25)后,对原始序列进行分类,并通过独特的样本标签进行区分。在质量过滤后获得高质量序列读数,再根据NR数据库进行比对,这些高质量读数聚集成OTU数。为了最小化来自不同样品的读取计数变化的影响,进行下游分析之前,在相同的序列深度(每个样品30 000个序列)下对序列进行随机二次取样。使用R语言计算Shannon多样性指数和偏差校正的Chao1丰富度。
1.4 数据统计
数据差异显著性分析采用方差分析法(ANOVA)、Tukey 法(P<0.05)。通过R语言vegan包计算获得Shannon指数和Chao1丰富度。通过R语言vegan和ape包计算获得主成分分析(principal co-ordinates analysis,PCoA)。随机森林分析采用R语言randomForest 程序包计算,并分别用 rfUtilities 和 rfPermute 程序包检验模型和每个变量的P值。相关分析采用Perason相关系数法。
2 结果与分析
2.1 phoD基因相关土壤解磷细菌多样性和相对丰度
基于Illumina测序,共获得1 935 015个高质量序列读数,分别聚集成6 019个OTU。蓝莓根际phoD基因相关土壤解磷细菌群落的Shannon指数除了RB6均高于非根际土,phoD基因相关土壤解磷细菌群落的Chao1丰富度均显著高于非根际土(P<0.05,图1)。在12个兔眼蓝莓品种中,RB4具有最高的Shannon指数和Chao1丰富度。

不同字母表示差异显著(P<0.05)。下同。The different letters indicated the significant differences at P<0.05.The same below.图1 蓝莓根际phoD基因相关土壤解磷细菌Shannon指数和Chao1丰富度Fig.1 The Shannon index and Chao1 richness of phoD phosphate solubilizing bacteria in blueberry rhizosphere soil


*、**分别表示P<0.05和P<0.01水平。下同。*,** indicated the significant differences at the level of P<0.05,P<0.01.The same below.图2 蓝莓根际土壤理化性质对phoD基因相关土壤解磷细菌Chao1丰富度的影响Fig.2 Effects of soil physiochemical properties on Chao1 richness of phoD phosphate solubilizing bacteria in blueberry rhizosphere soil
蓝莓根际phoD基因相关土壤解磷细菌群落核心细菌群中,4个门/纲中7个最主要的菌目分别为:α-变形菌纲根瘤菌目(Rhizobiales,相对丰度45.91%)、红螺菌目(Rhodospirillales,相对丰度2.13%),β-变形菌纲伯克氏菌目(Burkhodlderiales,相对丰度6.70%),γ-变形菌纲黄单胞菌目(Xanthomonadales,相对丰度6.49%)、海洋螺菌目(Oceanospirillales,相对丰度3.79%)、假单胞菌目(Pseudomonadales,相对丰度2.42%),放线菌门链霉菌目(Streptomycetales,相对丰度2.58%)。
2.2 phoD基因相关土壤解磷细菌群落PCoA分析
利用主成分分析(PCoA)进一步可视化Bray-Curtis距离,以确定样本间的phoD基因相关解磷细菌群落组成。12个兔眼蓝莓品种的phoD基因相关土壤解磷细菌群落可以明显地被分为两组(图3),分别为RBⅠ(RB1、RB3、RB5、RB9、RB11、RB12)和RBⅡ( RB2、RB4、RB6、RB7、RB8、RB10)(R2=0.159,P=0.001),表明蓝莓基因型主要决定第1主坐标(PCoA1)。第2主坐标(PCoA2)表明,12个兔眼蓝莓品种的根际phoD基因相关解磷细菌群落比非根际土中的细菌群落分布更均匀。以上说明,蓝莓品种对根际phoD基因相关解磷细菌群落分组有显著的影响。

图3 蓝莓根际phoD基因相关土壤解磷细菌群落PCoA分析Fig.3 The PCoA analysis of phoD phosphate solubilizing bacteria community in blueberry rhizosphere soil
蓝莓根际phoD基因相关土壤解磷细菌群落被分成RBⅠ和RBⅡ两组。α-变形菌纲、β-变形菌纲和γ-变形菌纲为优势菌纲,其次是放线菌门细菌。蓝莓根际phoD基因相关土壤解磷细菌群落中的α-变形菌纲和β-变形菌纲细菌相对丰度较对照(非根际土壤)无显著差异(P>0.05),γ-变形菌纲细菌相对丰度显著高于CK(P<0.05)。RBⅠ组的α-变形菌纲细菌相对丰度显著高于RBⅡ组(P<0.05),其余细菌门/纲在RBⅠ组和RBⅡ组中则没有显著差异(图4)。

图4 蓝莓根际phoD基因相关土壤解磷细菌中主要纲的分布Fig.4 The distributions of major classes in phoD phosphate solubilizing bacteria community in blueberry rhizosphere soil
2.3 土壤其他理化性质与phoD基因相关土壤解磷细菌群落对AP含量和ALP活性的影响

通过 Pearson 相关分析评价优势门/纲细菌相对丰度与土壤AP含量的关系可知,α-变形菌纲细菌相对丰度与AP含量呈显著负相关,β-变形菌纲和γ-变形菌纲细菌相对丰度则与AP含量呈显著正相关(图5)。通过 Pearson 相关分析评价优势门/纲细菌相对丰度与土壤ALP活性的关系,α-变形菌纲细菌相对丰度和ALP活性呈显著负相关,β-变形菌纲和γ-变形菌纲细菌相对丰度都与ALP活性呈显著正相关(图5)。
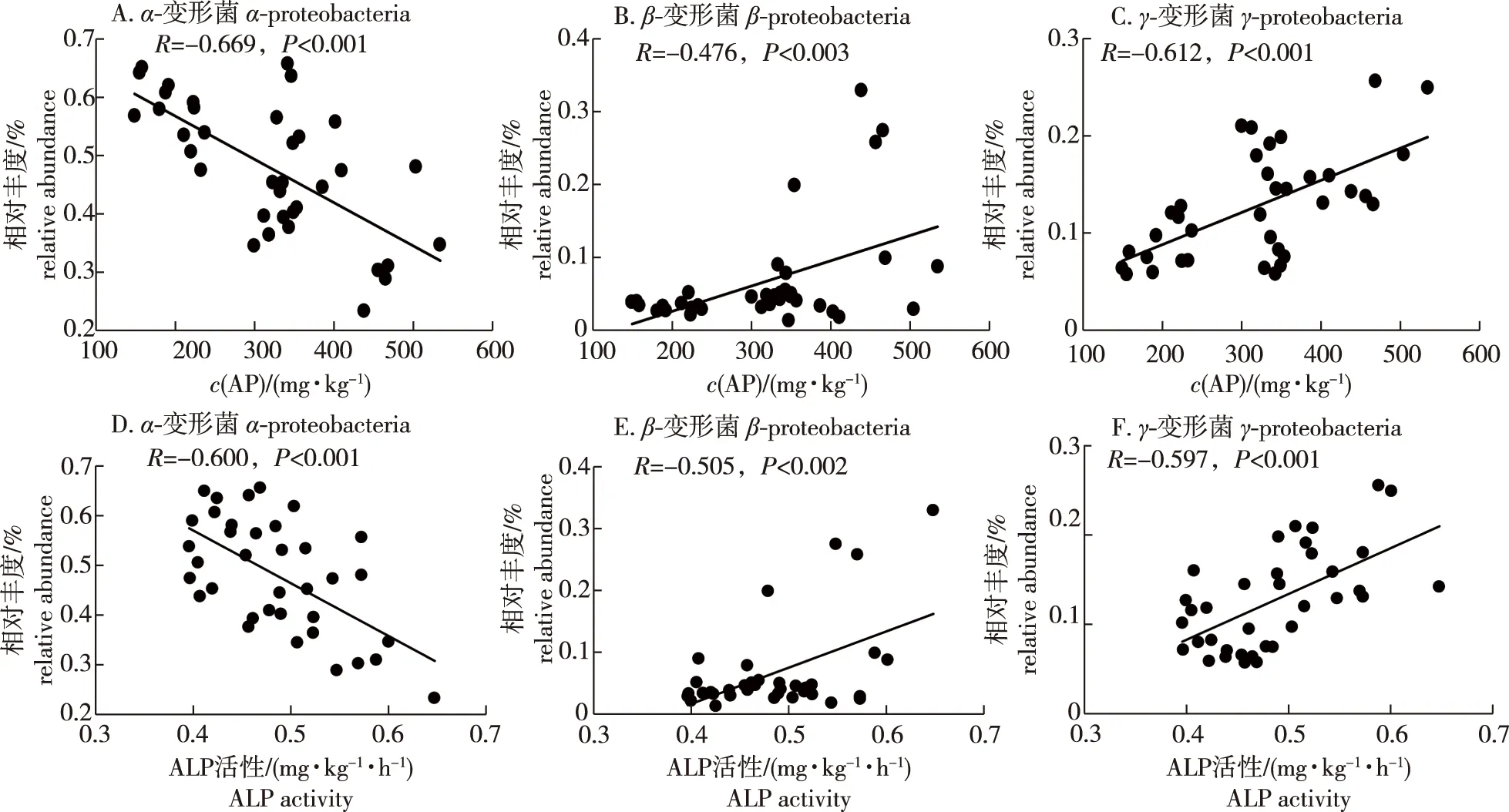
图5 蓝莓根际phoD基因相关土壤解磷细菌群落优势纲/门相对丰度与AP含量及ALP活性的相关性Fig.5 The relationships between AP content or ALP and the relative abundance of the dominant class in phoD phosphate solubilizing bacteria community
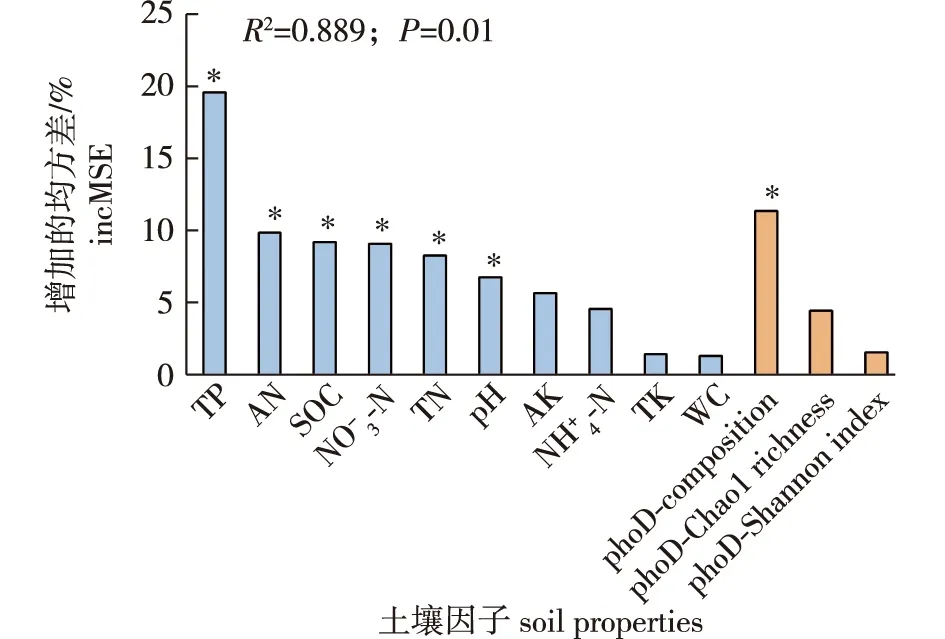
图6 土壤理化性质以及蓝莓根际phoD基因相关土壤解磷细菌群落的组成对土壤AP含量的影响Fig.6 Effects of soil physiochemical properties and phoD phosphate solubilizing bacterial community on soil AP content
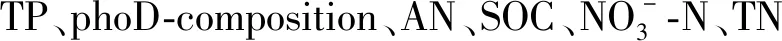
3 讨 论
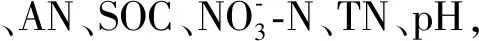
根际细菌对植物的生长、营养、健康有重要影响。植物也通过根系分泌物影响着根际细菌群落的结构及组成。Jiang等[24]的研究发现蓝莓根际细菌多样性显著低于非根际对照,反映了植物对根际细菌的筛选和驯化。而本研究中蓝莓根际phoD基因相关土壤解磷细菌群落多样性高于非根际对照,但差异未达到显著,该结果暗示蓝莓根际在对解磷细菌的驯化中可能并没有促进某几种特定根际功能细菌的生长繁殖。此外,有机肥的施用也会增加根际细菌群落多样性[33]。本研究发现,12个蓝莓品种中,RB4根际土壤不仅phoD基因相关土壤解磷细菌群落多样性和丰富度最高,土壤有机质SOC含量也最高。进一步通过随机森林分析发现,土壤理化因子对Chao1丰富度的随机森林模型中(P<0.05)贡献度最高的是SOC,而土壤理化因子对Shannon指数的随机森林模型则不具有显著性(P>0.05)。由此推测,蓝莓品种(基因型)仅通过影响土壤SOC含量来影响phoD基因相关土壤解磷细菌群落丰富度而非群落多样性。
植物的种类乃至品种和个体都可以显著影响根际微生物群落结构及组成[34]。本研究中,12个蓝莓品种根际phoD基因相关土壤解磷细菌群落在PCoA图中可被分为两组(RBⅠ和RBⅡ)。该结果证明了不同蓝莓品种不能显著影响根际解磷细菌这类根际功能细菌群落的结构和组成。在大豆、玉米等植物的研究中表明,基因型能显著影响根际菌群组成结构以及互作网络[35-36]。Jiang等[24]的研究确定了蓝莓根际细菌群落多样性和蓝莓系统发育距离一致,表明宿主基因型与菌落差异相关。本研究发现蓝莓根际phoD基因相关土壤解磷细菌群落多样性与蓝莓品种密切相关,推测蓝莓基因型可能也参与并促进了根际解磷功能细菌群落差异的产生。
蓝莓根际phoD基因相关土壤解磷细菌群落丰度高于非根际对照,表现出较强的根际效应。本研究发现,蓝莓根际phoD基因相关土壤解磷细菌群落,在门/纲水平上主要由变形菌门(α-变形菌纲、β-变形菌纲、γ-变形菌纲、δ-变形菌纲)和放线菌门细菌组成。在目水平上,主要由根瘤菌目、伯克氏菌目、黄单胞菌目、海洋螺菌目、假单胞菌目和链霉菌目细菌组成,该结果与前人报道[37-38]基本一致。有研究表明,γ-变形菌纲假单胞菌目是参与磷循环的主要细菌[39],与促进植物生长紧密相关。对假单胞菌菌株中phoD基因的鉴定[40]以及一些更深入的研究也表明该细菌有助于有机磷矿化[41-42]。此外,对β-变形菌纲伯克氏菌目[43]和γ-变形菌纲黄单胞菌目[44]的解磷能力也有大量报道。放线菌门链霉菌目细菌是较早被鉴定为具有解磷能力的一类细菌[45],其基因组具有多个可编码ALP的基因[46]。本研究RBⅠ组中α-变形菌纲的相对丰度显著高于RBⅡ,其他细菌群落在RBⅠ和RBⅡ组中都无显著差异性,并且发现RBⅡ组的平均AP含量显著高于RBⅠ组(RBⅠ,240.18 mg/kg;RBⅡ,396.70 mg/kg,P<0.05),推测α-变形菌纲作为差异最显著的群落可能对两个蓝莓组中AP含量的差异起主导作用。α-变形菌纲细菌丰度与ALP活性及有效磷含量呈显著负相关关系,暗示含磷丰富的土壤中解磷细菌的高丰度并不一定提升供磷潜力,因为一些微生物ALP可能以磷抑制的方式发挥调控作用[47]。
