利用低场核磁共振技术检测刺槐种子吸水过程水分的变化
2022-11-30朱铭玮朱莹莹李淑娴
袁 鸣,朱铭玮,侯 静,朱莹莹,李淑娴*
(1.南京林业大学林学院,南方现代林业协同创新中心,江苏 南京 210037;2.苏州纽迈分析仪器股份有限公司,江苏 苏州 215163;3.苏州市职业大学,江苏 苏州 215104)
刺槐(Robiniapseudoacacia)树体高大,叶色鲜绿,可用作庭荫树和行道树,其根系发达,适应性强,也是水土保持和西北干旱地区的主要造林树种;其花呈白色或红色,可以直接食用,花蜜营养价值较高,还是北方重要的蜜源植物[1]。刺槐通常以种子繁殖,但因种皮存在硬实现象,透水性差,常常导致播种后发芽率低、发芽周期长、出苗不整齐等现象[2],这给育苗生产带来了一定困难。水分是种子萌发的必要条件,干燥的种子必须吸收大量水分才能萌发。研究种子吸水量常采用质量法,但该方法不能深入研究种子吸水过程中水分相态变化及各相态水的含量变化。
低场核磁共振(low nuclear magnetic resonance,L-NMR)可以动态检测脉冲CPMG(carr-purcell-meiboom-gill)序列信号,得到样品自旋-自旋弛豫时间(即横向弛豫时间T2)[3-5]。由于被测样品内水分流动性的差异,使得T2谱呈现出多组分特征,不同T2弛豫时间范围内的水分代表不同相态的水分[6],因此利用T2弛豫时间及其信号值的差异可以有效探测样品内水分相态及其含量的变化。有学者尝试着将NMR技术应用于种子吸水研究,如李然等[7]利用NMR技术对绿豆(Vignaradiata)种子吸水过程进行了分析,发现绿豆种子吸水过程中存在3种状态水,即毛细管水(capillary water)T21、自由水(free water)T22及束缚水(bound water)T23;宋平等[8]利用NMR技术研究了玉米(Zeamays)种子萌发过程中水分相态的变化,也得到类似结果。另外,牟红梅等[9]利用NMR技术对冬小麦(Triticumaestivum)灌浆过程中水分的变化规律进行了监测;汪楠等[10]也利用该技术对稻谷(Oryzasativa)干燥特性与水分迁移的关系进行了研究。NMR技术在农业领域应用广泛,但目前对林木种子,如刺槐种子吸水过程中水分变化的研究鲜见报道。笔者拟采用核磁共振技术对刺槐种子吸水萌发过程进行研究,利用T2弛豫时间的差异来区分种子内部水分的相态,根据T2反演谱信号幅值的差异分析种子内部各水分相态含量的变化规律,拟为揭示刺槐种子的吸水特性提供理论依据。
1 材料与方法
1.1 试验材料
2019年9月下旬于山东烟台采集试验所用的刺槐种子,采回后先剔除刺槐种子中的夹杂物、虫害粒以及受损粒,再采用水选法去除空粒、瘪粒,剩余饱满种子阴干后置于4 ℃ 冰箱中待用(处理后种子的发芽率为95%)。
1.2 试验方法
1.2.1 刺槐种子吸水率测定
随机取一定数量的刺槐种子,用初始温度为85 ℃的热水浸种5 min后,从中随机抽取解除硬实性的种子30粒,重复3次,用吸水纸擦拭种子表面水分后称取其质量(m1)。将抽取的种子置于烧杯中进行浸种,待吸水3、6、9、12、24、36……108 h时分别取出种子,擦拭种子表面水分后再次称其质量(m2),再将称量后的种子放回原有烧杯中使其继续吸水,重复上述操作过程,直至种子质量达到稳定。对照为干种子直接置于装有清水的烧杯中浸种。按式(1)计算种子的吸水率并绘制吸水曲线。

(1)
式中:m1为浸种前的种子质量,g;m2为浸种后各时间点的种子质量,g。
1.2.2 种子吸水过程中水分相态含量的测定
按照种子吸水率测定的方法处理种子,随机选取解除硬实性的种子30粒(3个重复),用吸水纸擦拭种子表面水平后称取其质量,将种子置于烧杯中进行浸种,吸水3 h时,取出种子,放入玻璃试管,在低场核磁共振仪中进行检测。测定时,采用CPMG脉冲序列,并利用SIRT(联合迭代重建技术)算法反演操作,得到T2弛豫图谱。CPMG脉冲序列的主要参数有:主频(SF)为23 MHz,偏移频率(Ο1)为401 279.79 Hz,90°脉冲射频脉宽(P1)为12 μs,180°脉冲射频脉宽(P2)为23.04 μs,信号采样点数(TD)为720 016,重复采样等待时间(TW)为4 000 ms,重复采样次数(NS)为32,回波时间(TE)为0.3 ms,回波个数(NECH)为12 000。测定后立刻将种子放入清水中继续浸种,分别在6、9、12、24、36 h时取出种子,置于玻璃试管中,重复之前的操作。36 h后将种子置于湿石英砂中培养,分别在48、60、72、96 h及胚根伸出时取出种子,重复之前的操作。
1.2.3T2弛豫谱峰面积与刺槐种子含水量关系的构建
NMR的T2弛豫谱总峰面积与样品中氢质子的数量成正比,故T2弛豫谱总峰面积反映了种子中水分含量的多少。参照宋平等[11]的方法将传统的质量信号换作核磁信号量,再通过回归分析,构建T2弛豫谱总峰面积与种子含水量的回归方程,并通过R2检验对回归方程的拟合效果进行校验。
1.3 数据分析
用Excel对试验数据进行图标处理,采用SAS 6.0和SPSS 22.0统计软件对测定指标进行相关分析。
2 结果与分析
2.1 刺槐种子的吸水曲线
刺槐种子的吸水曲线见图1。热水处理后种子的吸水率与对照组间差异显著(P<0.05),在不同的吸水阶段,对照组种子的吸水率均低于热水处理的种子。热水处理后的种子,在0~12 h呈快速吸水阶段,之后种子的吸水速度变缓,至36 h时吸水渐趋于平衡,吸水率为122.31%,而此时对照种子的吸水率仅为6.16%;吸水至72 h时,热水处理的种子吸水率达123.75%,此时对照种子的吸水率为9.17%;吸水至96 h时,对照种子吸水率为9.36%,而热水处理的种子吸水率达125.01%,为对照的13.36倍。由此可见,种皮透水性差是限制刺槐种子吸水的主要原因。

图1 刺槐种子的吸水曲线Fig.1 The water absorption curve of Robiniapseudoacacia seeds during their imbibition
2.2 吸水萌发过程中弛豫时间(T2)与水分相态的划分
弛豫时间(T2)反映了样品中水分的自由度,也就是说T2图谱的变化能反映水分的流动性,所以根据T2弛豫谱中的波峰位置可以辨别组织中水分流动性的差异,从而区分不同的水分相态[12-14]。本研究中,刺槐种子吸水至萌发过程中的T2反演谱有3个明显的波峰(图2),即存在3种不同相态的水。各峰结束时间T2i表示样品中第i种水分的横向弛豫时间,纵坐标为信号幅值,用A2i表示第i种水分信号的强度。T2主要变化范围是 0.1~1 000 ms,从左向右各峰值所在区间T2弛豫时间分别为T21、T22、T23。弛豫时间最短(T21,>0.1~1 ms)的为束缚水(bound water),该状态的水与生物大分子紧密结合,流动性差,其信号幅值为A21;弛豫时间较长(T22,>1~100 ms)的为不易流动水(immobile water),该种水分的流动性略高于束缚水,但仍受一定的制约,其信号幅值为A22;弛豫时间最长(T23,>100~1 000 ms)的为自由水(free water),该状态的水以游离形式存在,可以在细胞内自由流动,不会被植物细胞内胶体颗粒或大分子所吸附,是良好的溶剂并参与物质代谢,其信号幅值为A23。0 h时刺槐种子的T2反演图谱只有两个峰,第1个峰的弛豫范围为0.14~10.67 ms,水的流动性较弱,第2个峰的弛豫范围为11.44~529.48 ms,水的流动性较强。由于此时对应峰的弛豫范围与其他阶段完全不相同,因此没有将0 h时的结果与其他吸水阶段进行比较。

图2 刺槐种子吸水萌发过程中的T2反演图谱Fig.2 Spectra inversion of transverse relaxationtime (T2) of Robinia pseudoacacia seeds during their imbibition
刺槐种子吸水萌发过程中各相态水分峰顶点时间的动态变化见图3。在吸水过程中,束缚水T21的峰顶点时间差异均不显著,但至胚根伸出时,束缚水消失。在吸水3~9 h过程中,不易流动水T22的峰顶点时间呈增加趋势,即峰顶点向右偏移,并且各测定结果间差异显著;随后峰顶点时间趋于稳定(9~96 h)并维持在17 ms左右;当胚根伸出时,峰顶点时间显著延长至27.43 ms,再次向右偏移。而在吸水萌发过程中,自由水T23峰顶点时间的变化幅度较大,与另外两个峰的变化规律也不一致,总的来说呈先上升后下降的变化趋势:72 h前,峰顶点时间显著延长,即峰顶点显著向右偏移,在72 h时,峰顶点时间达到最大值741.13 ms,说明这一阶段,水分的自由度变高,流动性增强;72 h后,峰顶点显著下降,当胚根伸长时显著降低至252.96 ms,水分的流动性明显减弱。
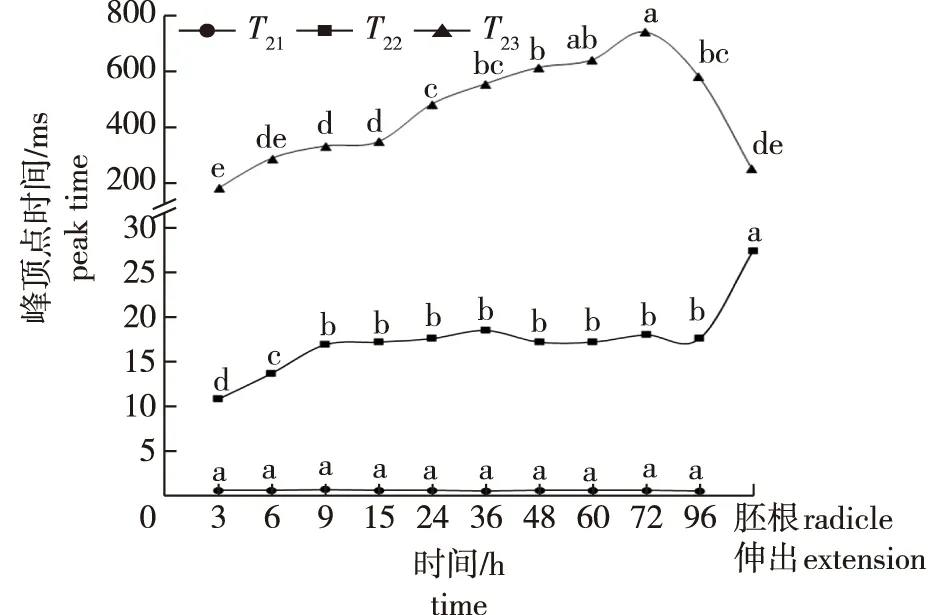
不同小写字母表示同一水分相态峰顶点时间差异显著(P<0.05)。Different lowercase letters indicate the significant difference among peak times of the same water phase(P<0.05).图3 刺槐种子吸水萌发过程中各相态水分峰顶点时间的变化Fig.3 Changes of peak time of each water phase of Robinia pseudoacacia seeds during their imbibition
刺槐种子吸水萌发过程中各相态水分的峰起始点、结束点的T2反演谱结果见表1。在种子吸水萌发的3~96 h过程中,束缚水T21峰起始点均差异不显著,峰结束点、弛豫范围呈先增加(3~60 h)再下降(60~96 h)的变化趋势;当胚根伸出时,种子内部束缚水消失,水分自由度变高。测定过程中,不易流动水T22的峰起始点时间也是呈先增加(3~36 h)再下降(36 h以后)的变化趋势,且在胚根伸出时峰起始点时间最低,由最高时的2.00 ms显著下降到0.57 ms。在吸水过程中,峰结束点呈相同的变化趋势,但变化幅度更大些,特别是吸水6 h时,由3 h时的95.63 ms迅速增加到139.49 ms,增加了45.86%,随后(6~96 h)各测定值的结果呈波动增加趋势,峰结束点的最大值出现在吸水96 h时,明显迟于起始点最大值出现的时间(36 h)。在吸水过程中,弛豫范围呈波动变化,其最大值同样出现在吸水96 h时,比3 h时的增加了63.58 ms,增幅67.24%;在胚根伸出后T22变化范围又显著减小。自由水T23的起始点、结束点、弛豫范围也是呈波动变化的趋势,并且也是在吸水96 h时各测定结果最大,在胚根伸出后又再次显著减小。由此可见,在种子吸水过程中,束缚水的变化范围较小,不易流动水和自由水的弛豫范围基本呈不断增大趋势,说明氢质子自由度逐渐升高,水分的结合能力变弱,能更好地参与物质代谢;当胚根伸出后,不易流动水和自由水的弛豫时间范围又显著变小。

表1 刺槐种子吸水萌发过程中的T2反演结果Table 1 T2 inversion of Robinia pseudoacacia seeds during its imbibition 单位:ms
2.3 核磁共振T2弛豫谱峰面积与刺槐种子含水量的关系

图4 刺槐种子核磁共振T2弛豫谱峰面积与含水量之间的回归关系Fig.4 The regressive relationship between NMR peakarea of T2 relaxation spectrum and moisture content of the Robinia pseudoacacia seeds
刺槐种子核磁共振T2弛豫谱峰面积与含水量的拟合曲线见图4。由图4可知,在显著水平α=0.05进行回归分析,发现刺槐种子含水量与峰面积之间具有明显的线性关系,其线性回归方程为y= 21 132x+ 698.05,其中,y为核磁共振T2弛豫谱峰面积,x为样品的含水量。回归方程中相关系数R2=0.999 6,说明方程拟合程度较好,刺槐种子核磁共振T2弛豫谱峰面积与样品含水量具有较好的相关性。
2.4 吸水萌发过程中各峰面积及其比例的动态变化
刺槐种子吸水萌发过程中各峰面积及比例变化见表2。T21、T22、T23所对应的峰面积分别为S21、S22、S23,S为3个峰面积的总和,即该时间段种子内部各相态水含量的总和。由表2可知,吸水萌发过程中总峰面积呈先迅速上升后保持基本稳定的“S”形变化趋势。吸水至12 h时,总峰面积迅速由3 h时的18 681.86显著增加至32 840.98,增加了75.79%;随后各测定时间段的总峰面积差异不显著,这与图1吸水曲线的变化趋势相同。在吸水过程中,各相态水峰面积的变化趋势不尽相同:束缚水的峰面积总体呈先上升(3~12 h)再下降(12~96 h)的趋势,峰面积的最大值(吸水12 h)较最小值(吸水3 h)时增加了54.82%;与束缚水的变化规律不同,不易流动水的峰面积总体呈先迅速上升(3~12 h)后保持基本稳定的趋势,其最大值(吸水60 h)较最小值(吸水3 h)时增加了72.42%,大于束缚水的变化幅度;自由水峰面积的变化趋势与不易流动水的相似,但峰面积的最大值出现在胚根伸出时,是最小值(吸水3 h)时的4.16倍,变化幅度远大于束缚水和不易流动水。
在刺槐种子吸水萌发过程中,各相态水的比例也是在动态变化中。总的来说,此过程中束缚水的比例呈下降趋势,特别是在吸水24 h以后,其比例维持在4%以下,在种子中水分的占比极小。随着吸水时间的延长,不易流动水的比例略呈下降的趋势,特别是胚根伸出时,峰比例进一步下降至最低值75.89%。尽管如此,此过程中,各测定时间点均是不易流动水的占比最大,远大于自由水和束缚水的比例。随着吸水时间的延长,自由水的比例呈增加的趋势,吸水3~12 h期间,自由水的比例维持在10%以下;吸水24~96 h过程中,自由水含量有所增加,维持在15%以下;胚根伸出时,自由水占比再次增加到23.02%。由此可见,吸水萌发过程中,束缚水、不易流动水的比例在下降,自由水的比例在上升,因此吸水萌发过程中水的流动性不断增强。

表2 刺槐种子吸水萌发过程中各峰面积的动态变化Table 2 The dynamic changes of each peak areas of Robinia pseudoacacia seeds during its imbibition
3 讨 论
3.1 刺槐种子的吸水特性
硬实现象在植物界中,特别是豆科植物中普遍存在,是种子在脱水过程中,随种皮结构不断发育而形成的。多数硬实性种子的种皮非常坚硬,在限制水分渗入的同时也会限制气体交换,从而影响种子的顺利萌发[15]。陈丽等[16]在研究合欢(Albiziajulibrissin)种皮结构对其吸水特性的影响中发现,种皮的不透水性严重影响了合欢种子的吸水萌发,热水处理能有效解除其硬实性,大大提升种皮的透性;方芳等[2]认为刺槐种子是典型的硬实性种子,种皮对种子的吸水具有明显的力学阻碍作用,热水处理能有效提高种子的发芽率。本研究结果再次说明种皮透水性差是阻碍刺槐种子吸水的主要原因,采用85 ℃热水处理后的种子吸水率明显提高,这与白刺花(Sophoradavidii)[17]、决明(Sennatoravar.obtusifolia)[18]等植物种子的研究结果类似。
3.2 刺槐种子吸水萌发过程中弛豫时间(T2)与水分相态的变化
水分是细胞内部新陈代谢的重要介质,也是种子萌发过程中营养物质转化和运输必不可少的条件。NMR 技术可通过测定样品中氢质子密度与分布来反映水分不同的相态,从而在微观层面揭示样品中水分变化规律[19]。宋平等[20]通过横向弛豫时间T2的差异将水稻(Oryzasativa)种子中的水分区分为内层水(internal water)(T21,0.01~0.5 ms)、中层水(intermediate water)(T22,0.5~8 ms)和外层水(external water)(T23,8~80 ms);新鲜采收的成熟香樟(Cinnamomumcamphora)种子中也含有3 种状态的水分,按照弛豫时间的长短可分为束缚水(T21,1.32 ms)、不易流动水(T22,12.33 ms)和自由水(T23,114.98 ms)[21]。本研究利用核磁共振技术测定了刺槐种子的横向弛豫时间T2及信号幅值A,发现种子在吸水萌发过程中同样存在3种相态的水:束缚水(T21,0.1~1 ms)、不易流动水(T22,1~100 ms)、自由水(T23,100~1 000 ms)。虽然上述植物种子中都含有3种相态的水,但是不同种子内含有的物质如蛋白质、脂肪等中的氢质子所处的化学环境以及所受的束缚力不同,所以各相态水分的弛豫时间也不尽相同。在0 h时,刺槐种子内只有2个峰,这可能是因为刚经过热水处理后的种子只是种皮开始软化,但内部环境没有发生明显变化,细胞也未开始活化,此时种子内水分结构与其他测定时间段不同。
本研究发现刺槐种子吸水过程中束缚水的弛豫范围明显右移,其弛豫范围的最大值为1.71 ms(72 h),而最小值即3 h时仅为1.04 ms;不易流动水和自由水的弛豫时间范围也基本呈不断增大的趋势,即峰明显向右偏移,造成峰右移的可能是由于随着种子的不断吸水,营养物质的浓度降低,导致水分结合能力逐渐变弱。花生(Arachishypogaea)[22]、玉米种子[23]萌发过程中自由水的变化趋势与刺槐种子相似,但花生种子吸水过程中束缚水的弛豫时间变化不大,这与刺槐种子不同,付晓记等[22]认为这主要是由于浸种期间花生种子中的有机物变化不大,致使与之结合水分的数量整体上也相对稳定。此外,当刺槐种子胚根伸出时,束缚水完全消失,不易流动水、自由水这两个峰却明显向左偏移,水分的流动性好像又有所变弱,具体原因有待进一步研究。
3.3 刺槐种子吸水萌发过程中各相态水分含量的动态变化
吸水萌发过程中种子内各相态水分的含量是一个动态变化过程。刺槐种子吸水萌发过程中,束缚水峰面积总体呈先上升再下降的趋势,不易流动水、自由水的峰面积先增加而后保持基本不变,说明随着种子内部营养物质的分解以及转化等活动的进行,束缚水与物质的结合程度不再那样牢固,而不易流动水、自由水的流动性变高。胚根穿过种皮时,自由水峰面积较上一阶段显著增加近1倍,这主要是因为自由水是细胞间自由流动的水,负责把营养物质运送到各个细胞,其含量制约着细胞的代谢强度,自由水含量越高表明生物的代谢越旺盛。玉米种子在萌发过程中束缚水、不易流动水的变化与刺槐种子类似,但其自由水的含量却先减少后增加,因此不同植物种子各相态水含量的变化规律并不完全相同[8]。另外,大多数植物种子吸水过程中自由水含量较多,如花生种子[22];而宋平等[8]在研究玉米种子萌发过程中水分流动规律时则发现,束缚水含量高于其他两种相态水分,但刺槐种子却是不易流动水含量占比远超过束缚水和自由水的总和。本研究还发现,刺槐种子吸水萌发过程中,束缚水不仅峰面积在下降,其峰比例总体也呈现下降趋势,而Garnczarska等[23]则发现羽扇豆(Lupinusangustifolius)种子吸水过程中束缚水比例却迅速增大。刺槐种子内不易流动水的峰比例呈下降趋势,自由水的比例则一直呈增加趋势,虽然自由水的占比不是特别高,但占总含水量的比例却显著增大。综上所述,不同植物种子内的主要水分相态、各相态水分含量的变化规律并不相同,上述差异与营养物质的种类、种子萌发速度的关系还有待进一步研究。
4 结 论
1)刺槐种子吸水曲线表明,85 ℃热水处理的刺槐种子吸水率远远高于对照组种子,0~12 h为快速吸水阶段,随后吸水速率变缓,至36 h时吸水趋于平衡。
2)回归分析发现,刺槐种子水分质量(x)与核磁共振弛豫图谱峰面积(y)呈显著一元线性回归关系,其线性回归方程为:y= 21 132x+ 698.05,相关系数R2=0.999 6。
3)利用弛豫时间(T2)的差异可区分种子内部水分的相态,吸水过程中刺槐种子主要存在3种相态的水,即束缚水、不易流动水、自由水。
4)通过T2反演结果发现,种子吸水过程中,束缚水的峰顶点、起始点变化不明显,峰结束点、弛豫范围呈先增加再下降的变化趋势,胚根伸出时,种子内部束缚水消失。此过程中,不易流动水的峰顶点时间先增加后趋于稳定,胚根伸出时,峰顶点时间再次增加;弛豫时间范围基本呈不断增大的趋势。自由水的峰顶点先上升后下降,吸水72 h时,峰顶点时间达到最大值;弛豫范围呈增大趋势,但在胚根伸出时,范围减小。
5)通过分析吸水过程中刺槐种子各相态水的峰面积及比例变化发现:束缚水峰面积呈先上升再下降的趋势,但峰比例总体呈下降趋势;不易流动水的峰面积呈先上升随后保持稳定趋势,峰比例略呈下降趋势;自由水的峰面积不断上升,且在胚根伸出时,增幅近1倍,峰比例也呈上升趋势。
