4种基因表达量和光合参数差异对白桦无性系幼苗生长的影响
2022-11-30纳晓莹刘桂丰王秀伟
纳晓莹,刘 刚,刘桂丰,王秀伟
(东北林业大学森林生态系统可持续经营教育部重点实验室,东北林业大学林学院,黑龙江 哈尔滨 150040)
白桦(BetulaplatyphyllaSuk.)广泛分布于我国东北以及华北等地区,具有速生、耐严寒、适应性强等特征,是我国人工林的主要树种之一[1]。近年来,提高白桦的光合能力,进而提升白桦人工林的造林质量,产生更大的社会、生态和经济价值是研究热点。植物的生物量和生物产量主要取决于光合作用[2-3],影响植物光合效率的因素很多,有研究表明,植物缺乏磷元素会使光合磷酸化过程中有机磷循环受阻从而降低光合速率[4];也有人认为,提高光合作用效率的关键之一是增强与光合作用相关的酶的催化效率。如,核酮糖-1,5-二磷酸羧化/加氧酶(Rubisco)催化光合作用中暗反应的第一步,但是其催化效率很低[5-6],而植物为了弥补Rubisco较低的催化效率,会大量积累Rubisco于细胞内,使其含量占植物细胞内可溶性蛋白的20%~50%[7],但这也大大降低了植物对氮素的利用效率[8-9]。
由于酶在光合作用暗反应阶段发挥了重要的作用[10],因此,笔者选取Rubisco、Rubsico活化酶(RCA)和乙醇酸氧化酶(GO)3种酶作为研究对象。Rubisco负责对光合作用中CO2的固定过程进行催化,此反应是光合作用中碳固定的关键步骤[11-12]。RBCS多基因家族负责编码Rubisco的小亚基,RBCS1A、RBCS3B是RBCS多基因家族两个主要成员[13]。RCA负责对叶片内的Rubisco进行活化,Rubisco只有经过活化才能表现出其羧化/加氧活性,即Rubisco在植物体内的活性取决于RCA对它的活化作用[14]。GO在植物光呼吸过程中负责将乙醇酸氧化成乙醛酸[15],虽然GO与碳固定的相关性可能不高,但是由于其参与催化光合作用的光呼吸过程,因此选择GO作为对照基因,探索GO与光合速率的关系。
本研究采用标准化实验方法,测定6组不同1年生白桦无性系幼苗的苗高和地径、4种特定基因(RBCS1A、RBCS3B、RCA、GO)相对表达量,以及6种光合作用参数(净光合速率、胞间CO2浓度、瞬时水分利用效率、气孔导度、羧化效率、蒸腾速率),比较无性系间生长量的差异,并分析两个生长量参数(苗高、地径)与基因表达量和光合参数间的相关性,以期找出对白桦幼苗生长有影响的相关因素,为我国白桦幼苗培育技术提供理论依据。
1 材料与方法
1.1 供试材料
植物材料。从白桦双列杂交子代林中选择6株长势良好的树木进行组织培养获得无性系幼苗。2014年5月1日,将幼苗移至室外设置的温室大棚中进行培养,2015年5月收获1年生白桦无性系幼苗,分别命名为3号、15号、21号、33号、52号、56号,在自然环境中适应1个月后测定相关参数。
实验试剂及引物合成。通用植物总RNA提取试剂盒(离心柱型,BioTeke,RP3002),RNASE REMOVER Ⅰ(华越洋,0416),反转录试剂盒(TOYOBO,FSQ-301),SYBR Green(Realtime PCR Master Mix-Plus-TOYOBO,QPK-212)。实验中所用引物由金唯智生物工程股份有限公司合成。
实验仪器与软件。Eppendorf常温离心机(5424,德国),Eppendorf低温离心机(5407,德国),IMPLEN超微量分光光度计(P330,德国),荧光定量PCR仪(ABI 7500,美国),便携式光合测量系统(Li-6400,LI-COR,Nebraska,美国)等;7500 Software v2.0.6(Applied Biosystems,美国),Office 2010(Microsoft,美国),BD 8.10软件(Premier,加拿大 ),R 3.2.3等。
1.2 实验方法
1)光合指标的测定。于2015年6月9日上午9:00—10:00测定叶片的光合参数。每个白桦无性系选取3株生长正常的幼苗,每株选择2片完全伸展、长势良好的健康成熟叶片进行测量,重复3次。测定时人工光照的光合有效辐射为1 000 μmol/(m2·s)。测定指标分别为净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr),同时计算瞬时水分利用效率(EWUE=Pn/Tr)和羧化效率(ECUE=Pn/Ci)。
2)总RNA的提取和cDNA的合成。用通用植物总RNA提取试剂盒提取6株白桦无性系幼苗叶片的总RNA;使用超微量分光光度计检测提取RNA的质量,确定RNA的浓度;通过反转录试剂盒将总RNA反转录合成第一链cDNA,并在-20 ℃条件下保存反应液。
3)实时荧光定量PCR(聚合酶链式反应)。根据白桦基因组和转录组数据库中的数据设计目的基因定量引物和内参,为了确保引物的特异性,利用BLAST程序对引物进行比对,详细的引物信息见表1。
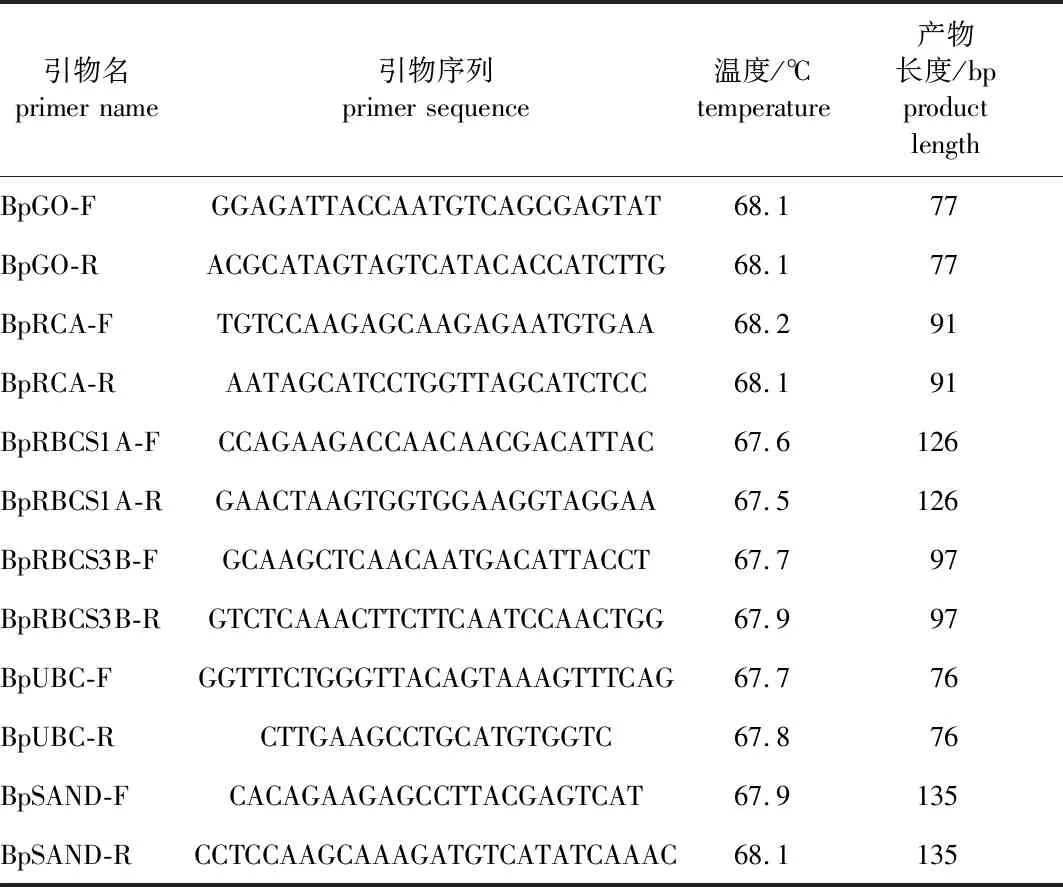
表1 实时荧光定量PCR引物信息Table 1 The primer information of real-time PCR
分别以6株白桦无性系幼苗的叶片cDNA为模版,每个无性系进行3次生物学重复,每个模版进行4次技术重复,实时荧光定量PCR反应采用SYBR Green法(反应体系包括超纯水4.4 μL、荧光染料SYBR10.0 μL、缓冲溶液2.0 μL、引物-F0.8 μL、引物-R0.8 μL、模板DNA2.0 μL),PCR具体反应程序见表2。荧光信号校正使用参比染料(ROX);荧光数据类型选择基线校正的标准化荧光值;采用Amplification-based threshold对阈值进行计算;采用“Treat Collectively”算法对技术重复的数值进行合并;采用参比染料标准化的荧光值的一阶导数对溶解曲线进行分析;采用ΔΔCT法计算基因的相对表达量:
式中:ΔCT为目的基因与内参基因达到设定阈值循环数的差值;ΔΔCT为目标株系目的基因与内参基因阈值循环的差值与参照株系目的基因与内参基因阈值循环数的差值。CTM表示目的基因阈值循环数,CTN表示内参基因阈值循环数,ΔCTMZ表示目标株系目的基因与内参基因阈值循环数差值,ΔCTNZ表示目标株系内参基因与其内阈值循环数差值,CTGE表示目的基因相对表达量。荧光阈值设定为0.07(由扩增曲线结果得出),使用得到的样本CT对各相关参数进行计算。公共内参CT值为BpSAND和BpUBQ两个内参CT值的几何平均数。使用3号幼苗叶片的各基因表达量作为参考,计算各无性系幼苗叶片RBCS1A、RBCS3B、GO和RCA基因的相对表达量。
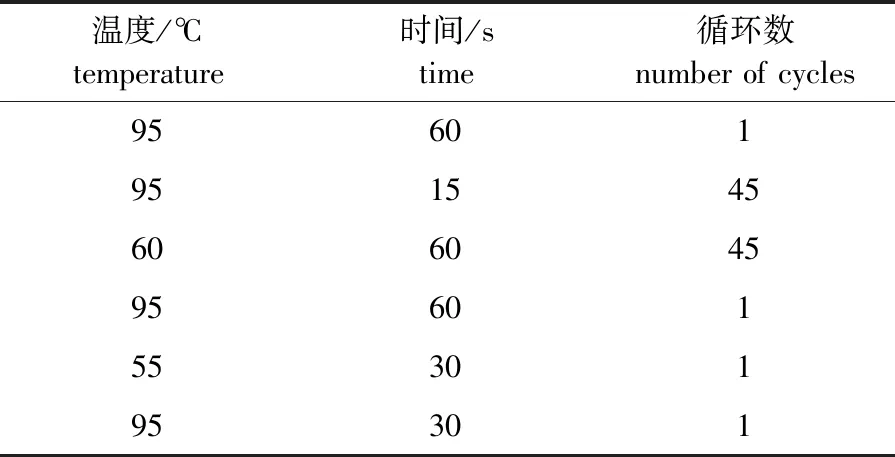
表2 实时荧光定量PCR反应体系Table 2 The reaction system of real-time PCR
1.3 数据分析
使用R 3.2.3进行数据分析和绘图。经检验,研究中所有变量值均符合正态分布。运用单因素方差分析和多重比较分析不同无性系间基因相对表达量和光合参数间的差异,采用Pearson相关性分析评价参数之间的二元相关性。
2 结果与分析
2.1 不同白桦无性系幼苗苗高、地径的差异
从不同白桦无性系生长情况(图1)可知,无性系间苗高(H)和地径(D)的差异显著(P<0.05),整体上,地径随着苗高的增加而增加;6种白桦无性系幼苗的苗高为85.38~123.39 cm,地径为5.73~7.56 mm;苗高从高到低排序为15号、33号、52号、3号、21号和56号,表现最优的是15号(123.39 cm),表现最差的是56号(85.38 cm);地径最大的是无性系3号(7.56 mm) ,最小的是无性系56号(5.73 mm)。
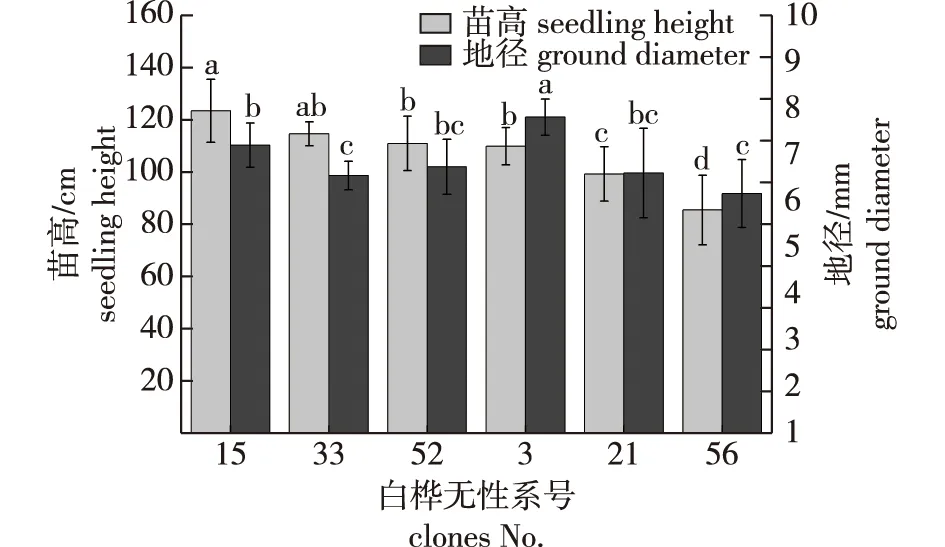
图中不同小写字母表示苗高或地径Duncan检验差异显著(P<0.05)。下同。Different lowercase letters in the figure indicate significant differences of seedling height or ground diameter (P<0.05) in the Duncan test.The same below.图1 不同白桦无性系幼苗苗高、地径的差异比较Fig.1 The comparison of seedling height and ground diameter of different white birch clones
2.2 不同白桦无性系幼苗光合参数的差异
白桦无性系幼苗光合参数的差异见图2。
由图2可以看出:无性系间Ci差异显著(P<0.05),Ci的变化范围为261.06~284.07 μmol/mol,最高的是无性系21号,最低的是无性系33号;无性系间EWUE和ECUE表现出了显著的差异(P<0.05),EWUE最高的为无性系33号、最低的为21号,ECUE最高的为无性系33号和56号,显著高于其他无性系,最低的为无性系3号;不同无性系间Gs、Tr、Pn均存在显著差异(P<0.05),Gs较高的为无性系21号[0.26 μmol/(m2·s)]和无性系56号[0.28 μmol/(m2·s)]、最低的为无性系3号[0.15 μmol/(m2·s)];Tr最高的是无性系21号[7.09 mmol/(m2·s)],显著高于其他的无性系,最低的是无性系3号[4.44 mmol/(m2·s)],显著低于无性系21号、56号以及15号;Pn较高的为无性系33号和56号[分别为14.37和14.97 μmol/(m2·s)],显著高于其他的无性系,最低的为无性系3号的9.83 μmol/(m2·s),显著低于其他无性系。

图2 不同白桦无性系幼苗净光合速率、气孔导度、胞间CO2浓度、蒸腾速率、瞬时水分利用效率、羧化效率的差异Fig.2 Differences in net photosynthetic rates,stomatal conductance,intercellular CO2 concentration,transpiration rates,instantaneous water use efficiency,and carboxylation efficiency of different white birch clones
2.3 白桦无性系幼苗RBCS1A、RBCS3B、GO与RCA基因相对表达量的差异
不同白桦无性系幼苗RBCS1A、RBCS3B、GO与RCA基因相对表达量间存在显著差异(P<0.05)(图3)。所有的无性系中4种基因相对表达量以RCA的最高(除了56号)、GO基因的最低(除了3号),且在无性系21号中RCA相对表达量最高、GO的相对表达量最低。就不同基因来看,RBCS1A的相对表达量在无性系21号、33号、56号中较高,15号中最低;RBCS3B的相对表达量在无性系33号、56号中较高,15号中最低;GO的相对表达量在无性系3号、33号中较高,且显著高于其他无性系,在21号中最低;RCA的相对表达量在无性系21号中最高,且显著高于其他无性系,在15号中最低。同时,基因RBCS1A和RBCS3B的相对表达量在不同白桦无性系幼苗中显示出了相同的变化趋势。而4种基因的总表达量中,33号的最高,15号的最低。
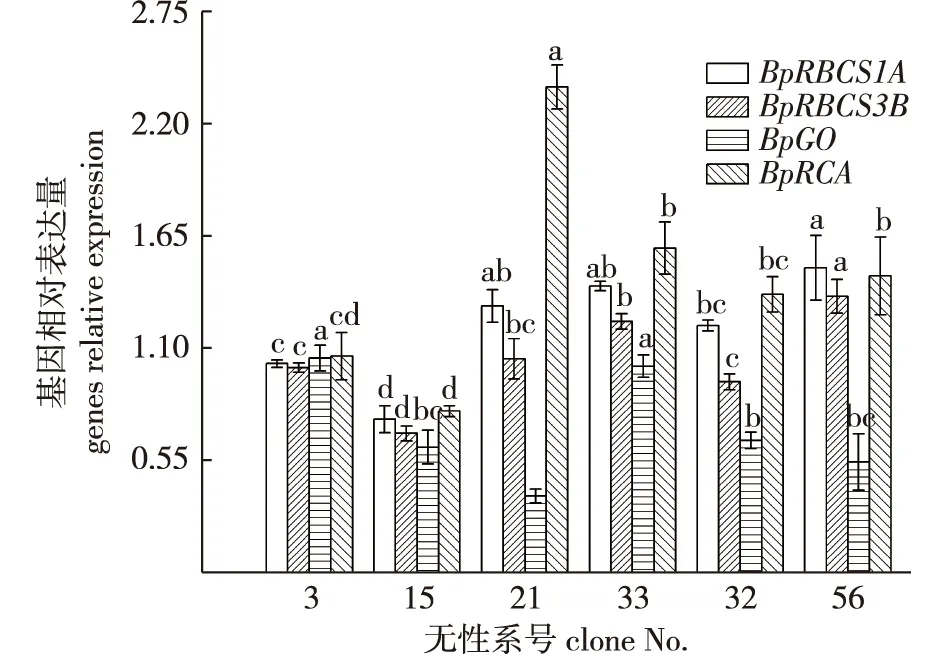
图3 不同白桦无性系幼苗RBCS1A、RBCS3B、GO与RCA基因相对表达量的差异Fig.3 The comparison of the relative expression levels of RBCE1A,RBCS3B,GO and RCA genes in different white birch clones
2.4 白桦无性系幼苗基因相对表达量、光合参数与生长量之间的相关性分析
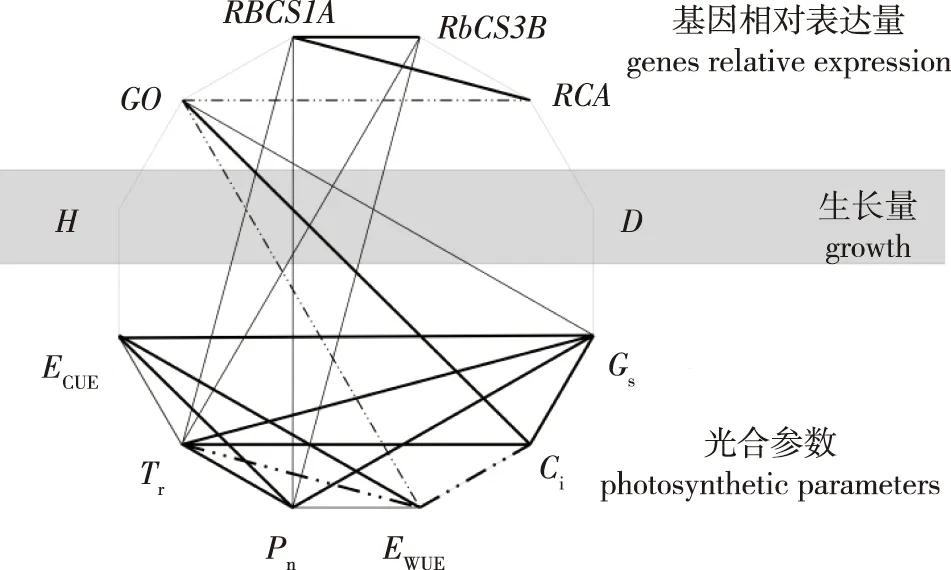
图中实线表示相关参数间显著正相关,虚线表示相关参数显著负相关;粗线表示显著性水平P<0.01,细线表示显著性水平P<0.05。The solid line in the figure indicates a significant positive correlation between the related parameters,and the dotted line indicates a significant negative correlation between the related parameters;the thick line indicates the significance level P<0.01,and the thin line indicates the significance level P<0.05.图4 基因相对表达量、光合参数与苗高、地径之间Pearson相关性分析Fig.4 Pearson correlation analysis between the relative gene expression,photosynthetic parameter and seedling height and ground diameter
RBCS1A基因相对表达量与RCA基因相对表达量(R=0.920)、RBCS3B基因相对表达量与RCA基因相对表达量(R=0.629)显著正相关(图4);GO基因相对表达量与RCA基因相对表达量(R=0.326)显著负相关;其他基因间没有表现出显著相关性。白桦无性系幼苗6个光合参数也表现出了显著的相关性,其中,Pn与Gs(R=0.736)、Tr(R=0.499)及ECUE(R=0.937)显著正相关;Gs与Ci(R=0.727)、Tr(R=0.818)、ECUE(R=0.472)显著正相关;Ci与Tr显著正相关,与EWUE显著负相关;Tr与EWUE显著负相关,与ECUE显著正相关;EWUE与ECUE显著正相关。基因RBCS1A、RBCS3B的相对表达量与Pn、Tr显著正相关。植物的生长量参数(苗高、地径)与基因相对表达量及光合参数的相关性未达到显著水平(P>0.05)。
3 讨 论
3.1 白桦无性系幼苗光合参数与基因相对表达量间的关系
本研究中,6种光合参数间表现出了密切的相关性。其中,净光合速率与蒸腾速率、羧化效率、气孔导度和瞬时水分利用效率显著正相关,这与吴廷娟等[16]对不同品种地黄光合特性的比较研究中得到的结果类似;瞬时水分利用效率通常被表示为光合速率与蒸腾速率的比值[17-18],本研究中瞬时水分利用效率与蒸腾速率和胞间CO2浓度显著负相关,但要注意的是,较高的瞬时水分利用效率不仅要求较低的蒸腾速率,同时还需要较高的净光合速率。在6株白桦无性系幼苗中,56号白桦无性系幼苗拥有最高的净光合速率,但是由于其蒸腾速率较高,瞬时水分利用效率低于无性系33号,因此,在选育同时具有较高净光合速率和较高瞬时水分利用效率的优质白桦幼苗时,33号无性系具有较高的研究价值。
4种基因相对表达量间,RBCS1A的相对表达量与RBCS3B的相对表达量显著正相关,这是因为高等植物的Rubisco全酶由8个大亚基和8个小亚基组成[19],编码该酶小亚基的RBCS基因在植物基因组中以多基因家族形式存在[20],RBCS1A和RBCS3B是拟南芥RBCS家族中的两个主要成员,共同参与编码Rubisco酶的小亚基,而多基因家族成员需要共同发挥作用进行相关酶的合成,以产生足够多的Rubisco来维持植物的光合能力。同时,在Rubisco酶催化CO2的固定过程中,必须有RCA将Rubisco位点上的抑制物解除[21],也就是说只有经过RCA活化的Rubisco酶才具有催化能力,这可能是RBCS1A相对表达量与RCA相对表达量显著正相关的原因。在光照和空气中高浓度O2低浓度CO2的环境下,植物在进行光合作用的同时也会进行光呼吸[22],而GO是绿色植物光呼吸途径中的关键酶,其主要作用是催化乙醇酸氧化生成乙醛酸[23]。本研究中GO基因的相对表达量与RCA的相对表达量显著负相关,这可能是植物根据外界环境情况进行的一种调节:在有利于光合作用的O2和CO2浓度比下,植物会表达更多的RCA,参与对Rubisco酶的活化从而催化光合作用的进行;在有利于光呼吸的O2和CO2浓度比下,则会表达形成更多的乙醇酸氧化酶,催化植物的光呼吸过程。
基因RBCS1A、RBCS3B的相对表达量与植物净光合速率、蒸腾速率显著正相关,这表明净光速率较高的白桦无性系幼苗表达产生了更多的Rubisco酶催化光合作用的碳固定。同时,净光合速率的不断增加说明植物通过增加气孔导度,让更多的CO2进入植物细胞内部羧化部位参与光合作用,气孔导度的增加也会加快植物水分的散失,这表现为蒸腾速率的不断上升[24]。因此,基因RBCS1A、RBCS3B的相对表达量与蒸腾速率的正相关可能只是一种现象,并不具有因果关系。从以上分析也可以看出,在进行参数间的相关研究时,统计结果不是最重要的,而是要透过现象看到两个相关量之间的因果关系[25]。例如在本研究中胞间CO2浓度与蒸腾速率显著正相关,但是二者的相关性只是一种现象,不具有因果关系,实际上,二者都是气孔导度增大的结果[9]。GO基因在本研究中作为对照基因,其相对表达量与气孔导度、胞间CO2浓度和瞬时水分利用效率间表现出的相关性有待于进一步的研究。
3.2 白桦无性系幼苗光合参数与基因相对表达量对生长的影响
本研究中,基因相对表达量与光合参数及生长量(苗高、地径)间并没有表现出显著的相关性。虽然RBCS1A、RBCS3B参与编码Rubisco酶,在经过RCA的活化作用后对白桦幼苗的光合作用进行调节,二者的相对表达量决定了白桦幼苗的净光合速率。但有研究表明,较高的净光合速率与植物的生长量之间没有必然的联系,因为较大的生长量不仅要求植物具有较高的净光合速率,还需要有较低的暗呼吸,这也与黄国伟等[26]在研究紫薇优良无性系生长和光合特征,以及赵思思等[27]在黑榆(Ulmusdavidiana)不同无性系苗期表型性状及光合特征的差异性比较研究中得出的结论一致。同时,也进一步证明基因RBCS1A、RBCS3B、GO和RCA并不能够直接影响白桦幼苗的生长。一方面,由于植物的生长是一个相对复杂的生理过程,是许多基因共同表达的结果,如除Rubisco酶外还有10种酶参加催化构成光合碳循环的10多个反应[9],而本研究中只选取了其中3种进行研究,存在一定的局限性;另一方面,虽然本研究中4种基因相对表达量及6种光合参数对1年生白桦幼苗生长的影响不显著,但该结论在更长的生长周期中是否成立,需要通过进一步的试验进行验证。
