玫瑰红菇和灰肉红菇对根际土壤微生物群落结构的影响
2022-11-29梁俊峰
禹 飞,梁俊峰
(1.山西农业大学林学院,山西 晋中 030801;2.中国林业科学研究院热带林业研究所,广东 广州 510520)
外生菌根真菌与宿主植物共生过程中,外生菌根真菌可以为宿主植物提供水分以及氮、磷等必要的矿质元素,来促进宿主植物的生长和提高其抵抗不良环境的能力[1];而宿主植物以脂质或糖的形式为外生菌根真菌提供碳水化合物供菌丝的生长[2]。在森林生态系统中,宿主植物-外生菌根真菌-根际土壤微生物之间存在相互依存、协同进化的关系,根际土壤微生物不仅能够提高外生菌根真菌的接种率[3],还能促进外生菌根真菌与宿主植物发生共生关系[4],这类根际土壤微生物称之为菌根辅助菌。大量研究表明,菌根辅助菌不仅能通过降解植物细胞壁等促进外生菌根真菌定殖,提高外生菌根真菌菌丝的存活率,还能通过降解细胞壁获得碳源供外生菌根真菌生长,诱导外生菌根真菌孢子萌发,抑制病原菌的产生[5]。菌根辅助菌还能分泌生长因子、次级代谢物等供外生菌根真菌生长,因此,筛选外生菌根真菌生长所需的菌根辅助菌对于提高外生菌根菌的产量十分重要[6]。
灰 肉 红 菇(Russula griseocarnosaX.H.Wang,Zhu L.Yang &Knudsen 2009)又名“正红菇”、“真红菇”、“大红菌”等,味道鲜美,干品价格为800~1 000 元·kg-1,常见于广东、广西、云南、福建、贵州等地[7];玫瑰红菇(Russula roseaPersoon 1796)别称苦红菇、红辣子等,其菌肉硬,子实体中存在苦红菇酸A和苦红菇酸B四环三萜酸化合物,稍带苦辣味[8],很容易与灰肉红菇混淆,价格为200~500 元·kg-1,分布地方比较广,在全国各地均有分布。灰肉红菇和玫瑰红菇作为红菇属中常见的野生食药用外生菌根菌,富含氨基酸、脂肪酸和矿质元素等营养物质,不仅具有高蛋白、低脂肪、粗纤维等功能,还具有抗氧化、抗肿瘤、抗癌等功效,是非常重要的林下非木质林产品资源[9-10]。李国杰等[11]报道了我国82种可食用红菇和22种可药用红菇,其中,灰肉红菇和玫瑰红菇均具有重要的食药用价值。灰肉红菇与玫瑰红菇不仅在味道上有显著差异,而且亲缘关系较远[12-13],目前均不能进行人工栽培。在野外考察中,发现灰肉红菇和玫瑰红菇共存于同一片区域。
本研究以同一生态条件下2种外生菌根真菌玫瑰红菇和灰肉红菇的根际和非根际土壤微生物(细菌、真菌)作为研究对象,采用Illumina MiSeq二代双端测序的方法进行测序分析,通过比较2种红菇根际与非根际土壤微生物的群落结构差异,筛选相应的菌根辅助菌,结合土壤理化性质和2种红菇的生境,为2种红菇的保育促繁、开发利用提供理论依据。
1 采集地概况
在 广 东 省 梅 州 市 丰 顺 县(116°16′58″ E,24°5′25″ N)采集到灰肉红菇和玫瑰红菇2种野生食药用外生菌根菌,采集林分主要树种为藜蒴(Castanopsis fissa(Champ.ex Benth.) Rehd.et Wils.),2种红菇混杂于林内,该地区海拔147 m,属于亚热带季风气候,年均气温为21.4 ℃,年降水量为1 776.1 mm。
2 研究方法
2.1 样品采集
在野外藜蒴林发现野生的灰肉红菇和玫瑰红菇,用抖落法收集粘附在红菇上的深度0~10 cm土壤作为根际土壤;在没长红菇、且与红菇横向距离相隔1 m地方,取深度0~10 cm的土壤作为非根际土壤。由于灰肉红菇和玫瑰红菇生长相距较近,非根际土壤采集可以共同使用。将上述采集的根际与非根际土壤分别分为2份,一份装入无菌自封袋,液氮运回实验室,在-70 ℃冰箱保存用于分子水平高通量测序研究;另一份带回实验室自然风干,风干后的土壤过2 mm筛,用于理化性质测定。采集地的土壤为红壤。样品标记中,RR为玫瑰红菇根际土壤;RG为灰肉红菇根际土壤;BK为非根际土壤。
2.2 土壤理化性质测定
土壤pH使用土水比(w/v)为1∶2.5的pH510酸度计测定[14];土壤有机碳使用重铬酸钾加热法测定[15];土壤有效氮利用碱解扩散法测定[16];土壤有效磷采取碳酸氢钠浸提-钼锑抗比色法测定[17];土壤有效钾使用火焰分光光度法测定[18]。
2.3 土壤微生物多样性分析
2.3.1 土壤DNA提取、PCR扩增和测序 称取0.30 g土壤,按照上海生工提供的Ezup 柱土壤DNA 抽提试剂盒说明提取土壤DNA样品,利用NanoDrop 2000分光光度计检测DNA浓度和纯度,确保DNA纯度OD260/280处于1.8~2.0间,DNA浓度>50 mg·L-1。
检测合格的DNA样品分别使用真菌ITS和细菌16S引物序列进行扩增。真菌ITS引物片段约为300 bp,引物序列为:ITS1F(5′-CTTGGTCA TTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTG CGTTCTTCATCGATGC-3′)[19]。细菌16S的引物序列为338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)[20],片段长度约为468 bp。20 μL PCR扩增反应体系均为:5×PCR扩增缓冲液4 μL,2.5 mmol·L-1dNTPs 2 μL,2.0 g·L-1牛血清白蛋白溶液(BSA)0.2 μL,5 μmol·L-1正反向引物各0.8 μL,Taq DNA聚合酶0.4 μL,50 mg·L-1DNA模板2 μL,ddH2O 9.8 μL。PCR反应扩增程序均为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共35个循环;72 ℃延伸10 min;4 ℃保存。PCR扩增产物使用2%(质量体积比)琼脂糖凝胶电泳进行检测,检测合格的样品送至上海美吉生物公司进行Illumina MiSeq PE300双端测序。
2.3.2 测序分析 通过MiSeq PE300双端测序获得原始下机数据,对原始下机数据进行过滤及质量评估:选取平均质量值>20、长度>100 bp的序列;根据首尾两端的barcode和引物序列调整序列方向,去除首尾两端的barcode和引物序列;利用FLASH v1.2.11软件将成对reads拼接成一条序列,拼接后的序列最大错配比率<0.2的作为有效序列,进行后续分析。
使用Uparse v7.0.1 软件对所有样品的有效序列基于97%的相似性进行OTUs聚类,在聚类过程中去除嵌合体,得到OTUs代表序列,将这些代表序列使用RDP classifier贝叶斯算法与数据库进行比对得到物种的注释信息。真菌的比对数据库为Unite(Release 8.0)[21];细菌的比对数据库为Silva(Release138)[22]。结合比对物种组成信息可以得到不同样品在各个分类水平的物种丰度表。土壤真菌多样性研究,除去红菇属序列,避免对实验结果造成影响[23]。土壤真菌和细菌在数据分析前期,均使用最小样本的序列数进行抽平[24]。抽平后的OTUs丰度信息使用Qiime v1.9.0计算样品的物种数、Chao指数、Shannon指数等α多样性指数。Chao指数反映物种群落丰富度,Shannon指数反映物种群落多样性。
土壤细菌的功能预测先通过PICRUSt对OTU丰度表进行标准化分析,根据OTU对应的greengene id,与KEGG数据库进行比对,可获得各个样本在不同代谢通路的注释结果[23]。
2.4 统计学水平分析
使用Excel 2016进行数据前处理,并进行正态分析,符合正态分布且方差齐性的数据使用SPSS 21.0进行单因素邓肯Duncan方差分析,数据的描述采取平均值±标准误差,在统计学水平p<0.05下,同列不同字母表示存在显著差异,字母相同表示差异不显著。两组样本在属水平上的数据符合正态分布且方差不等的情况下,选择Welch'st检验进行比较分析[25],并使用STAMP软件进行绘制。
分别对土壤细菌、真菌的OTU数据进行去趋势对应排序分析(DCA)[26],DCA分析结果显示第一轴的长度均<3,因此使用R v 4.1.0语言vegan包进行冗余分析(RDA),探讨样本、菌群与土壤理化性质之间的关系。
在属水平上,物种的丰度注释信息以及土壤微生物与土壤理化性质的Spearman相关性分析均使用R v 4.1.0语言中Pheatmap 包绘制。利用R语言绘制稀释性曲线图和在门水平上的物种相对丰度柱状图。
3 结果分析
3.1 2种红菇根际与非根际土壤理化性质
2种红菇根际与非根际土壤理化性质表明:灰肉红菇和玫瑰红菇根际土壤的有机碳(p=0.047)和有效钾(p=0.046)显著高于非根际土壤,在土壤pH、有效氮和有效磷中差异不显著(表1)。
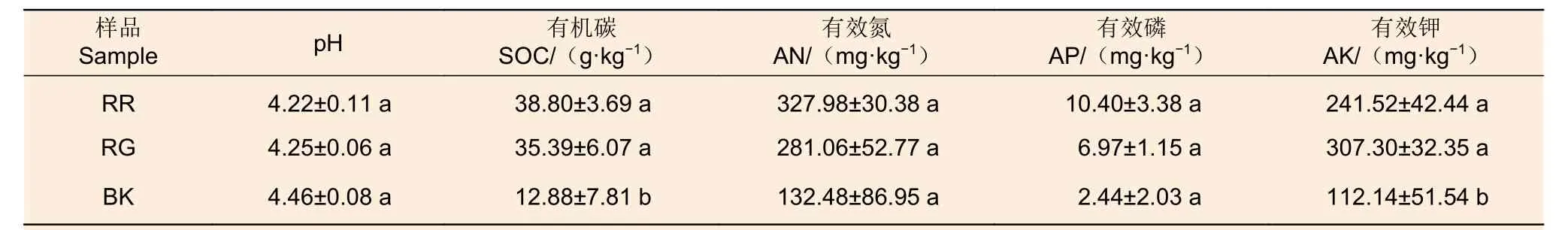
表1 2种红菇根际与非根际土壤理化性质Table 1 Physicochemical properties of mycosphere and bulk soil of two species of Russula
3.2 2种红菇对根际微生物多样性的影响
通过对2种红菇根际与非根际土壤细菌、真菌的高通量测序分析,数据经过过滤、质控后,玫瑰红菇根际、灰肉红菇根际和非根际土壤细菌分别获得39 685、40 681、33 688条有效数据;玫瑰红菇根际、灰肉红菇根际和非根际土壤真菌分别获得46 151、52 073、65 339条有效数据。2种红菇根际与非根际土壤的细菌、真菌实际测量出的OTU数目的稀释性曲线均趋于平坦(图1),说明测序的结果合理可靠,更多的测序数据量发现新的OTU贡献率较低。在本研究中,土壤细菌共获得2 914个OTU,土壤真菌共获得536个OTU。
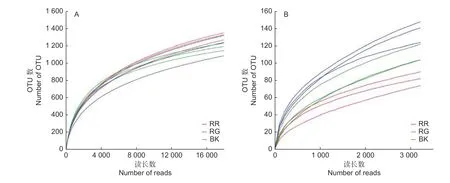
图1 2种红菇根际与非根际土壤微生物的稀释性曲线Fig.1 Rarefaction curve of mycosphere and bulk soil in two species of Russula
2种红菇根际土壤细菌Chao指数显著高于非根际土壤(p=0.03),Shannon指数低于非根际土壤,2种红菇的根际土壤细菌多样性差异不显著(表2)。在土壤真菌多样性中发现,灰肉红菇的根际土壤真菌Chao指数(p=0.034)和Shannon指数(p=0.01)显著高于玫瑰红菇根际土壤(表2)。
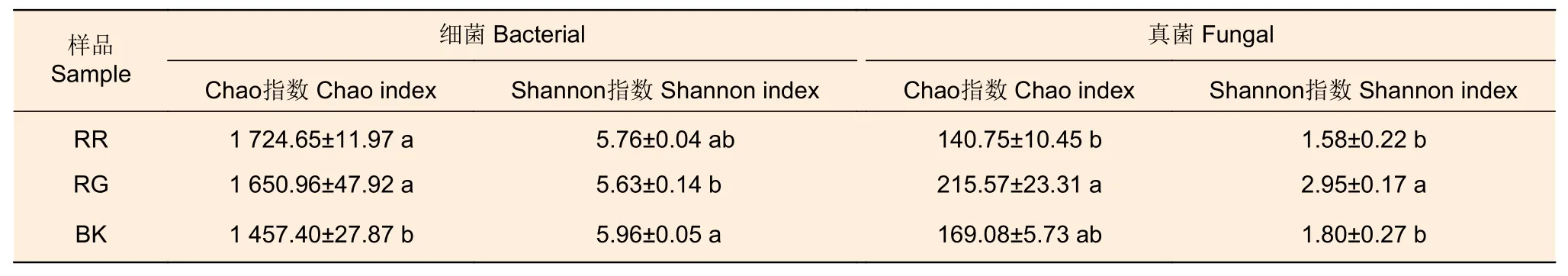
表2 2种红菇根际与非根际土壤微生物多样性指数的比较分析Table 2 Diversity index of mycosphere and bulk soil microorganism of two species of Russula
3.3 2种红菇对根际微生物群落结构的影响
2种红菇的根际和非根际土壤共注释到24个细菌门,5个真菌门,其中,变形菌门(Proteobacteria)、酸 杆 菌 门(Acidobacteria)、绿 弯 菌门(Chloroflexi)和放线菌门(Actinobacteria)为主要的细菌门(图2A);子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和接合菌门(Zygomycota)为主要的真菌门(图2B)。灰肉红菇和玫瑰红菇的根际土壤细菌中变形菌门(p=0.017)、酸杆菌门(p<0.01)和土壤真菌中担子菌门(p=0.002)均显著高于非根际土壤(图2)。
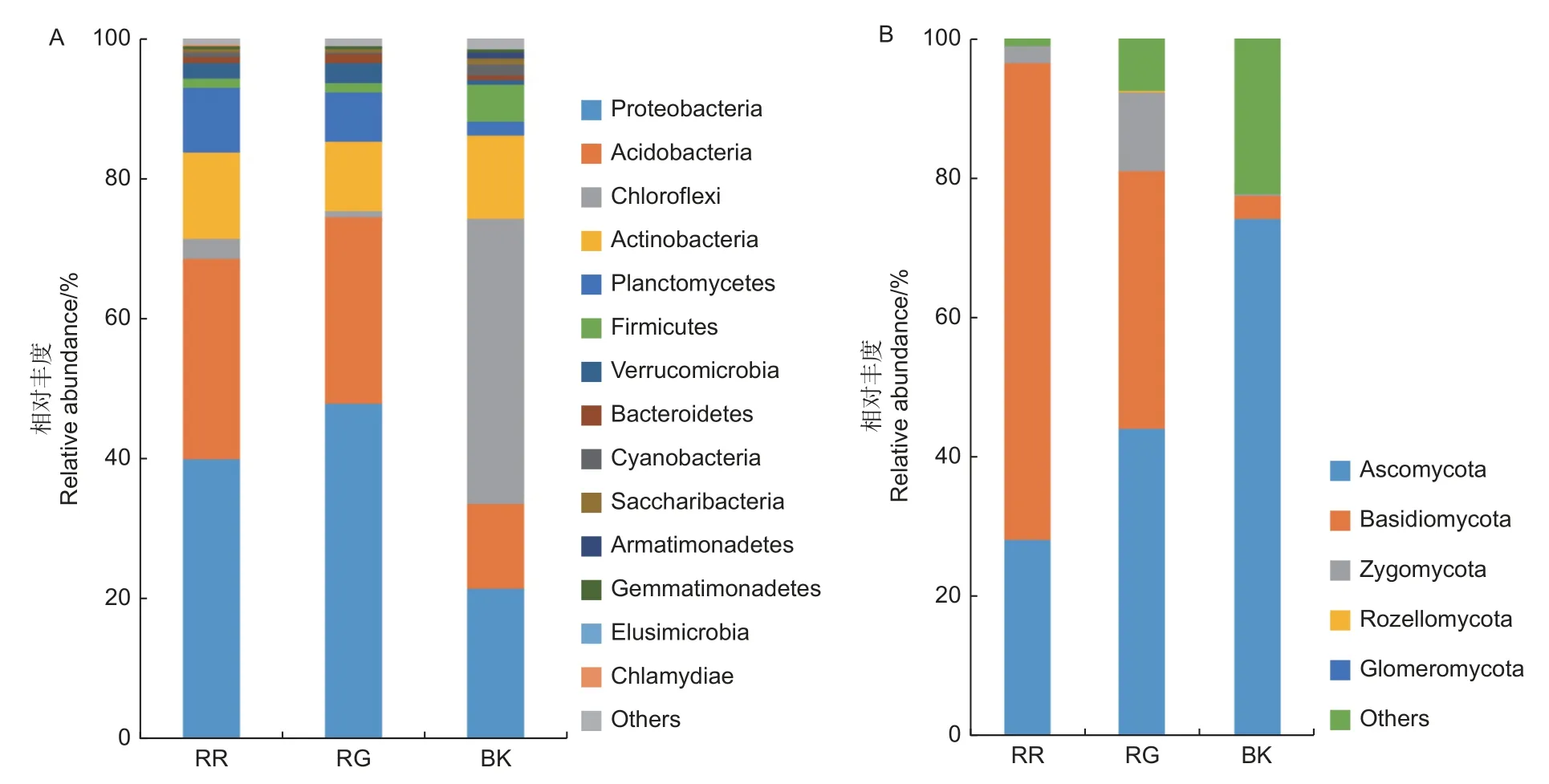
图2 2种红菇根际与非根际土壤微生物在门水平上的群落组成 (A:细菌 B:真菌)Fig.2 Community composition of mycosphere and bulk soil in two species of Russula at phylum level ( A: Bacterial B: Fungal)
在细菌属共计注释到445个属,变异杆菌属(Variibacter)、热酸菌属(Acidothermus)、慢生根瘤菌属(Bradyrhizobium)、Candidatus_Solibacter属和Burkholderia-Paraburkholderia属等13个属的相对丰度大于0.1%,为主要的细菌属。在前50个属中,玫瑰红菇和灰肉红菇根际土壤细菌的变异杆菌属(Variibacter)(p<0.01)、Candidatus_Solibacter属(p=0.033)、堆囊菌属(Sorangium)(p=0.029)、分 枝 杆 菌 属(Mycobacterium)(p<0.01)、Singulisphaera属(p=0.023)、Isosphaera属(p=0.001)、蛭弧菌属(Bdellovibrio)(p=0.034)和类芽孢杆菌属(Paenibacillus)(p=0.005)显著高于非根际土壤,这些可能是红菇属生长的主要菌根辅助细菌;丛生放线菌属(Actinospica)(p=0.016)、鞘氨醇单胞菌属(Sphingomonas)(p=0.023)、Chthonomonas属(p=0.001)和Vicinamibacter属(p<0.01)等显著低于非根际土壤(图3A)。在土壤细菌的群落结构发现,灰肉红菇和玫瑰红菇处于同一支,说明二者之间的菌群结构相似。进一步对灰肉红菇和玫瑰红菇的根际土壤细菌进行比较发现,灰肉红菇根际土壤细菌中变异杆菌属(Variibacter)(p=0.022)、Bryobacter属(p=0.023)和芽生绿菌属(Blastochloris)(p=0.008 9)显著高于玫瑰红菇根际土壤细菌,而热酸菌属(Acidothermus)(p=0.013)、分枝杆菌属(Mycobacterium)(p=0.044)、Reyranella属(p=0.009)、纤线杆菌属(Ktedonobacter)(p=0.013)和罗思河小杆菌属(Rhodanobacter)(p=0.013)显著低于玫瑰红菇根际土壤细菌(图4A),这说明不同红菇中的土壤细菌优势辅助菌略有差异。
在土壤真菌属共计注释到146个属,木霉属(Trichoderma)、被孢霉属(Mortierella)、青霉属(Penicillium)、棉革菌属(Tomentella)和粘头束霉属(Gliocephalotrichum)为主要的真菌属。在前50个属中,灰肉红菇和玫瑰红菇根际土壤真菌中木霉属(Trichoderma)(p=0.023)、青霉属(Penicillium)(p=0.038)和Hypomyces属(p=0.038)显著高于非根际土壤,而豆马勃属(Pisolithus)(p=0.023)、枝孢属(Cladosporium)(p=0.030)和拟棘壳孢属(Pyrenochaetopsis)(p=0.003)显著低于非根际土壤(图3B)。进一步对灰肉红菇和玫瑰红菇的根际土壤真菌进行比较,发现玫瑰红菇根际土壤真菌的Oidiodendron属(p=0.018)和木霉属(Trichoderma)(p=0.018)显著高于灰肉红菇根际土壤真菌,灰肉红菇根际土壤真菌的Cladophialophora属(p=0.049)、拟盘多毛孢属(Pestalotiopsis)(p=0.023)、拟青霉属(Paecilomyces)(p=0.020)和节菱孢属(Arthrinium)(p=0.044)显著高于玫瑰红菇根际土壤真菌(图4B),这些结果表明不同红菇中主要的优势真菌菌群略有差异。
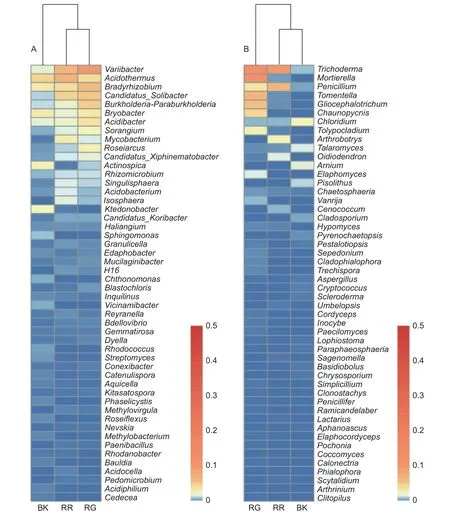
图3 2种红菇根际与非根际土壤微生物在前50个属水平上的群落组成(A:细菌 B:真菌)Fig.3 Community composition of mycosphere and bulk soil in two species of Russula at the top 50 genera (A: Bacterial B: Fungal)
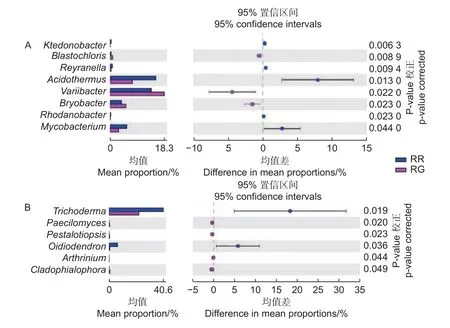
图4 2种红菇根际土壤微生物在属水平上的比较分析 (A:细菌 B:真菌)Fig.4 Comparative analysis of mycosphere soil microorganisms of two species Russula at genus level (A: Bacterial B: Fungal)
3.4 土壤理化性质对根际微生物的影响
RDA结果分析可以反映菌群、样本和环境之间的关系。通过对2种红菇根际与非根际土壤(细菌、真菌)在97%水平上的OTU进行RDA分析,结果表明:2两种红菇根际土壤样品与非根际土壤样品相距较远,菌群结构差异明显,而2种红菇样品相距较近,菌群结构相似,重复样地之间测序结果合理(图5)。通过对样地菌群与环境因子进行分析,发现pH与土壤细菌(p=0.020)、真菌(p=0.048)群落之间的相关性最大,说明pH是影响土壤微生物群落结构的主要因素。
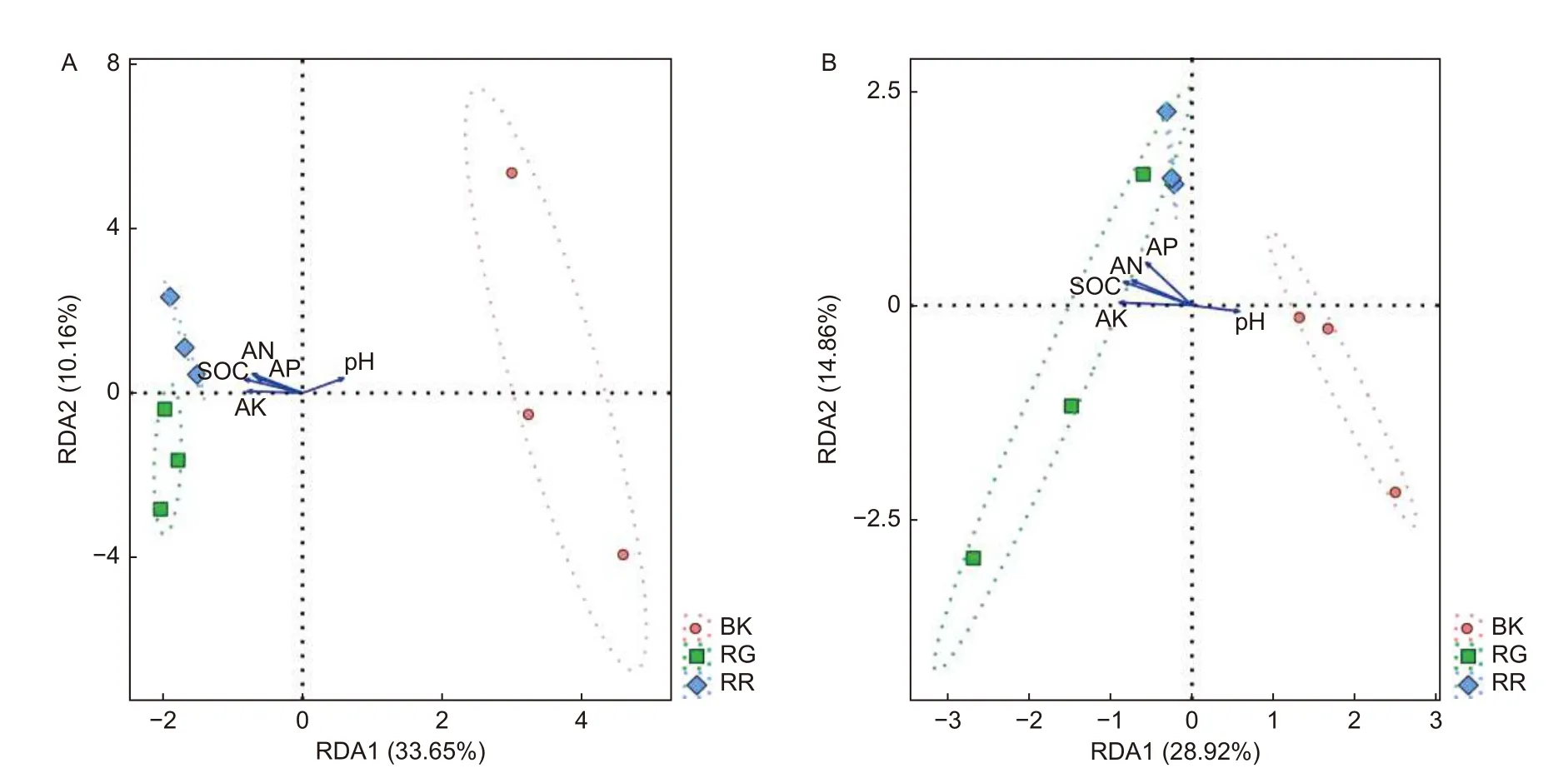
图5 样地与土壤理化性质的RDA冗余分析 (A:细菌 B:真菌)Fig.5 Redundancy analysis (RDA) between soil physicochemical properties and sample( A: Bacterial B: Fungal)
通过对前50个属水平的菌群和环境因子进行Spearman相关性分析,结果显示:有效氮(AN)、有效磷(AP)、有机碳(SOC)、有效钾(AK)为一类,pH为单独的一类,说明pH对菌群的影响较大(图6)。在土壤细菌中,变异杆菌属(Variibacter)(p=0.049)、堆 囊 菌 属(Sorangium)(p=0.025)、分 枝 杆 菌 属(Mycobacterium)(p=0.038)、根 微 菌 属(Rhizomicrobium)(p=0.005)、芽生绿菌属(Blastochloris)(p=0.030)、Reyranella属(p=0.036)、蛭弧菌属(Bdellovibrio)(p=0.020)和北里孢菌属(Kitasatospora)(p=0.049)与pH呈显著负相关,Chthonomonas属(p=0.007)、Aquicella属(p=0.013)和玫瑰弯菌属(Roseiflexus)(p=0.015)与pH呈显著正相 关;Candidatus_Solibacter属、堆 囊 菌 属(Sorangium)和Mucilaginibacter属与土壤SOC、AN、AP和AK呈显著正相关,Chthonomonas则与土壤SOC、AN、AP和AK呈显著负相关(图6A)。在土壤真菌中,木霉属(Trichoderma)、被 孢 霉 属(Mortierella)、粘 头 束 霉 属(Gliocephalotrichum)、茎霉属(Chaunopycnis)和瘤孢属(Sepedonium)与pH呈显著负相关,与有机碳呈显著正相关;Arnium属、豆马勃属(Pisolithus)和隐囊菌属(Aphanoascus)与pH呈显著正相关,与有机碳、AK呈显著负相关(图6B)。
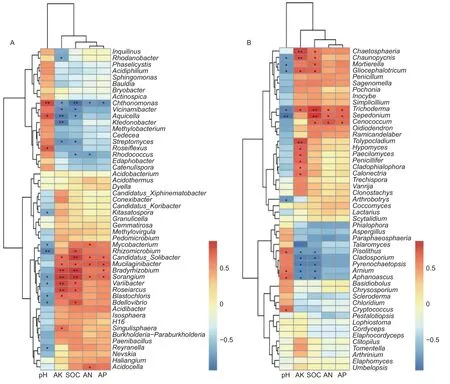
图6 前50个属的土壤微生物与土壤理化性质的Spearman相关性分析(A:细菌 B:真菌)Fig.6 Spearman correlation analysis between the top 50 genera and soil physicochemical properties (A: Bacterial B: Fungal)
3.5 2种红菇对土壤细菌群落功能的影响
通过对2种红菇根际与非根际土壤细菌在KEGG代谢通路注释结果进行单因素方差分析,发现相对丰度超过0.5%的代谢通路共有71条,其中具有显著性差异的代谢通路有33条(图7)。玫瑰红菇和灰肉红菇根际土壤细菌在信号转导[双组分调节系统(Two-component system)(p<0.001)]、氨基酸代谢[甘氨酸、丝氨酸和苏氨酸代谢(Glycine,serine and threonine metabolism)(p<0.001)、半胱氨酸和蛋氨酸代谢(Cysteine and methionine metabolism)(p=0.026)、组氨酸代谢(Histidine metabolism)(p=0.001)、酪氨酸代谢(Tyrosine metabolism)(p=0.001)]、能量代谢[氮代谢(Nitrogen metabolism)(p<0.001)]、膜运输[分泌系统(Secretion system)(p<0.001)、细菌分泌系统(Bacterial secretion system)(p<0.001)]、细胞迁移[细菌趋化性(Bacterial chemotaxis)(p<0.001)]、聚糖生物合成与代谢[脂多糖生物合成蛋白(Lipopolysaccharide biosynthesis proteins)(p=0.014)]显著高于非根际土壤(图7),其中,灰肉红菇的分泌系统(Secretion system)和细菌分泌系统(Bacterial secretion system)代谢途径显著高于玫瑰红菇(图7),而甘氨酸、丝氨酸和苏氨酸代谢(Glycine,serine and threonine metabolism)和组氨酸代谢(Histidine metabolism)显著低于玫瑰红菇(图7)。
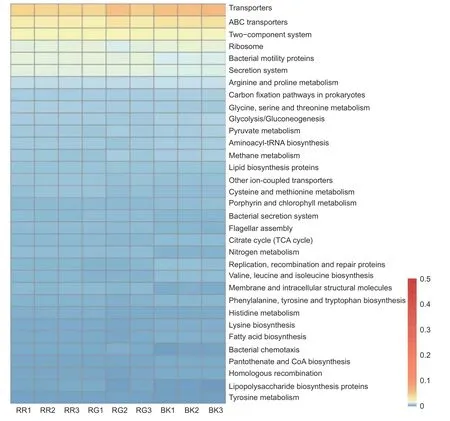
图7 根际与非根际土壤细菌在KEGG level3水平上具有显著性差异的代谢通路Fig.7 KEGG level3 metabolic pathways with significant differences between mycosphere and bulk soil bacteria
4 讨论
已有研究表明,外生菌根真菌如牛肝菌科、鹅膏菌科和红菇科等多生长于植物覆盖度较大、腐殖质丰富、土壤肥沃的森林环境中[27]。范俐等[28]发现正红菇根际土壤中全氮、有机质的含量丰富;罗佳煜等[29]在樟子松根际土壤接种褐环乳牛肝菌和互作细菌假单胞杆菌发现,根际土壤养分指标有机质、全氮、速效氮、全磷、速效磷含量显著提高。本研究中,2种红菇根际的SOC、AN、AP和AK均高于非根际土壤,表明由于2种红菇的生长使得土壤养分含量增加,这与前人的研究结果一致,说明外生菌根真菌与植物共生能够改善根际土壤的养分状况。外生菌根真菌的生长也受土壤因子如pH值、N和P等影响[30],特别是pH值,研究发现,外生菌根菌喜酸性土壤,最适宜生长的pH值范围在4~6[31],本研究中玫瑰红菇和灰肉红菇的根际土壤pH值介于4.2~4.3,证实了外生菌根菌喜好酸性土壤的结论。Avis等[32]发现,土壤氮元素增加可以刺激外生菌根真菌定植和生长[33]。土壤中磷在一定临界值有利于外生菌根形成,若土壤中磷含量过高,则降低外生菌根真菌的侵染率[34],这些结果说明了外生菌根菌能影响土壤的养分状况,反过来,土壤养分也能调节外生菌根菌的定殖及生长。
Oh等[23]发现,松茸根际土壤细菌、真菌多样性显著低于非根际土壤(p<0.05)。本研究中,2种红菇根际与非根际土壤微生物多样性指数存在显著差异,表明2种红菇不仅依据偏向影响了根际土壤微生物的群落结构,而且影响了微生物的多样性。在细菌属水平上,2种红菇根际土壤中变异杆菌属、Candidatus_Solibacter属、堆囊菌属、分枝杆菌属、Singulisphaera属、Isosphaera属、蛭弧菌属和类芽孢杆菌属显著高于非根际土壤;在真菌属水平上,木霉属、青霉属和Hypomyces属显著高于非根际土壤,这些可能是红菇属生长的重要微生物。进一步比较2种红菇的根际土壤微生物之间的差异,发现相对丰度较高的类群相似,含量略有差异,如根际土壤细菌中,灰肉红菇根际土壤中变异杆菌属和Bryobacter属显著高于玫瑰红菇根际土壤,而热酸菌属和分枝杆菌属显著低于玫瑰红菇根际土壤;根际土壤真菌中,玫瑰红菇根际土壤中Oidiodendron属和木霉属显著高于灰肉红菇根际土壤,这些可能是由于两种红菇特异性地选择对自己生长有益的土壤微生物[5]。因此,可以推测这些共有的和特异性的微生物可能是2种红菇的菌根辅助菌。研究发现,变异杆菌属(Variibacter)、慢生根瘤菌属、Candidatus_Solibacter属和伯克氏菌属为外生菌根真菌中主要的菌根辅助菌[35-37]。在欧洲赤松的根际土壤中加入伯克氏菌属,红乳菇的侵染率增加1.9~2.4倍[36],而加入芽孢杆菌属,褐环乳牛肝菌的侵染率增加2.1倍[38];在三角叶杨根际土壤中加入类芽孢杆菌,发现双色蜡蘑的侵染率提高了2.5倍[3]。Kataoka等[39]发现,土壤中慢生根瘤菌属和伯克氏菌属存在外生菌根真菌红菇属、牛肝菌属与宿主植物共生的根尖部位。Oh等[23,40]发现,细菌伯克霍尔德氏菌属、分枝杆菌属和类芽孢杆菌和真菌青霉属、木霉属、被孢霉属和毛霉属均是外生菌根真菌松茸的菌根辅助菌。Yu等[7]对不同地区的灰肉红菇土壤细菌进行研究,发现伯克氏菌属、分枝杆菌属、Candidatus_Xiphinematobacter属、Roseiarcus属和堆囊菌属是灰肉红菇主要的外生菌根辅助菌,这些研究表明菌根辅助菌在外生菌根菌生长过程中具有重要的作用。2种红菇中主要的菌根辅助菌具有能够影响外生菌根菌定殖的生态功能,如在根际土壤细菌中,Candidatus_Solibacter属可以有效分解有机质[41];堆囊菌属存在降解木聚糖酶,可以降解植物细胞壁和生物大分子,有利于外生菌根真菌定殖,提高外生菌根真菌产量[42];分枝杆菌属具有固氮功能,能为外生菌根真菌的生长提供氮源[43];Singulisphaera属能够降解木聚糖和果胶[44];而土壤真菌中,木霉属不仅分泌降解植物细胞壁的纤维素酶和半纤维素酶、降解真菌细胞壁的几丁质酶等[45],还能与被孢霉属和青霉属溶解土壤中的有机磷和无机磷,促进植物对土壤磷元素的吸收,参与土壤碳、磷循环[46]。两种红菇根际土壤中具有降解植物细胞壁功能的微生物显著高于非根际土壤,这表明这些微生物菌群参与外生菌根真菌与宿主植物的共生机制。此外,在根际与非根际土壤中相对丰度高的菌群也具有类似的生态功能,如Bryobacter可以促进土壤碳循环[41];慢生根瘤菌属起到固氮、溶解土壤有机和无机磷能力[46];伯克氏菌属不仅具有固氮作用,还能优先与菌根结合,随着外生菌根菌菌丝进行迁移[35],说明这些微生物菌群对红菇的生长也起到了促进作用。Oh等[23]通过对松茸根际土壤细菌的功能进行预测发现,根际土壤主要参与氨基酸代谢和碳水化合物代谢。2种红菇在信号转导、氨基酸代谢、能量代谢、膜运输、细胞迁移等代谢途径中显著高于非根际土壤,这可能是由于菌根菌与植物的共生导致根系分泌物中氨基酸、脂肪酸、碳水化合物等增加,为土壤微生物提供重要的碳源,有助于土壤微生物的富集[23,47]。2种红菇根际土壤微生物群落功能存在差异,可能是由于不同的菌根菌对根际微生物的偏向性选择,导致微生物菌群的功能表现出差异,这些差异也可能会反过来影响2种红菇的特性。
5 结论
本研究发现,玫瑰红菇和灰肉红菇2种红菇根际土壤微生物与非根际土壤微生物群落结构具有显著差异,细菌(变异杆菌属、Candidatus_Solibacter属、堆囊菌属、分枝杆菌属、Singulisphaera属、Isosphaera属、蛭弧菌属、类芽孢杆菌属)和真菌(木霉属、青霉属和Hypomyces属)为2种红菇共有的优势菌根辅助菌,这些菌群具有降解植物细胞壁、固氮和溶磷等功能,能促进红菇与植物根系形成共生关系。2种红菇根际土壤微生物菌群之间也存在显著差异,这是由于2种红菇会特异性地选择对自己生长有益的土壤微生物。pH是影响2种红菇生长的主要因素。2种红菇根际土壤细菌群落在能量代谢,信号转导通路,膜运输通路等显著高于非根际土壤。本研究的目的是筛选外生菌根真菌红菇的菌根辅助菌,制备专用微生物菌肥,扩大林下经济规模,为红菇的保育促繁提供理论依据。
