siRNA干扰MafA对小鼠胰岛β细胞的生长以及胰岛素相关基因的表达分析
2022-11-29孙志兵
孙志兵,杨 娟
糖尿病是临床上较为常见的疾病之一,发病后多为长期带病生存,目前临床共识认为糖尿病发病机制为胰岛素抵抗或胰岛素分泌不足[1-2]。随着基因技术的不断发展,糖尿病相关的基因表达调控通路不断被发现[3]。肌腱膜纤维肉瘤癌基因同源物A(v-maf musculoaponeurotic fibrosarcoma oncogene homologue A,MafA)被多个研究证实是胰岛细胞增殖和分泌胰岛素的重要调控因子,下调MafA的表达水平将会导致胰岛β细胞功能障碍,引起胰岛素分泌不足,上调MafA的表达水平则会增加胰岛素的分泌[4-6]。基于此,本研究采用siRNA干扰胰岛细胞MafA基因的表达,观察胰岛素相关基因和蛋白表达水平及胰岛素的浓度变化情况。
1 材料与方法
1.1 细胞 小鼠胰岛β细胞株Min6购自上海晶抗生物工程有限公司。
1.2 仪器与试剂 Trizol RNA iso试剂盒、反转录试剂盒、Lipofectamine 2000转染试剂购自赛默飞世尔科技(中国)有限公司;RPMI 1640培养基、胰蛋白酶、磷酸盐缓冲液(phosphate buffered solution,PBS)、胎牛血清均购买自美国Gibco公司;BCA蛋白定量试剂盒、PCR引物、siRNA购自上海吉凯基因化学技术有限公司;GAPDH抗体、兔抗鼠MafA多克隆抗体购自美国Novus Biologicals公司;Western blotting检测试剂盒、ELISA试剂盒购买自苏州宇恒生物科技有限公司。酶联免疫吸附仪购自北京普天新桥技术有限公司,实时荧光定量聚合酶链反应仪购自深圳市瑞安康医疗器械有限公司,凝胶电泳分析系统购自英国CLEAVER公司。
1.3 实验方法
1.3.1 小鼠胰岛β细胞的培养 将冷冻保存的Min6细胞在37 ℃水浴中融化,复苏后将细胞株接种在加入10%胎牛血清的RPMI 1640培养基中,在37 ℃、5% CO2培养箱中常规培养。
1.3.2 MafA基因的siRNA序列 搜索数据库MafA基因序列,设计MafA基因的siRNA序列正义链为:5′ UGA UGA AGU UCG AGG UGA AdTdT 3′,反义链为:5′ UUC ACC UCG AAC UUC AUC AdTdT 3′,由上海吉凯基因化学技术有限公司合成。
1.3.3 实验分组与处理 取对数生长期Min6细胞,以胰蛋白酶消化处理后,以合适的密度(40%~50%)接种于6孔板或96孔板中进行培养,实验分为MafA干扰A组、MafA干扰B组、MafA干扰C组、对照D组、对照E组、对照F组,其中MafA干扰A组、MafA干扰B组、MafA干扰C组应用MafA siRNA进行转染,对照D组、对照E组、对照F组未采取siRNA干扰,培养液葡萄糖浓度依次为MafA干扰A组和对照D组5.6 mmol/L、MafA干扰B组和对照E组10 mmol/L、MafA干扰C组和对照F组25 mmol/L。
1.3.4 实时荧光定量PCR 取各组转染后培养24 h的Min6细胞,用胰蛋白酶消化,采用TRIzol法提取细胞中总RNA。取20 μg总RNA,反转录为cDNA,反转录操作参照反转录试剂盒的说明书。引物由上海吉凯基因化学技术有限公司合成,引物序列见表1。进行荧光定量PCR检测,PCR扩增条件为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,循环40次。采用2-△△CT法计算各基因的相对表达量。
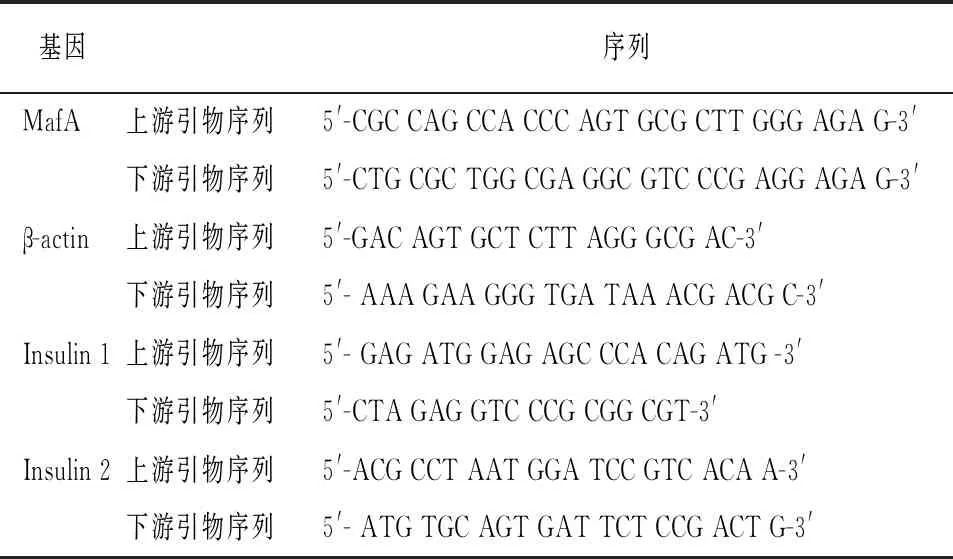
表1 相关基因的引物序列
1.3.5 Western blotting 取各组转染后培养48 h的Min6细胞,经胰蛋白酶消化后接种于96孔板,每孔1×108个细胞,加入适量RIPA细胞裂解液,冰上裂解30 min,收集裂解液于离心管中,在预冷4 ℃的离心机中5 000 r/min离心5 min,取上清液,经95 ℃水浴后,应用二喹啉甲酸法检测总蛋白浓度。取40 μg总蛋白,用12%十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳分离,采用电转移法将蛋白转移至聚偏氟乙烯膜上,在室温条件下封闭2 h。然后加入稀释的兔抗鼠MafA蛋白抗体(1∶800)、GAPDH抗体(1∶8 000)在4 ℃孵育过夜。第2天用PBST洗涤,重复3次,然后加二抗孵育2 h,用PBST洗涤3次,再用二氨基联苯胺显影液进行显影。采用Image J软件分析蛋白条带灰度值。
1.3.6 MTT法测定细胞增殖 取Min6细胞悬液接种于96孔板中,每孔6 000个细胞、培养基100 μL,设置8个复孔。在37 ℃、5%CO2培养箱内培养24 h后转染siRNA培养48 h,再以不同葡萄糖浓度培养液培养24 h,每孔加入20 μL MTT溶液,反应4 h。弃掉孔内的培养液,每孔加入二甲基亚砜150 μL,测定吸光度值(OD)。
1.3.7 ELISA法测定胰岛素浓度 将Min6细胞悬液接种在48孔培养板中,每孔8 000个细胞,在培养箱中培养24 h后转染siRNA培养48 h,然后加入无糖KRBB进行平衡,静置1 h,再以含有不同葡萄糖浓度KRBB培养24 h,测定上清液中胰岛素的浓度。
1.4 统计学方法 采用方差分析和q检验。
2 结果
2.1 MafA siRNA转染后各组MaFA mRNA及蛋白相对表达水平比较 在MaFA mRNA表达水平,MafA干扰B组和对照E组、MafA干扰C组、对照F组相比,差异均有统计学意义(P<0.05);MafA干扰A组、MafA干扰B组、MafA干扰C组间差异有统计学意义(P<0.05)。在MaFA蛋白表达水平,MafA干扰B组和对照E组、MafA干扰C组和对照F组相比,差异均有统计学意义(P<0.05);MafA干扰A组、MafA干扰B组、MafA干扰C组间差异有统计学意义(P<0.05)(见表2)。
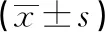
表2MafA siRNA转染后各组MaFA mRNA及蛋白相对表达水平比较
2.2 MafA siRNA转染对Min6细胞增殖的影响 在25 mmol/L葡萄糖浓度的MafA干扰C组Min6细胞OD值低于对照F组(P<0.05);在葡萄糖浓度为5.6 mmol/L、10 mmol/L的MafA干扰A组和对照D组、MafA干扰B组和对照E组相比,差异均无统计学意义(P>0.05)(见表3)。
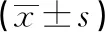
表3 各组Min6细胞OD值比较
2.3 各组胰岛素相关基因Insulin-1、Insulin-2 mRNA相对表达量比较 MafA干扰A组Insulin-1、Insulin-2 mRNA相对表达量和对照D组、MafA干扰B组、对照E组,差异均无统计学意义(P>0.05);MafA干扰C组Insulin-1、Insulin-2 mRNA相对表达量低于对照F组(P<0.05)(见表4)。
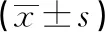
表4 各组Insulin-1、Insulin-2 mRNA相对表达量比较
2.4 各组胰岛素浓度比较 MafA干扰A组胰岛素浓度和对照D组、MafA干扰B组和对照E组相比,差异均无统计学意义(P>0.05);MafA干扰C组胰岛素浓度低于对照F组(P<0.05)(见表5)。
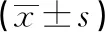
表5 各组胰岛素浓度比较
3 讨论
MafA基因位于第8对染色体上,全长3 123 bp,目前认为MafA基因可能参与了糖尿病发生的过程[7]。有研究[8-9]显示在小鼠胰腺发育的胚胎期,未检测到MafA基因,而在胰腺发育的后期,则可以检测到MafA基因,并且随着时间的增长MafA基因的表达水平逐渐增多,说明MafA基因可能参与了胰腺组织的发育。MATSUOKA等[10]在小鼠体内转染Mafa基因和Pdx1基因后,观察胰岛胚胎细胞以及胰岛α细胞发生和转化情况,结果显示转染后的小鼠能将Ngn3阳性胰岛细胞和胰岛α细胞转化为胰岛β细胞,从而为胰岛细胞的可塑性提供了新的证据。而在对人胰腺组织的研究[11]中,研究者对手术后取得的2型糖尿病胰岛组织进行分析,测定该胰岛组织细胞内的MafA基因,结果显示胰腺组织中的MafA基因水平明显降低,进一步证明MafA基因与2型糖尿病的发生有密切关系。有学者[12-13]提出,不同葡萄糖浓度下,MafA基因的表达水平可能不同,在低糖条件下时MafA基因的表达水平受到抑制,推测具体机制可能为MafA基因的相关序列发生了磷酸化,导致了MafA基因表达的降低,进一步影响细胞的生长。本研究采用siRNA干扰MafA基因的表达,观察不同葡萄糖浓度下胰岛细胞增殖以及胰岛素相关基因及蛋白的表达。
本研究对MafA siRNA转染后的效果进行观察,发现MafA siRNA能有效干扰MaFA mRNA及蛋白的表达,而在不同葡萄糖浓度时干扰的效果也不一致,在10、25 mmol/L时,MaFA基因和蛋白的表达较与未转染组相比差异具有统计学意义,提示在10、25 mmol/L葡萄糖浓度下siRNA抑制MaFA表达的效果好,而在5.6 mmol/L条件下,转染组与未转染组差异无统计学意义,可能由于低糖抑制正常胰腺细胞MaFA的表达,从而降低了MaFA基因表达的水平。
同时,本研究发现MafA siRNA转染后的胰岛细胞增殖会受到MaFA表达的影响,相同葡萄糖浓度下,下调MaFA基因表达,其胰岛细胞增殖数量减少。当葡萄糖浓度不同时,胰岛细胞内MaFA基因的表达量不同,也会导致胰岛细胞增殖的差异性。王鸿武等[14]对间充质干细胞进行研究发现,增加MaFA基因表达,能够上调glucagon、Nkx2.2、Pdx1基因水平,但对于间充质细胞的形态和数量未见明显变化,本研究与其结论不一致,分析原因可能为研究对象不同,采取的转染方式不一致,观察的指标不相同,最终导致了结论的差异性。
本研究观察胰岛素相关基因和胰岛素水平,发现下调MaFA基因表达水平,会导致相应的胰岛素基因表达受抑制,但胰岛素浓度的变化与MaFA基因的表达无线性相关性,分析原因可能为MaFA基因介导了Insulin-1、Insulin-2两种基因的表达通路,并通过两种基因对胰岛素的表达进行调节;并发现胰岛素浓度与胰岛素基因的表达有一定关联,但胰岛素浓度的变化未呈现明确的线性关系,分析原因可能为胰岛素分泌可能为多条信号通路介导,与杨梅等[15]研究结果相近。
综上所述,MafA基因的表达在胰岛细胞增殖和胰岛素分泌中发挥一定的作用,下调MafA基因能抑制小鼠胰岛细胞的增殖,并且降低Insulin-1、Insulin-2 mRNA的表达,但对胰岛素分泌的影响还有待进一步研究。
