超声辅助法提取红豆种皮中花色苷的工艺研究
2022-11-29金丽梅朱成成杨斯琪邸子清
金丽梅,朱成成,杨斯琪,邸子清,左 锋,*
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.黑龙江省杂粮加工及质量安全工程技术研究中心,黑龙江 大庆 163319;3.国家杂粮工程技术研究中心,黑龙江 大庆 163319;4.黑龙江省农产品加工工程技术研究中心,黑龙江 大庆 163319)
红豆,又名赤豆,原产于中国,广泛分布于我国东北及长江中下游等地区,是亚洲国家最常食用的杂粮作物之一。红豆的药用价值很高,具有补气养血、促进体内血红蛋白合成、预防缺铁性贫血、排脓解毒等多种功效,被李时珍形象地称为“心之谷”[1]。红豆种皮中含有丰富的花色苷等酚类物质,具有清除机体内自由基及缓解氧化损伤,预防和治疗氧化应激相关疾病的功效,受到人们的广泛关注和重视。将红豆种皮中的花色苷用于开发食品和药品,对于提高红豆的利用价值,保障人们的身体健康等具有重要意义,且红豆种皮具有来源广泛、安全可靠、功效显著等优势[2]。
目前花色苷的提取方法主要有溶剂提取法、酶解法、微波辅助提取法以及超声波辅助提取法等[3]。溶剂提取法是传统的提取方法之一,虽然操作简单,但耗时长,且使用大量的有机溶剂对环境有一定危害,该方法适用于对花色苷粗提取物的提取[4-5]。酶解法利用生物酶对提取对象的细胞壁结构进行破坏,使细胞内容物完全暴露并进行提取,该方法受外界条件影响因素较大,其提取率会受到一定影响[6]。微波浸提法虽具有时间短、效率高等优点,但该方法必须以极性溶剂作为提取剂,加热也会破坏有效成分,费用成本较高,所以微波浸提法目前多用于实验室研究,在使用过程中需避免微波泄露、过热等,因此要加强安全防范[7-8]。
超声波辅助提取是一项新型提取技术,是利用超声波产生的高速强烈的空化效应和搅拌作用,促进植物组织的水合作用,使细胞孔隙增大甚至破裂,促使溶剂渗透到药材细胞中,从而促进活性物质的溶出[9]。除此之外,超声辅助法减少了溶剂使用量,具有成本低、减少高温操作对提取物质的结构破坏,以及提高产品的品质等优点[10-12],在茶叶中咖啡因[13]、枸杞多糖[14]、紫薯色素[15]等提取过程中均有广泛的应用。孔茜等[16]以水为溶剂,利用超声辅助法对红豆色素进行提取,有效缩短了提取时间,大幅度提高了产率。但是乙醇作为一种常见的色素提取溶剂,利用超声辅助乙醇溶剂提取红豆种皮中花色苷的研究还较鲜见。
本文采用超声波辅助乙醇溶剂法进行红豆种皮色素花色苷的提取,在纤维素酶的作用下,研究不同提取条件(料液比、超声温度、pH值、乙醇体积分数、超声功率)对红豆种皮花色苷的影响,结合响应面法优化试验设计,确定出最佳的提取工艺条件,以期为红豆产品的深加工和花色苷的提取工艺提供技术参考。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
红豆,购于当地华联超市;纤维素酶(10 000 U/g),宁夏和氏璧生物技术有限公司;盐酸、氯化钾、无水乙醇、氢氧化钠,均为分析纯,辽宁泉瑞试剂有限公司;乙酸钠、柠檬酸,均为分析纯,天津瑞兴试剂有限公司。
1.1.2 仪器与设备
DK-98电热恒温水浴锅,天津市泰斯特仪器有限公司;DFT-150手提式高速万能粉碎机,温岭市林大机械有限公司;AR224CN电子天平,上海奥豪斯仪器有限公司;FE20 pH计,梅特勒-托利多仪器(上海)有限公司;L420台式低速离心机,湖南湘仪实验室仪器开发有限公司;KH-500DE数控超声波清洗器,昆山禾创超声仪器有限公司;A360紫外可见分光光度计,翱艺仪器(上海)有限公司;DHG-9145A电热鼓风干燥箱,上海一恒科学仪器有限公司。
1.2 方法
1.2.1 原料处理
挑选出豆粒饱满、完全无损、无霉变的红豆,用少量蒸馏水和乙醇清洗干净后再浸泡4 h,手工脱除豆皮后放置于事先调好的60℃电热鼓风干燥箱烘干至恒重,干燥后粉碎并过60目筛,放在密封袋中于4℃下低温储存,备用。
1.2.2 红豆种皮花色苷的超声辅助提取
将红豆种皮粉末按一定料液比加至含有不同体积分数的乙醇溶液中,用0.1 mol/LHCl和0.1 mol/L NaOH溶液分别调节提取液pH值,按加酶量0.4%向提取液中添加纤维素酶,在一定温度和功率下进行20 min超声提取,获得花色苷提取液。在4 000 r/min下离心10 min,重复对残渣浸提直至浸提液无肉眼可见颜色为止,收集数次浸提液于250 mL容量瓶中并定容,对浸提液中的花色苷含量进行测定。
1.2.3 红豆种皮花色苷提取单因素试验设计
按照“1.2.2”所述提取方法,称取1 g提前研磨好的红豆种皮粉末,设定料液比1∶35(g/mL)、pH 3.0、乙醇体积分数30%、超声温度60℃、超声波功率350 W为固定条件,分别研究不同料液比(1∶20、1∶25、1∶30、1∶35、1∶40(g/mL))、乙醇体积分数(20%、30%、40%、50%、60%)、pH(2.0、3.0、4.0、5.0、6.0)、超声温度(40、50、60、70、80℃)、超声功率(200、250、300、350、400 W)对花色苷含量的影响。每组试验平行重复3次,结果取平均值。
1.2.4 红豆种皮花色苷提取响应面试验设计
在单因素试验结果的基础上,采用响应面试验对花色苷提取工艺条件进行优化,以花色苷含量为响应值,分别以料液比(A)、乙醇体积分数(B)、pH(C)、超声温度(D)4个因素为自变量,运用Design-Expert 8.0.6进行响应面优化设计,如表1所示。
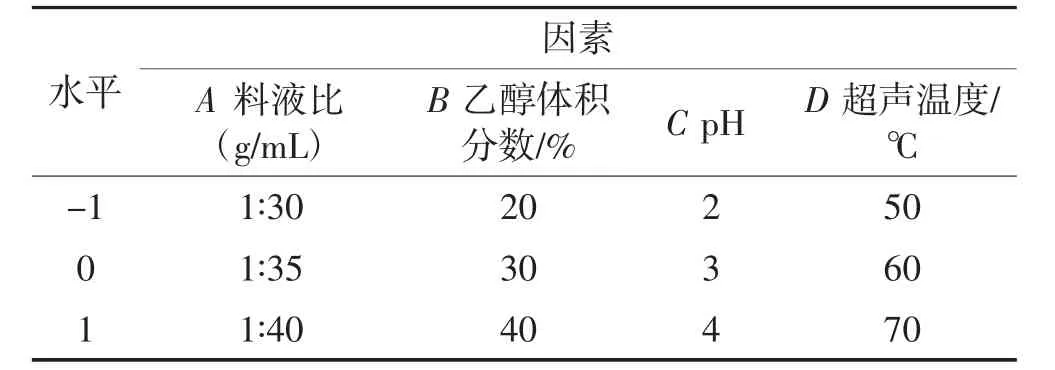
表1 响应面试验因素水平设计Table 1 Design of response surface test factors and levels
1.2.5 花色苷含量测定
参照文献[17],采用pH示差法测定红豆种皮中花色苷含量,计算公式如下:

式中:C为花色苷含量,mg/100 g;A0、A1分别为pH 1.0、pH 4.5时花色苷在520 nm处的吸光值;V为提取液总体积,mL;n为稀释倍数;M为矢车菊-3-葡萄糖苷(Cy-3-Glu)的相对分子质量,449.2 g/mol;ε为Cy-3-Glu的消光系数(29600);m为样品质量,g。
1.2.6 数据处理
采用Excel 2010进行数据统计与初步处理,SPSS26.0对数据进行显著性分析,Origin Pro 9.1绘制单因素试验折线图,Design-Expert 8.0.6进行响应面试验设计及分析。
2 结果与分析
2.1 花色苷提取单因素试验结果
2.1.1 料液比对提取效果的影响
由图1可知,在溶剂用量较小时,红豆种皮中的花色苷不易溶出,造成提取液中花色苷含量较低。随着溶剂用量的增大,植物内部和外部溶剂中花色苷含量之间产生更大的浓度差,有利于色素从红豆种皮内部向溶剂本体扩散,进而使得提取出的花色苷含量逐渐升高。当料液比为1∶35(g/mL)时,红豆种皮提取液中花色苷含量达最大值。继续增加溶剂用量,花色苷含量反而下降,说明花色苷溶出量已达到极限,且过大的料液比将溶解出更多水溶性杂质,从而降低花色苷的含量[18]。
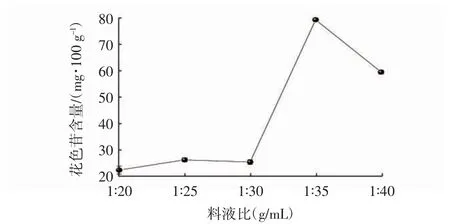
图1 料液比对花色苷含量的影响Fig.1 Effect of solid-liquid ratio on anthocyanin content
2.1.2 乙醇体积分数对提取效果的影响
乙醇体积分数对花色苷含量的影响如图2所示。当乙醇体积分数低于30%时,提取液中花色苷的含量较高且处于70~80 mg/100 g之间,花色苷溶出效果较好,但此时提取液较浑浊,表明水溶性杂质溶出量增多,不利于花色苷后续分离纯化;提取溶剂中乙醇体积分数大于30%时,红豆种皮因脱水和酸解离减弱而导致花色苷提取量下降[19],故选择乙醇体积分数为30%。

图2 乙醇体积分数对花色苷含量的影响Fig.2 Effect of ethanol volume fraction on anthocyanin content
2.1.3 pH对提取效果的影响
图3为不同pH对提取液中花色苷含量的影响。由图3可见,pH在从2.0变化到6.0的过程中,花色苷含量呈先增大后减小的趋势,pH为3.0时花色苷含量达最大值85.2 mg/100 g。由于红豆种皮色素提取过程中,中性和弱碱性环境适宜提取红褐色素,酸性环境适宜提取紫红色素[20],由此可见,红豆色素以紫红色为主,提取pH可控制在3.0左右。

图3 pH对花色苷含量的影响Fig.3 Effect of pHvalueon anthocyanin content
2.1.4 超声温度对提取效果的影响
由图4可知,在40~60℃的提取温度范围内,花色苷含量明显上升,在60℃时达到最大值,之后花色苷含量随温度的增加而下降。在超声辅助提取过程中,随着温度的升高,体系黏度降低,加速了传质过程。这可能与超声提取过程中会涉及到的两个步骤有关:首先是植物材料在溶剂中浸泡、溶胀和水化的过程,接着是物料中的目标成分通过扩散和渗透作用的传质过程[21]。随着超声温度的上升,花色苷的含量迅速增多,植物组织软化膨胀速度与温度呈正相关,色素从红豆种皮组织内部向溶剂扩散速度增加,花色苷提取量也逐渐增加,然而超声温度过高也会引起表面张力的降低和蒸汽压力的增加,造成超声波的阻尼[22],进而导致花色苷含量下降。为避免提取过程中的热效应导致花色苷分解[23],超声温度可控制为60℃。

图4 超声温度对花色苷含量的影响Fig.4 Effect of ultrasonic temperature on anthocyanin content
2.1.5 超声功率对提取效果的影响
超声波在提取溶液中产生的空化效应和机械作用可以有效破碎植物细胞结构组织,使有效成分花色苷呈游离状态并溶入提取剂[24]。由图5可见,随着超声功率的增加,花色苷含量呈缓慢增加趋势,在350 W时达最高值,随后花色苷含量略微下降,但总体上看,花色苷含量变化不明显。当超声功率过高时,花色苷会受到破坏而分解,同时也会使更多脂溶性物质溶入提取液中影响花色苷的提取效果[25]。因此,本试验中超声功率可确定为350 W。由于该因素对花色苷含量影响不大,故后续响应面优化试验未考察超声功率。
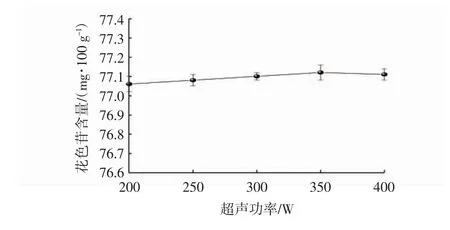
图5 超声功率对花色苷含量的影响Fig.5 Effect of ultrasonic power on anthocyanin content
2.2 响应面试验结果
2.2.1 模型方程的建立与方差分析
以单因素试验结果为依据,为考察不同因子对花色苷提取效果的影响顺序以及不同因子之间的交互作用,根据Box-Behnken的试验原理,选择料液比(A)、乙醇体积分数(B)、pH(C)和超声温度(D)4个因素进行4因素3水平的响应面优化试验,试验设计与结果见表2。

表2 Box-Behnken响应面试验设计与结果Table 2 Response surface experimental design and results
通过对表2中的试验数据进行回归模型拟合,得到花色苷含量(Y)预测值对自变量A、B、C、D的二次多项回归方程:Y=81.88-2.22A-2.88B-7.94C-7.58D-0.60AB+0.10AC-1.29AD-3.44BC-3.83BD+0.34CD-7.38A2-8.88B2-19.22C2-8.23D2。
模型的可靠性可以从模型的方差分析(见表3)及相关数据来考察。结果表明,回归模型达极显著水平(P<0.01),说明其能很好地预测试验结果。失拟项的P值为0.108 0,大于0.05,为不显著。因此,可用此模型对红豆种皮花色苷提取量进行分析和预测。回归模型预测了料液比、乙醇体积分数、pH、超声温度4因素在花色苷提取试验研究中的作用。从变量和响应值的F值可知(见表3),pH(C)对红豆种皮花色苷提取的影响最大,接着依次是超声温度(D)、乙醇体积分数(B)和料液比(A)。另外,模型中B、C、D、A2、B2、C2、D2均对花色苷含量的影响极显著(P<0.01),而A、BC、BD对花色苷含量的影响显著(P<0.05)。

表3 回归模型方差分析Table 3 Regression model analysisof variance
2.2.2 各因素间交互作用分析
为进一步确定花色苷的最佳提取参数,采用Design-Expert 8.0.6软件对表2中的试验数据进行优化分析。料液比、乙醇体积分数、pH、超声温度两两因素之间交互作用的响应面图如图6所示,乙醇体积分数(B)和pH(C)两因素的交互作用显著(P<0.05),pH对应的响应面坡度较陡,乙醇体积分数对应的响应面坡度较平缓,说明pH对花色苷含量的影响大于乙醇体积分数的影响;乙醇体积分数(B)和超声温度(D)两因素的交互作用显著(P<0.05)。响应面优化试验研究表明,超声法提取红豆种皮中花色苷的最佳条件为:料液比1∶34.44(g/mL)、乙醇体积分数29.79%、pH为2.79、超声温度55.48℃,在此条件下提取液中花色苷含量最高,为84.57mg/100g。
2.2.3 验证试验
根据实际操作,将花色苷提取条件调整为:料液比1∶34(g/mL),乙醇体积分数30%,pH为3,超声温度55℃,为了检验响应面试验预测值的准确性,进行了3次验证试验,所得的花色苷含量平均值为(82.35±3.28)mg/100 g,比较接近预测值,证明该结果合理。
3 结论
采用超声辅助乙醇溶剂法对红豆种皮中的花色苷进行提取工艺参数优化,得到如下结论:通过单因素和响应面试验确定了影响花色苷提取效果的各因素顺序为pH>超声温度>乙醇体积分数>料液比,超声功率对提取效果几乎无影响。红豆种皮中花色苷最佳提取工艺条件为料液比1∶34(g/mL)、乙醇体积分数30%、pH为3、超声温度55℃,该工艺条件下提取液中的花色苷含量可达(82.35±3.28)mg/100 g。该研究结果将为红豆种皮花色苷的提取提供一定的技术参考。
