芦荟多糖及其衍生物的制备与抗氧化活性研究
2022-11-29蒋文明周石洋
蒋文明,周石洋,2,3,*
(1.重庆化工职业学院,重庆 401228;2.重庆大学生物工程学院,重庆 400044;3.重庆师范大学化学学院,重庆 401331)
芦荟(Aloe vera)为百合科芦荟属多年生常绿肉质草本植物,原产于非洲热带干旱地区,分布于热带和亚热带地区[1]。目前,芦荟品种已有600多种,是集食用、药用、美容、观赏为一身的应用广泛的天然植物。芦荟在民间用于解毒和治疗便秘等已有几千年的历史。现代药理研究表明,芦荟中的活性成分具有抗菌、抗炎、抗癌、促进伤口愈合、增强机体免疫力等十多种药理作用[2]。芦荟中富含多种生物活性物质,已被广泛应用于食品、美容、保健、医药等领域。芦荟的化学成分研究表明,其成分较为复杂,主要包含蒽醌类、多糖类、氨基酸类、有机酸类、维生素类等化合物,以及矿物质、微量元素等。芦荟多糖是芦荟中主要的生物活性物质,研究结果表明芦荟多糖具有抗氧化、抗肿瘤、抗辐射、抗衰老、抑菌消炎、防治艾滋病、免疫调节等多种功效[3-4]。目前,芦荟多糖提取方法主要有热水提取法、酸碱提取法、酶提取法等,但尚未见有关芦荟多糖衍生物的合成与活性方面的研究报道。
本研究以新鲜芦荟叶为原料,采用热水提取法制备芦荟多糖,并对多糖提取工艺进行优化,再经过去蛋白、透析等处理,制备得到精制的芦荟多糖[5],进一步进行芦荟多糖衍生化,获得乙酰化、羧甲基化和磷酸化衍生物,同时评价其抗氧化活性,以期为研究芦荟多糖及其衍生物构效关系提供一定的理论指导,为将芦荟多糖及其衍生物开发为药物或功能性食品提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
芦荟:购于重庆市场。
乙醇、乙酸酐、氯乙酸、磷酸、异丙醇、正丁醇、氯仿、VC、硫酸亚铁、双氧水、水杨酸、邻苯三酚、盐酸、大豆卵磷脂、三氯乙酸、硫代巴比妥酸、1,1-二苯基-2-三硝基苯肼(DPPH)、Tris-HCl缓冲液,均购于成都市科隆化学品有限公司。
1.1.2 仪器与设备
TGL16G台式高速离心机,江苏金怡仪器科技有限公司;101-0A电热鼓风干燥箱,天津市泰斯特仪器有限公司;TWCL-T磁力搅拌电热套,巩义市科瑞仪器有限公司;Optilab T-rEX示差检测器、DAWNHELEOSⅡ激光光散射检测器,美国怀雅特技术公司;600 MHz核磁共振波谱仪,德国Bruker(布鲁克)公司。
1.2 方法
1.2.1 芦荟多糖的制备
取新鲜芦荟叶,去除坏死部分,清洗干净,自然沥干。称取100 g芦荟叶,充分捣碎,置于-10~-5℃下冷冻10~12 h,使其组织细胞充分破碎。将冷冻后的芦荟汁用500 mL水在90℃条件下提取3 h,常压抽滤,收集滤液,滤渣再次使用500 mL常温水浸泡,重复该操作2次。合并抽滤滤液,再以4 000 r/min离心5 min,收集上清液。上清液减压浓缩(-0.08~-0.1 MPa,50~55℃)至体积为200 mL时停止浓缩,得到粗芦荟多糖溶液。用Sevage法去除粗芦荟多糖溶液中的蛋白质和核酸,向粗芦荟多糖溶液中加入40 mL氯仿和10 mL正丁醇,常温剧烈磁力搅拌处理30 min。以4 000 r/min离心10 min,收集上清液。将上清液转移至透析袋中(截留分子质量>3 500 u),透析处理得到精制芦荟多糖溶液。将透析完的精制芦荟多糖溶液置于1 000 mL烧杯中,再加入800 mL无水乙醇醇沉24 h。醇沉后的混合物在4 000 r/min离心10 min,收集沉淀物。将沉淀物置于50℃恒温干燥箱中干燥12 h,得到精制的芦荟多糖。芦荟多糖得率计算公式如下:

1.2.2 乙酰化芦荟多糖的制备
准确称取1 g精制的芦荟多糖,置于250 mL干净的圆底烧瓶中,加入20 mL蒸馏水,磁力搅拌使其充分溶解。常温条件下,缓慢滴加1.2 mL乙酸酐,并保持磁力搅拌。在滴加乙酸酐过程中,不断用10%氢氧化钠溶液调节反应液的pH值,使其pH控制在9~10。乙酸酐滴加完毕后,继续常温磁力搅拌反应液1 h,使其充分反应。接着将反应液置于透析袋中进行透析处理,先用流动的自来水透析处理24 h,再用去离子水透析处理24 h。透析处理完成后,将剩余的透析液置于250 mL圆底烧瓶中,再加入100 mL 95%乙醇进行醇沉处理24 h。醇沉后的混合物以4 000 r/min离心10 min,收集沉淀物。将沉淀物置于50℃恒温干燥箱中干燥12 h,得到乙酰化芦荟多糖。乙酰化芦荟多糖质量占称取的芦荟多糖质量的百分比为乙酰化芦荟多糖得率。
1.2.3 磷酸化芦荟多糖的制备
量取5 mL磷酸和1 mL正丁醇,置于250 mL干净的圆底烧瓶中,磁力搅拌使其充分混溶。常温条件下,缓慢分批加入1 g精制的芦荟多糖,并保持磁力搅拌。芦荟多糖加入完毕后,将圆底烧瓶转移至50℃水浴锅中,继续磁力搅拌反应5 h。反应完成后,加入20 mL蒸馏水进行稀释,再将稀释后的反应液置于透析袋中进行透析处理。先用流动的自来水透析处理24 h,再用去离子水透析处理24 h。透析处理完成后,将剩余的透析液置于250 mL圆底烧瓶中,再加入100 mL 95%乙醇进行醇沉处理24 h。醇沉后的混合物以4 000 r/min离心10 min,收集沉淀物。将沉淀物置于50℃恒温干燥箱中干燥12 h,得到磷酸化芦荟多糖。磷酸化芦荟多糖质量占称取的芦荟多糖质量的百分比为磷酸化芦荟多糖得率。
1.2.4 羧甲基化芦荟多糖的制备
称取6 g氯乙酸固体,将其溶于10 mL异丙醇中,备用。量取20 mL 10%氢氧化钠溶液,置于250 mL干净的圆底烧瓶中。再称取1 g精制的芦荟多糖,加入圆底烧瓶中,并不断磁力搅拌使其充分溶解。常温条件下,将配制好的氯乙酸-异丙醇溶液缓慢滴加到圆底烧瓶中,并保持磁力搅拌。待氯乙酸-异丙醇溶液滴加完毕后,将圆底烧瓶转移至60℃水浴锅中继续磁力搅拌反应5 h。待反应完成后,将反应液冷却至室温,再加入20 mL蒸馏水稀释反应液。再将稀释后的反应液置于透析袋中进行透析处理,先用流动的自来水透析处理24 h,再用去离子水透析处理24 h。透析处理完成后,将剩余的透析液置于500 mL圆底烧瓶中,再加入200 mL 95%乙醇进行醇沉处理24 h。醇沉后的混合物以4 000 r/min离心10 min,收集沉淀物。将沉淀物置于50℃恒温干燥箱中干燥12 h,得到羧甲基化芦荟多糖。羧甲基化芦荟多糖质量占称取的芦荟多糖质量的百分比为羧甲基化芦荟多糖得率。
1.2.5 分子质量测定
芦荟多糖分子质量的测定采用凝胶渗透色谱-示差检测-多角度激光光散射(GPC-RI-MALS)方法。色谱系统为凝胶色谱-示差-多角度激光光散射系统,示差检测器为Optilab T-rEX,激光光散射检测器为DAWNHELEOSⅡ。利用软件ASTRA6.1处理色谱数据。
1.2.6 核磁共振光谱分析
应用核磁共振波谱仪对芦荟多糖及其衍生物进行碳谱和磷谱分析,核磁共振谱采用D2O作为氘代试剂。
1.2.7 糖含量测定
采用苯酚-硫酸法测定芦荟多糖及其衍生物(包括乙酰化芦荟多糖、磷酸化芦荟多糖和羧基化芦荟多糖)的含量。
1.2.8 取代度(DS)的测定
1.2.8.1 乙酰基(CH3CO-)取代度的测定
采用酸碱滴定法测定乙酰化芦荟多糖的乙酰基(CH3CO-)取代度。计算公式如下:

式中:A为样品中乙酰含量。
1.2.8.2 磷酸盐取代度的测定
采用磷钼酸铵法测定磷酸化芦荟多糖的磷酸取代度。计算公式如下:

式中:P为样品中磷酸盐百分含量。
1.2.8.3 羧甲基取代度的测定
采用酸度计法测定羧甲基化多糖的羧甲基取代度。计算公式如下:
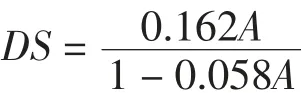
式中:A为样品中羧甲基含量。
1.2.9 抗氧化活性测试
1.2.9.1 羟基自由基(·OH)清除率的测定
配制质量浓度分别为0.1、0.2、0.4、0.8、1.6、3.2 mg/L的多糖样品溶液。在各比色管中分别加入不同质量浓度的样品溶液1 mL,再加入1 mmol/L的硫酸亚铁溶液1 mL、9 mmol/L的双氧水溶液1 mL和3 mmol/L的水杨酸-乙醇溶液1 mL(水杨酸-乙醇体积比为1∶3)。空白管中加入1 mL蒸馏水,混合均匀后于37℃恒温水浴中反应30 min。冷却至室温,使用紫外分光光度计在510 nm波长下测定各管的吸光度值。以3 mmol/L水杨酸-乙醇溶液(水杨酸-乙醇体积比为1∶3)调零,以等质量浓度VC作为阳性对照品,每组重复测试3次,结果取平均值。计算公式如下:

式中:A0为空白对照溶液的吸光度值;A1为样品的吸光度值。
1.2.9.2 超氧阴离子自由基清除率的测定
配制质量浓度分别为0.1、0.2、0.4、0.8、1.6、3.2 mg/L的多糖样品溶液。在各比色管中分别加入不同质量浓度的样品溶液0.2 mL,再加入3 mL 0.05 mol/LTris-HCl缓冲溶液(pH 8.2);空白管中加入1 mL蒸馏水,混合均匀后于室温反应10 min。再加入15μL 30 mmol/L的新制邻苯三酚溶液,混合均匀后反应4 min,迅速加入0.5 mL浓HCl终止反应。使用紫外分光光度计测定体系在325 nm处的吸光度值。以等质量浓度的VC作为阳性对照品,每组重复测试3次,结果取平均值。计算公式如下:

式中:A0为空白对照溶液的吸光度值;A1为样品的吸光度值。
1.2.9.3 抗脂质过氧化能力的测定
配制质量浓度分别为0.1、0.2、0.4、0.8、1.6、3.2 mg/L的多糖样品溶液。各比色管中分别加入不同质量浓度的样品溶液4 mL,再加入1 mg/mL大豆卵磷脂溶液3.6 mL和10 mmol/L新制硫酸亚铁溶液0.4 mL,空白管中加入4 mL蒸馏水,混合均匀后在37℃恒温水浴中反应20 min。待反应完成后冷却至室温,加入1 mL质量分数为20%的三氯乙酸溶液和1 mL质量分数为0.8%的硫代巴比妥酸溶液,于沸水浴中反应15 min。然后以3 500 r/min离心5 min,取上清液,使用紫外分光光度计在535 nm处测定各管的吸光度值。以等质量浓度VC作为阳性对照品,每组重复测试3次,结果取平均值。计算公式如下:

式中:A0为空白对照溶液的吸光度值;A1为样品的吸光度值。
1.2.9.4 DPPH自由基清除率的测定
配制质量浓度分别为0.1、0.2、0.4、0.8、1.6、3.2 mg/L的多糖样品溶液。取1 mL不同质量浓度的样品溶液于塞式试管中,快速加入4 mL预处理好的DPPH乙醇溶液(质量分数为0.004%)。混合均匀,室温下黑暗环境中反应30 min。测定待测溶液在517 nm处的吸光度值,以等质量浓度VC作为阳性对照品,每组重复测试3次,结果取平均值。计算公式如下:

式中:A0为等体积乙醇代替样品+DPPH乙醇溶液的吸光度值;A1为样品+DPPH乙醇溶液的吸光度值;A2为样品+不含DPPH乙醇溶液的吸光度值。
1.2.9.5 还原能力的测定
配制质量浓度分别为0.1、0.2、0.4、0.8、1.6、3.2 mg/L的多糖样品溶液。各比色管中分别加入不同质量浓度的样品溶液1 mL,再加入0.2 mol/L的磷酸盐缓冲溶液2.5 mL(pH 6.6)和质量分数为1%的铁氰化钾溶液2.5 mL。振荡均匀后,在50℃恒温水浴中反应20 min。待反应完成后冷却至室温,再加入2.5 mL质量分数10%的三氯乙酸溶液、0.4 mL质量分数为1%的三氯化铁溶液和4 mL蒸馏水,静置反应10 min。然后于3 500 r/min离心5 min,取上清液,使用紫外分光光度计测定700 nm处各管的吸光度值。以等质量浓度的VC作为阳性对照品,每组重复测试3次,结果取平均值。计算公式如下:

式中:A0为空白组溶液的吸光度值;A1为样品组的吸光度值;A2为对照组的吸光度值。
1.2.10 数据处理
采用SPSS20.0软件对所有试验数据进行分析,数据结果以平均值±标准差(x¯±s)表示。采用单因素方差分析进行统计学分析,以确定两组之间的差异是否有显著性。分析结果的显著性水平设置为概率值小于0.05(P<0.05)。
2 结果与分析
2.1 总糖含量和取代度
根据相关文献显示,苯酚-硫酸法稳定性好,准确度高,受到大多数研究者的青睐,并被用于多糖中总糖含量的测定[6]。取代度是指多糖中每个葡萄糖单元(葡萄糖苷)上活性羟基的数量,是用来衡量替代难易程度的指标。芦荟多糖及其衍生物的得率、总糖含量和取代度见表1。由表1可以看出,热水提取芦荟多糖的得率为0.51%(以芦荟叶湿重计)。芦荟多糖的3种衍生物(乙酰化、磷酸化、羧甲基化芦荟多糖)得率分别为84.56%、38.34%、81.61%,其中乙酰化芦荟多糖和羧甲基化芦荟多糖的得率极显著高于磷酸化芦荟多糖(P<0.01),这可能与反应条件、试剂等有关。从表1可以看出,通过热水浸提和Sevage法得到的芦荟多糖其总糖含量可以达到97.10%,这也说明在提取芦荟多糖的过程中采用Sevage法成功去除了蛋白质。芦荟多糖的3种衍生物的总糖含量均维持在80.68%~91.35%,其总糖含量较为理想。3个芦荟多糖衍生物的取代度在0.39~0.96之间,乙酰化芦荟多糖和羧甲基化芦荟多糖的取代度极显著高于磷酸化芦荟多糖(P<0.01),且乙酰化芦荟多糖的取代度最高,为0.96。在芦荟多糖衍生化过程中,所使用的试剂、反应时间、反应温度等因素均对其取代程度有影响。乙酰化和羧甲基化所使用的试剂活性高,反应条件较温和,最终获得较高的取代度;而磷酸化过程中使用磷酸,其活性较弱,从而导致取代度较低。

表1 芦荟多糖及其衍生物的总糖含量、得率和取代度Table 1 Total sugar content,yield and substitution degreeof aloe polysaccharides and derivatives
2.2 芦荟多糖分子质量的测定
与低分子质量化合物不同,多糖没有固定的分子质量,而是不同分子质量同系物的混合体系。因此,多糖分子质量是一个平均值,有一个分布的概念。这种分子质量的不均一性,称作多糖的多分散性。多糖试样的多分散性通常采用多分散系数来表征,多分散系数是重均分子质量(Mw)与数均分子质量(Mn)的比值或者z均分子质量(Mz)与重均分子质量的比值,常用的技术有凝胶渗透色谱-示差检测(GPC-RI)、凝胶渗透色谱-示差检测-多角度激光光散射(GPC-RI-MALS)等。芦荟多糖分子质量的测定结果见图1。以检测的保留时间为横坐标,以待测样品的摩尔质量为纵坐标得到绝对分子质量分析图。芦荟多糖分子质量测定的相关数据见表2。结果显示,芦荟多糖的数均分子质量为34693 u,重均分子质量为112381u,z均分子质量为723 114 u,峰值分子质量为10 043 u。通过对芦荟多糖分子质量的测定,可以清楚了解其多糖分子质量的大小。

图1 芦荟多糖的绝对分子质量分析图Fig.1 Absolutemolecular weight analysisof aloe polysaccharide.

表2 芦荟多糖分子质量数据Table 2 Molecular weight data of aloe polysaccharide.
2.3 芦荟多糖及其衍生物结构表征
核磁共振谱学是20世纪中叶起步并发展起来的。目前,核磁共振(NMR)已成为化学、医药、生物、物理等领域必不可少的研究手段。在共振技术中,氢(H)及碳(C)核磁共振是在有机化合物分子结构测定中最为重要的工具[7]。在确定有机化合物的结构时,碳核磁共振在某种程度上起着更为重要的作用,特别在多糖等高分子结构表征时,13CNMR是一种常用的表征手段。为了确定芦荟多糖及其衍生物的结构、衍生化是否成功,对其进行了核磁共振碳谱表征。图2为芦荟多糖的核磁共振碳谱图。由图2可见,δ100.36为糖苷端基C1的化学位移,而此处的化学位移小于100,则可推测芦荟多糖中的糖苷键为α-D型或者β-L型,δ60.72~76.22为C2、C3、C4、C5和C6的化学位移。从芦荟多糖的13CNMR图谱中可发现:在δ20.33处有吸收峰,该特征峰为甲基化中甲基碳的化学位移,说明芦荟多糖糖链或糖环上存在1个甲基。

图2 芦荟多糖核磁共振碳谱图Fig.2 13CNMRof aloe polysaccharides
为了得到更多的芦荟多糖衍生物,以芦荟多糖为原料,采用化学合成的方法制备得到了乙酰化芦荟多糖、磷酸化芦荟多糖和羧甲基化芦荟多糖。在对其衍生物进行结构表征过程中,采用13CNMR和31PNMR方法确证。图3为乙酰化芦荟多糖13CNMR,图4为磷酸化芦荟多糖13CNMR,图5为磷酸化芦荟多糖31PNMR,图6为羧甲基化芦荟多糖13CNMR。
由图3可以看出,在δ173.45处有明显的化学位移信号,该处为羰基特征信号峰。δ60.60~79.50为C2~C6的化学位移,与芦荟多糖相比变化不大(芦荟多糖:C2~C6化学位移为δ60.72~76.22)。δ98.94~100.46处为C1的化学位移,δ23.26和δ20.31为甲基的化学位移信号。

图3 乙酰化芦荟多糖核磁共振碳谱图Fig.3 13CNMRof acetylated aloe polysaccharides
由图4可以看出,与芦荟多糖相比,磷酸化后的13CNMR基本无变化。其中,δ60.54~78.42为C2~C6的化学位移,δ100.14为C1的化学位移,δ18.56为甲基中甲基碳的化学位移。为了更进一步确证磷酸根的存在,测定了磷酸化多糖的31PNMR。
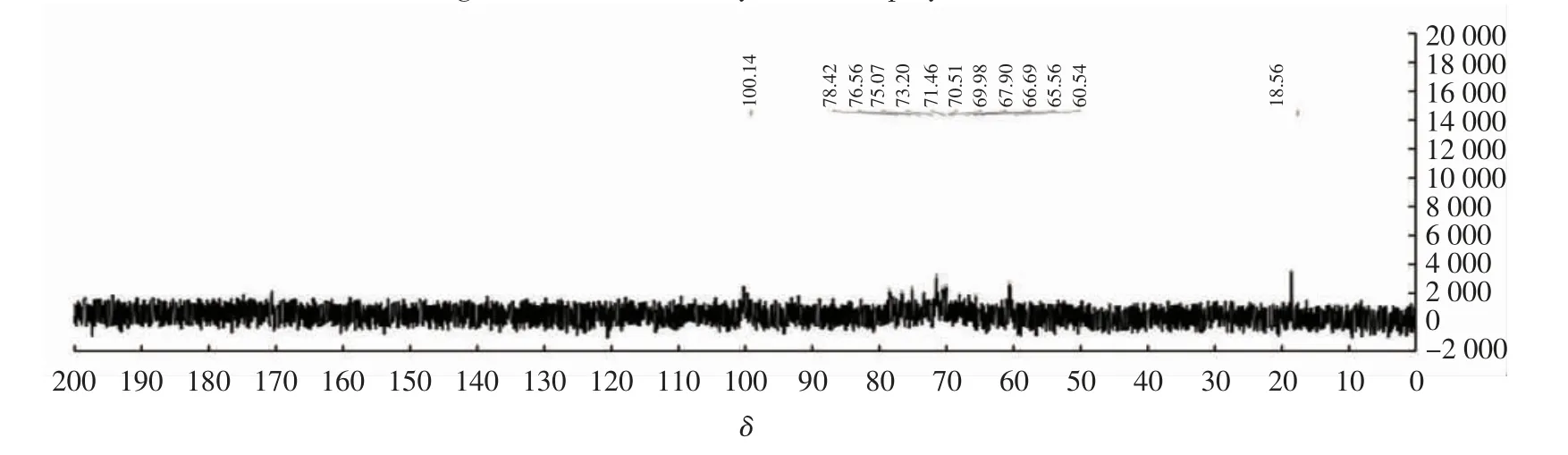
图4 磷酸化芦荟多糖核磁共振碳谱图Fig.4 13CNMRof phosphorylated aloe polysaccharides
由图5可以看出,在δ0.03和δ-91.64处有化学位移,并且在δ0.03处有明显吸收峰,说明在此处比较容易磷酸化,而在δ-91.64处比较难磷酸化,但可以说明芦荟多糖已被磷酸化。

图5 磷酸化芦荟多糖核磁共振磷谱图Fig.5 31PNMRof phosphorylated aloe polysaccharides
由图6可以看出,在δ170.62处有明显的化学位移信号,该处为羰基特征信号峰。δ60.30~78.30为C2~C6的化学位移,与芦荟多糖相比变化不大。δ100.16处为C1的化学位移,δ18.56为甲基的化学位移信号,δ29.70为羧甲基化中亚甲基碳的化学位移信号。

图6 羧甲基化芦荟多糖核磁共振碳谱图Fig.6 13CNMRof carboxymethylated aloe polysaccharides
2.4 体外抗氧化活性
研究表明,多糖具有抗肿瘤、抗病毒、降血糖、抗氧化、免疫调节作用等多种生理功能。多年来,人们对多糖进行大量的研究,对其抗氧化研究更是其中热点[8-10]。活性氧导致的氧化胁迫和氧化损伤是造成人体多种器官疾病和机体衰老的一个重要原因。随着地球环境的恶化,新的疾病不断产生,人们纷纷希望以抗氧化作为切入点,有效地预防和治疗疾病[11-16]。为了研究芦荟多糖及其衍生物的抗氧化活性,本试验进行了一系列体外抗氧化活性检测,包括超氧阴离子自由基清除能力、羟基自由基清除能力、抗脂质过氧化能力、DPPH自由基清除能力和还原能力的测定。
由图7可以看出,芦荟多糖及其衍生物对超氧阴离子自由基清除率测定中,在低质量浓度时表现出优于对照品VC,而在高质量浓度时略低于VC的活性。由图8可以看出,在同等质量浓度条件下,芦荟多糖及其衍生物与VC对羟基自由的清除能力均表现出相类似的活性。由图9可以看出,芦荟多糖及其衍生物在抗脂质过氧化能力方面也表现出良好的活性,在同等质量浓度下表现出与VC活性接近。由图10可以看出,芦荟多糖及其衍生物在DPPH自由基清除能力方面也表现出良好的活性,在低质量浓度时表现出低于对照品VC,而在高质量浓度时能表现出与VC相当。由图11可以看出,在还原能力方面,芦荟多糖及其衍生物能够表现出优异的活性。在同等质量浓度条件下,芦荟多糖及其衍生物的还原能力与VC相当,其中磷酸化的芦荟多糖在低质量浓度时优于VC。结合体外抗氧化活性结果,得到了一些有关芦荟多糖的构效关系。整体来看,磷酸化芦荟多糖的活性优于未衍生化的多糖,而乙酰化和羧甲基化的芦荟多糖其体外抗氧化活性同芦荟多糖基本处于同一水平。部分体外测试指标中,在相同质量浓度条件下,磷酸化芦荟多糖的活性优于VC。初步构效关系的研究结果能够为进一步修饰芦荟多糖提供一定的理论指导。

图7 芦荟多糖及其衍生物的超氧阴离子自由基清除能力Fig.7 Superoxideanion radicalsscavenging capacity of aloe polysaccharide and its derivatives

图8 芦荟多糖及其衍生物的羟基自由基清除能力Fig.8 Hydroxyl radical scavenging capacity of aloe polysaccharide and its derivatives

图9 芦荟多糖及其衍生物的抗脂质过氧化能力Fig.9 Anti-lipid peroxidation of Aloepolysaccharide and its derivatives

图10 芦荟多糖及其衍生物的DPPH·清除能力Fig.10 DPPH·scavenging capacity of aloe polysaccharide and its derivatives

图11 芦荟多糖及其衍生物的还原能力Fig.11 Reducibility of aloe polysaccharide and its derivatives
3 结论
本研究以新鲜芦荟为原料,经匀浆、热水提取、浓缩、醇沉、去蛋白、透析、干燥等步骤制备得到芦荟多糖。采用GPC-RI-MALS法对芦荟多糖分子质量进行测定,13CNMR分析法对芦荟多糖结构进行表征。结果表明,芦荟多糖含有1→4糖苷键,并且为甲基化多糖。为了进一步研究芦荟多糖的构效关系,以芦荟多糖为基础制备得到了乙酰化、磷酸化和羧甲基化的芦荟多糖,并对其进行了13CNMR和31PNMR确证,在此基础上研究了芦荟多糖及其衍生物的体外抗氧化活性。结果表明,芦荟多糖及其衍生物在对超氧阴离子自由基清除率、羟基自由基清除率、抗脂质过氧化、DPPH自由基清除率和还原能力方面表现出良好的活性。初步构效关系研究表明,磷酸化芦荟多糖的体外抗氧化活性最好,与阳性对照品VC处于同一水平。本研究为进一步研究芦荟多糖结构、开发功能性食品与药物提供必备的理论依据。
