人体内耳冰冻切片免疫组织化学染色技术探讨
2022-11-29王乃利郝欣平
李 颖 陈 彪 王乃利 郝欣平 *
[1.首都医科大学附属北京同仁医院耳鼻咽喉头颈外科,北京 100730;2.北京市耳鼻咽喉科研究所,耳鼻咽喉头颈科学教育部重点实验室(首都医科大学),鼻病研究北京市重点实验室,北京 100005;3.中国医学科学院基础医学研究所教学中心形态实验室,北京 100005]
在对人内耳免疫机制的研究中,为尽可能保留组织抗原的完整性,需采用冰冻切片技术。但由于内耳为骨性结构,因此必须经过固定和脱钙处理后,才能进行后续的切片步骤。由于甲醛固定液中的醛基与蛋白质中的氨基发生广泛的交联,而使抗原决定簇受到不同程度的掩盖,影响抗体与相应抗原决定簇的特异性结合,采用适当的抗原修复方法,可有效地破坏醛基交联,充分暴露抗原决定簇,提高抗原抗体结合的敏感性。又由于内耳的特殊骨性结构特点,且经过抗原修复等一系列免疫组织化学步骤,使得其冰冻切片较其他组织切片更容易出现脱片现象。为此,有效的防脱片处理和适当的抗原修复方法成为获得最佳内耳冰冻切片免疫组织化学染色结果的关键。
1 材料与方法
1.1 材料
1)研究对象:2019年4月至2019年9月期间,收集6例因病去世患者捐献的尸检颞骨标本,除了与年龄相关的变化外,没有已知的耳科疾病,患者年龄57~90岁,平均年龄76.2岁。
2)主要试剂及仪器:兔多克隆抗WARP抗体(Abcam公司,美国);鼠单克隆抗Neurofilament 200(NF200)抗体(Sigma公司,美国);兔多克隆抗IBA1抗体(Invitrogen公司,美国);鼠单克隆抗CD68抗体(Origene公司,美国);FITC标记羊抗鼠IgG、罗丹明标记羊抗兔IgG(Abcam公司,美国);含DAPI荧光封片剂(Abcam公司,美国)。IX81激光共聚焦显微镜(Olympus公司,日本);CM1850冰冻切片机(Leica公司,德国)。
1.2 实验方法
1)组织处理及冰冻切片:在患者死亡6~23 h后对尸体进行颞骨标本取材,并用中性甲醛溶液进行灌注固定,灌注后继续在甲醛溶液中浸泡3 d,固定结束后取出,自来水流水冲洗24 h。标本入10%(质量分数)乙二胺四乙酸(EDTA)脱钙,约1周后,电钻磨小至只剩耳蜗及半规管,继续脱钙,并隔天换液,约40 d左右,针刺无阻力感,即脱钙完成。标本入蔗糖液梯度脱水,最后入OCT胶4 ℃浸胶16~24 h。耳蜗用OCT胶平行于蜗轴方向包埋,液氮速冻,待OCT胶完全凝固取出,冰冻切片机切片,片厚8 μm,-20 ℃冷冻保存。
2)防脱片处理:取出切片,恢复室温后,分为3组。Ⅰ组(后固定组):入预冷的冷丙酮液中10 min,再入冷甲醇液中10 min进行后固定,取出风干15 min。Ⅱ组(烤片组):放46 ℃烤片箱中,烤片1~2 h。Ⅲ组(后固定+烤片组):入预冷的冷丙酮液中10 min后,取出风干15 min,再放46 ℃烤片箱中,烤片1~2 h。
3)抗原修复:将进行了防脱片处理的3组切片,每一组再分为A、B、C 3组(ⅠA、ⅠB、ⅠC、ⅡA、ⅡB、ⅡC、ⅢA、ⅢB、ⅢC共计9组)进行抗原修复。A组(热修复组):将切片放入已预热的PH 8.0 EDTA抗原修复液中,58 ℃ 5 min。B组(酶消化组):滴加0.1%(质量分数)胰蛋白酶,37 ℃20 min。C组(Triton组):滴加0.2%(体积分数)Triton X-100,室温10 min。
4)间接荧光免疫组织化学染色:将上述9组切片,每一组再分别用4种不同的抗体进行染色。切片入PBS浸洗3遍,入3%(体积分数)H2O2,室温10 min,PBS洗3遍,用0.2%(质量分数)BSA[内含0.02%(体积分数)Triton X-100]封闭30 min,分别滴加一抗WARP 1∶30、NF200 1∶400、CD68 工作液、IBA1 1∶500,4 ℃孵育过夜,PBS洗3遍,分别滴加FITC标记羊抗鼠IgG 1∶100,或罗丹明标记羊抗兔IgG 1∶100相应荧光二抗,室温避光孵育1.5 h,PBS洗3遍,含DAPI封片剂封片,激光共聚焦显微镜下观察、照相。
1.3 间接荧光免疫组织化学染色结果判定
激光共聚焦显微镜下观察4种标记蛋白中,所有未脱落切片在3种抗原修复方法下的表达情况。同一标记蛋白在扫描参数相同的情况下,将图像调至相对最清晰时进行40倍扫描获取图像。结合图像的荧光强度及抗体结合的特异程度,对结果进行判定。
1.4 统计学方法
采用SPSS 16.0统计软件对脱片程度进行统计分析,行χ2检验比较组间差异,以P<0.05为差异有统计学意义。
2 结果
2.1 脱片情况比较
防脱片处理的3组间比较,脱片数差异有统计学意义(P<0.01)。Ⅰ组(后固定组)和Ⅱ组(烤片组)比较,差异无统计学意义(P>0.05)。Ⅰ组和Ⅱ组分别与Ⅲ组(后固定联合烤片组)比较,差异均有统计学意义(P均<0.01)。Ⅲ组的防脱片效果最佳,详见表1、图1。
抗原修复的3组间比较, 脱片数差异无统计学意义(P=0.05)。B组(酶消化组)除在Ⅲ组防脱片处理方法时只有少数切片出现局部脱片,在其余两组防脱片处理方法时则大部分切片出现脱片现象。详见表2、图1。
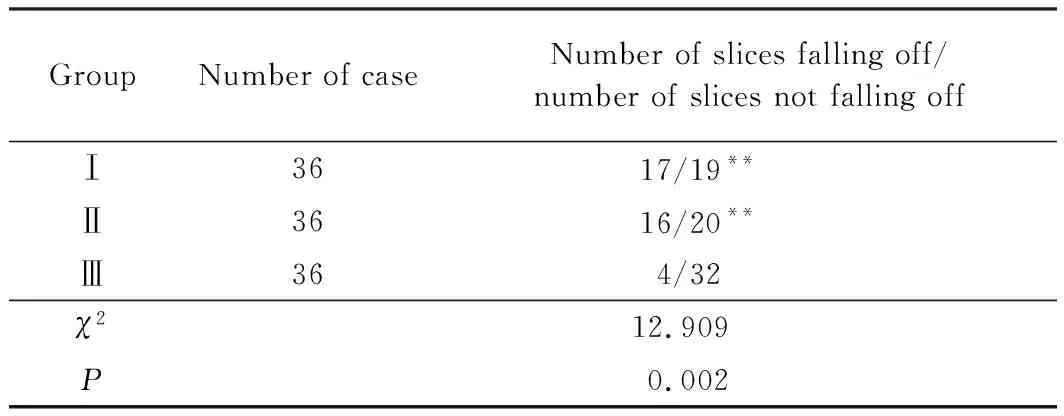
表1 不同防脱片处理方法脱片数的比较Tab.1 Comparison of the number of slices falling off with different anti-slice escaping treatments
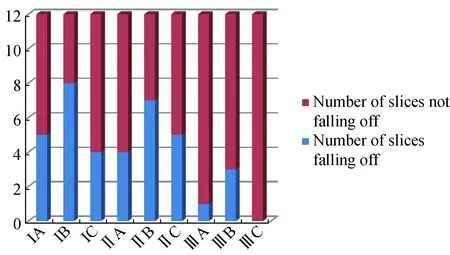
图1 不同防脱片处理及抗原修复方法脱片数的比较Fig.1 Comparison of the number of slices falling off with different anti-slice escaping treatments and antigen retrieval methods
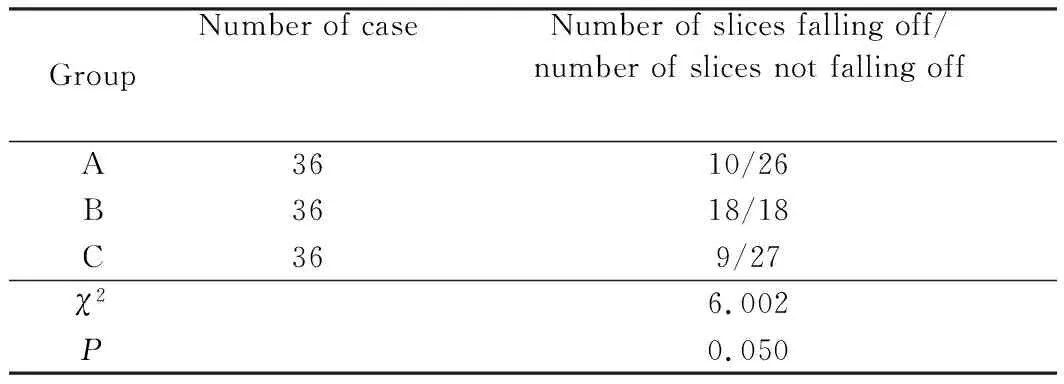
表2 不同抗原修复方法脱片数的比较Tab.2 Comparison of the number of slices falling off with different antigen retrieval methods
2.2 不同抗原修复方法的染色结果比较
1)WARP染色结果:A组(热修复组)和C组(Triton组)在耳蜗血管及微血管上皮呈特异阳性表达,且A组较C组表达更特异、更清晰。B组(酶消化组)无阳性表达,且细胞核已变形(图2)。
2)NF200染色结果:A组(热修复组)和C组(Triton组)在耳蜗螺旋神经节细胞体及突起均呈阳性表达,且特异、清晰。B组(酶消化组)无阳性表达,且细胞核已变形(图3)。
3)CD68染色结果:A组(热修复组)和C组(Triton组)在耳蜗呈现细胞体和细胞突起中溶酶体成分的点状染色,这些细胞的形态和位置与抗 IBA1 抗体的相似,阳性表达特异、清晰,但由于阳性细胞数较少,且不能完全染色细胞质,故较难判读。B组(酶消化组)呈极少数阳性表达,且细胞核已变形(图4)。
4)IBA1染色结果:A组(热修复组)和C组(Triton组)在耳蜗呈现大量分枝或变形虫(球体)样阳性表达,且特异、清晰。B组(酶消化组)无阳性表达,且细胞核已变形(图5)。

图2 免疫荧光染色3种不同抗原修复方法的WARP染色结果Fig.2 Immunofluorescence staining images of WARP with three different antigen retrieval methods(40×)A: group A (heat repair group) ;B:group B (enzymatic digestion group);C:group C (Triton group).

图3 免疫荧光染色3种不同抗原修复方法的NF200染色结果Fig.3 Immunofluorescence staining images of NF200 with three different antigen retrieval methods(40×)A: group A (heat repair group) ;B:group B (enzymatic digestion group);C:group C (Triton group).
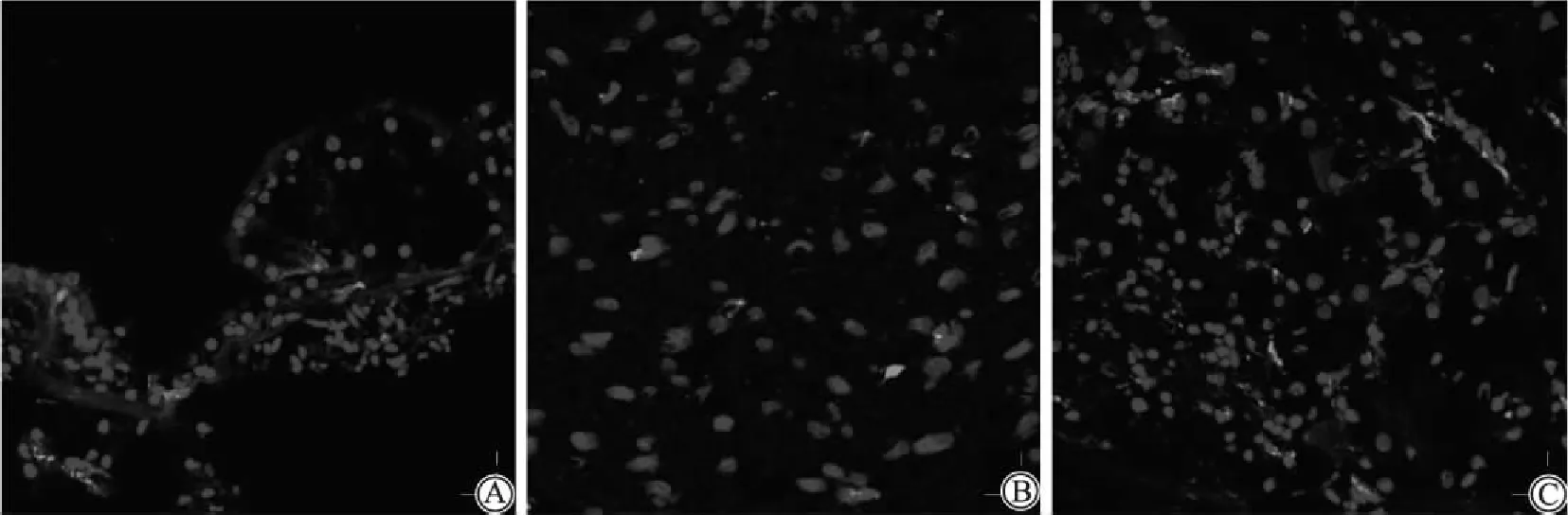
图4 免疫荧光染色3种不同抗原修复方法的CD68染色结果Fig.4 Immunofluorescence staining images of CD68 with three different antigen retrieval methods(40×)A: group A (heat repair group) ;B:group B (enzymatic digestion group);C:group C (Triton group).

图5 免疫荧光染色3种不同抗原修复方法的IBA1染色结果Fig.5 Immunofluorescence staining images of IBA1 with three different antigen retrieval methods(40×)A: group A (heat repair group) ;B:group B (enzymatic digestion group);C:group C (Triton group).
3 讨论
冰冻切片不经过乙醇脱水和二甲苯透明等过程,可使许多组织成分不受或少受影响。因此,冰冻切片不但省时简便,而且特别适合于组织化学观察。同时由于冰冻切片术可以获取较大的组织切片,所以很适用于对整个颞骨的内耳形态学研究[1]。由于人颞骨标本较难获得,所以之前的大部分相关研究都是基于动物颞骨标本。笔者结合既往的相关实验经验,并结合人颞骨标本的具体特点,对从标本的取材、固定、脱钙到切片、染色等过程进行了试验性研究,并对免疫荧光染色过程中,防脱片处理和抗原修复方法两个关键步骤进行了探讨。
在免疫荧光染色中,遇到的首要问题就是组织脱片问题。虽然切片时已应用黏附载玻片,但染色过程中还是会有较多切片出现脱片现象。怎样才能减少已切好冰冻切片的脱片现象?笔者分别采取了应用冷丙酮及甲醇进行后固定和加热烤片两种防脱片处理方法,虽然脱片现象有所改善,但还是不太理想。于是,将两种方法有机地结合起来,采用后固定联合烤片法,取得了良好的效果,脱片现象明显减少,并对不同防脱片处理和抗原修复方法的脱片数进行统计分析。不同防脱片处理方法间差异有统计学意义,Ⅲ组防脱片效果明显优于Ⅰ组和Ⅱ组。不同抗原修复方法间差异无统计学意义,说明不同抗原修复方法对脱片情况无明显影响。
丙酮和甲醇作为有机固定剂,其作用是沉淀蛋白质和糖,对组织穿透性很强,保存抗原的免疫活性较好。同时,丙酮和甲醇具有强大的脱水力,常用于冰冻切片及细胞印片和细胞涂片的后固定[2],可将细胞固定在一定形态并保持细胞的活性,甲醇还可以增加细胞结构的表面积,提高细胞对染料的吸收,同时由于甲醇吸附染色液中的水,使染色液升温,加速染色反应,所以常用在细胞染色前处理。加热烤片的作用主要是迅速烤干切片上的水分,防止组织皱缩,以及在染色过程中不易掉片。在石蜡切片中如此,在冰冻切片中亦起到相同作用,只是需要将温度适当调低,以减少对抗原的破坏。同时,切片质量的好坏也对脱片有至关重要的影响,切片要平整无皱褶,厚薄均匀才能减少脱片现象的产生。
由于标本已经过固定和脱钙,为更好地暴露抗原决定簇,提高抗原抗体结合的敏感性,适当的抗原修复必不可少。抗原修复技术的发明主要归功于生物化学家对蛋白质与甲醛化学反应的深入研究[3]。因为蛋白质分子与甲醛反应的复杂性,故难以找到一种适合所有组织抗原修复的方法 ,而抗原修复的主要机制是打开甲醛与蛋白质分子形成的交联物。Yam-ashita 等[4]将抗原修复技术应用于甲醛固定的新鲜组织的冰冻切片,获得了良好的免疫组织化学染色效果;Hasui等[5]用热修复抗原法对成人外周血单核细胞的p53蛋白进行免疫组织化学染色 ,染色效果亦较好。笔者将免疫组化实验中常用的3种抗原修复方法应用到本实验中,并根据冰冻切片的特点,将热修复的修复温度调整为58 ℃,修复时间为5 min。观察3种抗原修复方法的修复效果。
血管性血友病A结构域相关蛋白(von willebrand a domain-related protein, WARP)是一种细胞外基质分子,在软骨中表达受限,是周围神经、肌肉和中枢神经系统脉管系统中基底膜的一个子集;在人和小鼠的内耳中,WARP免疫反应描绘了位于血管纹、螺旋韧带、基底下区、间质组织以及螺旋和前庭神经节的血管;此外,WARP 能够描绘内耳中的微血管,从而可应用于研究耳科疾病发展中的血管病理学[6]。在生理情况下,耳蜗的螺旋韧带、螺旋板、螺旋神经节和血管纹周围血管存在免疫细胞[7-9]。Shi[10]发现内耳存在血管周围常驻巨噬细胞,它具有免疫防御、组织修复及免疫监视功能,产生超氧化物阴离子和炎性因子,并清除入侵的病原体和衰老坏死的细胞。内耳的巨噬细胞包括驻留巨噬细胞和浸润巨噬细胞(标记CD163+、IBA1+和CD68+),其主要分布于耳蜗外侧壁、骨螺旋板、螺旋神经元和感觉上皮等部位[9,11-13]。目前认为这些细胞属于先天性免疫系统和适应性免疫系统[14]。CD68 是溶酶体标志物和小鼠大唾液酸蛋白的人类同源物,是小鼠巨噬细胞和小胶质细胞中的氧化低密度脂蛋白胆固醇(low density lipoprotoin-cholosterol, LDL-C)结合蛋白。 大唾液酸和CD68包含在(溶酶体相关膜蛋白)糖蛋白家族中, CD68作为膜蛋白是氧化 LDL-C的清道夫或作为抗原呈递系统的组成部分[12]。IBA1被称为离子化钙结合衔接分子1,据报道[12]是一种专门针对小胶质细胞的特异性钙结合蛋白,它是与巨噬细胞和小胶质细胞吞噬作用相关的膜褶皱的关键参与者。具有不同形状的巨噬细胞密集存在于成人耳蜗、听觉神经和所有其他耳蜗组织中,在人类耳蜗的所有部分都有大量 IBA1表达细胞[15]。神经丝蛋白200(Neurofilament 200, NF200)是相对分子质量为200 000的神经纤维丝蛋白,在神经轴突中高表达,可用以标记神经元。NF200主要在神经细胞内合成、储存,参与神经细胞胞体及轴突的构成,在维持神经细胞形态特征、轴浆运输、神经再生等方面起着重要作用[16-18]。将上述分别标记血管、巨噬细胞和神经的4种抗原标志物应用到本研究中,A组(热修复组)和C组(Triton组)均取得较好的抗原修复效果,阳性结果特异、清晰。而B组(酶消化组)均修复效果不佳,且细胞核形态异常,组织结构受损,易脱片。笔者尝试将消化时间缩短,结果亦如此,推断可能与脱钙时间较长有关,据此,酶消化法不适用于此类实验中。
综上所述,本研究在人体内耳冰冻切片间接荧光免疫组化染色中,应用后固定联合烤片法防止染色过程中脱片现象的产生,联合应用热修复法或Triton打孔法进行抗原修复,取得了良好的染色结果。但此两种抗原修复方法只适用于本研究中的4种抗原标志物,对于一些较难染色的抗原标志物还可应用热修复联合Triton打孔法进行抗原修复,或对修复条件进行适当调整。应用适当的防脱片处理和抗原修复方法对提高内耳冰冻切片免疫组化染色的敏感性和制片质量起着至关重要的作用,可为内耳研究奠定实验基础。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明李颖:提出研究思路,设计研究方案,实验过程操作,撰写论文;陈彪:标本取材;王乃利:标本提供;郝欣平:标本取材,冰冻切片,审定论文。
