巴西橡胶树雄性不育相关候选基因HbXTH23的表达
2022-11-29刘红东党一敏高和琼庄南生
刘红东,党一敏,王 英,高和琼,庄南生
(1. 海南大学 热带作物学院,海口 570228; 2. 中国热带农业科学院 橡胶研究所, 海口 571101)
雄性不育(Male sterility)是存在于植物界中的一种普遍现象,它是指植物在有性繁殖过程中雄蕊非正常生长,自身不能产生有效花粉,但是雌蕊能正常发育受精[1]。目前研究人员已经在萝卜(Raphanus sativusL.)[2]、水稻(Oryza sativaL.)[3]、西瓜[Citrullus lanatus(Thunb.) Matsum. et Nakai][4]等多个品种或种间杂交品种中发现雄性不育现象,并开展了育种工作[5−6]。橡胶树存在雄性不育的现象,橡胶树育种主要采用杂交育种法,大面积推广种植的橡胶树品种几乎都是通过杂交选育获得的。杂交育种主要采用人工授粉的方式进行,普遍采用“雄蕊塞入法”。人工授粉耗费大,工序繁杂,加之橡胶树坐果率低(一般 5%~8%,最高不超过 10%),虽然每个杂交组合授粉数量超过2 000 朵,但真正获得可用于后续选育的杂交种子非常少。因此,由于杂交种子少,选育范围狭窄,橡胶树选育效率不高[7−10]。云南省热带作物科学研究所利用亲本雄性不育和雌性不育的特性,通过建立橡胶树自然杂交授粉园获得了大量杂交种子,扩大了筛选范围,通过授粉园获得的橡胶树自然杂交种子培育出了‘云研 77-2 ’和‘云研 77-4 ’两个大面积推广的优良品种[11]。然而,由于橡胶树雄性不育相关机制方面的研究报道尚少,使得橡胶树雄性不育种质的有效利用受到了限制。
XTH木葡聚糖水解酶/内转糖苷酶(xyloglucan endotransglucosylase/hydrolase, XTH) 是重构细胞壁的重要物质,其机制是通过催化作用,使木葡聚糖分子断裂和重连,对植物的纤维素-木葡聚糖结构进行修饰从而影响细胞壁结构[12]研究表明,XTH也参与花的发育,在花药与花丝柱上发生作用;在转录水平上,XTH的表达受植物激素和环境因素的调控,在植物生长和发育的很多方面调节细胞生长发育,同时不同的XTH对激素响应存在明显的差异[13−14]。在拟南芥中研究发现XTH23基因参与盐胁迫下的侧根的发育,其突变体对盐胁迫有极高的敏感度,其次XTH23是通过关键的油菜素内酯信号通路转录因子BES1被盐诱导的,BES1直接作用于XTH23的上游以控制它们的表达,表明XTH23通过BES1途径参与侧根发育,并有助于侧根对盐的适应[15]。据报道,在玉米中Zm-XTH23表达具有组织特异性,在幼茎中的表达量最高,且受到脱落酸 、NaCl以及PEG6000的诱导,在应答非生物逆境胁迫中具有重要作用[16],GmXTH23在大豆各组织中皆有表达,在茎中的表达量最高;与野生型拟南芥相比,拟南芥中过表达GmXTH23基因使得拟南芥在干旱胁迫下的耐受性增强,同时在干旱胁迫下GmXTH23通过提高脯氨酸与超氧化物歧化酶含量,并降低植物细胞在胁迫下的损伤来提高植物的抗旱性[17]。在荔枝中花穗发育不同时期LcXTH基因家族表达存在差异,LcXTH23表达量较高,推测其在花穗发育中起关键作用[18]。
笔者所在的课题组在前期转录组分析筛选出了一系列与橡胶树雄性不育相关的差异表达基因[19],其中包括XTH23基因。本研究利用qRTPCR对HbXTH23基因在橡胶树不同的组织器官及雄花不同发育时期的表达进行分析,通过mRNA原位杂交(mRNA fluorescencein situhybridization,mRNA-FISH)技术明确HbXTH23在橡胶树雄花中的特异性表达部位,以揭示HbXTH23基因在橡胶树雄性不育的功能与作用,从分子水平分析橡胶树雄性不育的机理,从而为橡胶树杂交育种提供科学的依据。
1 材料与方法
1.1 试验材料雄花不育品种‘热研93-114’和‘天任31-45’,雄花可育品种‘热研7-33-97’和‘PR107’,均为5年以上树龄的巴西橡胶树种。‘热研93-114’和‘天任31-45’品种采自国家橡胶树种质资源圃(儋州);‘热研7-33-97’品种采自中国热带农业科学院试验场二队(儋州),PR107采自中国热带农业科学院试验场一队(儋州)。采集每个品种的幼嫩叶子、树皮、胶乳、雌花和雄花,并于液氮中快速冷冻,放于−80 ℃保存备用。选取‘热研93-114’及‘热研7-33-97’品种的新鲜雄花为样本,使用RNase-Free的4%多聚甲醛固定液进行固定,样品固定1.5 h后用浓度为0.01 mol·L−1的磷酸缓冲液(pH 7.2)进行冲洗。尽可能将固定液残留液体冲洗干净,然后分别用25%、50%和70%的酒精室温下进行脱水处理,每次需脱水处理5 min,处理后的样品置于70%的酒精中,4 ℃下保存备用。
1.2 样品总RNA的提取及cDNA的合成使用RNA提取试剂盒[TIANGEN(天根), Cat.#DP441,多糖多酚植物总RNA提取试剂盒(离心柱型)]对巴西橡胶树的雌花和雄花的RNA进行提取,使用通用植物总RNA提取试剂盒[BioTeke(百泰克)Cat.#RP3301,植物总RNA提取试剂盒]对巴西橡胶树的幼嫩叶子、皮和胶乳的RNA进行提取,并进行反转录后合成cDNA,用TaKaRa试剂盒反转录cDNA,−20℃下保存。(具体操作方法参照试剂盒说明书)
1.3 荧光定量分析以合成的cDNA为模板,HbActin为内参基因,HbActin_F:5′-gattccgttgccc agaagtc-3′, HbActin_R: 5′-caccactcagcacaatgttacc-3′,使用TaKaRa(宝生物) 试剂盒[Cat# RR820A, TB Green Premix Ex TaqTM II(Tli RNaseH Plus)],以HbXTH23F: TCCAAAGAGCCAGCCAATG,HbXTH23R: TGTCTTCACAAGCCCACCC为引物,使用Bio-Rad伯乐PCR仪,采用两步法进行定量试验。每个样品设置3个生物学重复, 基因相对表达量用2-ΔΔCt法计算。用Origin 9.0软件进行数据处理并作图。
1.4 橡胶树HbXTH23的原位杂交选取样品新鲜雄花FAA固定液固定,梯度酒精脱水,并于70%酒精中保存备用。制作石蜡切片,石蜡切片标本制备过程主要参考文献[20]方法,并进行封片备用。利用AlleleID 6.0软件,通过基因的mRNA序列信息进行探针设计,探针长度在30~44 bp之间。在探针的5′末端含有5-FAM的荧光基团(Carboxyfluorescein-5-succimidylester)为5′-FAMAATATATTTGTATGGAGAATATAAGGGTCT CCACTAAGAT-3′,在蓝光的激发下,该荧光基团可发出绿光。mRNA-FISH参照刁艳茹[21]的方法,通过荧光显微镜(型号为BX51TR-32FA1-A03)观察,使用Image-Pro Plus 6.0软件进行图像采集。
1.5 生物信息学分析通过在线工具对基因HbXTH23(LOC110641156、XM_021792777)进 行分析。利用ExPASy ProtParam tool(http://web.expasy.org/protparam/)分 析HbXTH23的 理 化 性质。利用ExPASy ProtScale(http://web.expasy.org/protscale/)分析HbXTH23氨基酸序列的亲水性。利用ngLOC(http://genome.unmc.edu/ngLOC/index.html)和Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)工具预测 HbXTH23 蛋白的亚细胞定位情况,利用TMHMM Server v. 2.0(http://www.cbs.dtu.dk/services/)预测HbXTH23基因氨基酸序列的跨膜结构,氨基酸序列的二级结构预测使用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html),三 级 结构预测使用SWISS-MODEL(https://swissmodel.expasy.org/),用SignalP-5.0 Server(http://www.cbs.dtu.dk/services/SignalP/)对信号肽进行预测,利用MEGA构建HbXTH23蛋白与其他植物的同源蛋白的进化树。
2 结果与分析
2.1RNA的提取提取的RNA进行检测显示其OD260/OD280在1.9~2.1之间,表明RNA高质量,进行反转录为cDNA经电泳检测条带清晰。
2.2HbXTH23基因表达模式分析利用qRTPCR技术对HbXTH23基因在橡胶树雄性不育品种‘热研93-114’、‘天任31-45’和可育品种‘热研7-33-97’、‘PR107’的雄花、雌花、胶乳、幼嫩叶子及嫩皮中的表达量进行分析。结果表明,HbXTH23基因在不育品种的雄花表达量明显高于在可育品种雄花的表达量,也明显高于在其他组织的表达量,而在胶乳中几乎没有表达(图1)。

图1 HbXTH23基因在不同器官组织中的表达分析
为了解HbXTH23基因在雄花发育过程中的表达变化趋势,本研究对HbXTH23在小孢子母细胞时期、四分体和单核小孢子时期3个发育阶段雄花的表达量进行了比较分析。选择育种和生产中应用较多的2个品种‘热研93-114’(雄性不育)和‘热研7-33-97’(雄性可育)做比较分析(图2)。结果表明:HbXTH23基因在可育品种‘热研7-33-97’中在小孢子母细胞时期、四分体和单核小孢子时期3个阶段的变化呈现平缓上升的趋势,3个时期表达量均比较低,变化差异不明显;在不育品种‘热研‘93-114’中,从小孢子母细胞时期到四分体时期表达量逐渐上升,在四分体时期达到最高。从四分体时期到单核小孢子时期表达量呈下降趋势,在四分体时期的表达量高于同一时期的可育品种。该基因在不育品种与可育品种的四分体时期的表达差异最大,这表明该基因调控雄花不育主要在四分体时期。推测该基因在不育品种四分体时期的超高表达可能是导致橡胶树雄性不育的原因之一。
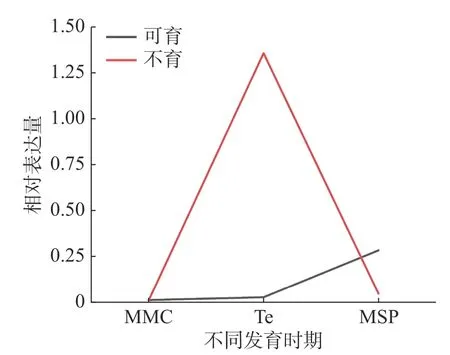
图2 HbXTH23基因在雄花不同发育时期的表达分析
2.3HbXTH23基因表达的RNA荧光原位分析对‘热研93-114’(雄性不育)和‘热研7-33-97’(雄性可育)四分体到单核小孢子时期的雄花进行石蜡切片,利用mRNA-FISH技术对HbXTH23基因雄花不同细胞中的表达进行检测。结果表明:不论是雄花不育品种还是可育品种,在花药壁、花丝(柱)上均检测到HbXTH23基因的表达(图3)。这表明HbXTH23基因可能主要是在花丝(柱)、花药壁中表达来调控雄花的发育,而在这些细胞中的异常表达可能导致了橡胶树的雄性不育。

图3 基因HbXTH23表达的原位分析
2.4HbXTH23基因的生物信息学分析
2.4.1HbXTH23基因编码的蛋白理化性质分析和亚细胞定位预测蛋白质理化性质分析结果表明,HbXTH23蛋白有286个氨基酸,在已知的22个蛋白质氨基酸中,除吡咯赖氨酸(Pyl,O)、硒半胱氨酸(Sec, U)没有参与HbXTH23蛋白编码外,其他氨基酸均参与了该蛋白的编码,其中丝氨酸(Ser,S)含量较高占11.9%,组氨酸(His,H)最低占比1%(图4)。蛋白分子量为31.95 kDa, 理论等电点7.62,总平均亲水性GRAVY为−0.288,氨基酸序列密集分布在负值以下(图5),为亲水性蛋白。该蛋白不稳定系数为31.96,蛋白不稳定系数大于40为不稳定蛋白,脂肪系数为73.01,热稳定性较好。亚细胞定位预测其存在于细胞壁、细胞质中。

图4 HbXTH23的氨基酸组成

图5 HbXTH23的疏水性曲线
2.4.2HbXTH23基因编码的蛋白结构分析HbXTH23氨基酸序列的跨膜结构预测结果表明,HbXTH23氨基酸序列跨膜螺旋氨基酸残基数量的期望值为15.50,蛋白前60个氨基酸中跨膜螺旋的氨基酸量的期望值为15.36,N-term位于膜细胞质侧的总概率0.468(图6),不属于跨膜蛋白。氨基酸序列的二级结构预测结果分析表明,HbXTH23氨基酸序列一共编码286个氨基酸,形成α-螺旋(Alpha helix)的氨基酸有49个,占比为17.13%,形成延伸链的氨基酸(Extended strand)有85个,占比29.72%,17个氨基酸形成β-转角(Beta turn),占比5.94%,形成无规则卷曲(Random coil)的氨基酸有135个,占比47.20%(图7)。HbXTH23三级结构预测结果(图8)表明,HbXTH23蛋白的三维模型覆盖了56.44%的蛋白序列,即161个氨基酸,可信度为92%。对HbXTH23基因编码蛋白的信号肽预测结果(图9)表明,HbXTH23具有信号肽且信号肽的剪切位点位于第26和第27号氨基酸之间。利用MEGA构建HbXTH23蛋白与其他植物的同源蛋白的进化树(图10), 结果表明,HbXTH23蛋白与刺毛黧豆蛋白(Mucuna pruriensRDY03917.1)、烟 草 蛋 白(Nicotiana attenuataXP_019259007.1)亲缘关系较近。

图6 HbXTH23 蛋白的跨膜结构分析

图7 HbXTH23蛋白的二级结构分析

图8 HbXTH23蛋白的三级结构分析
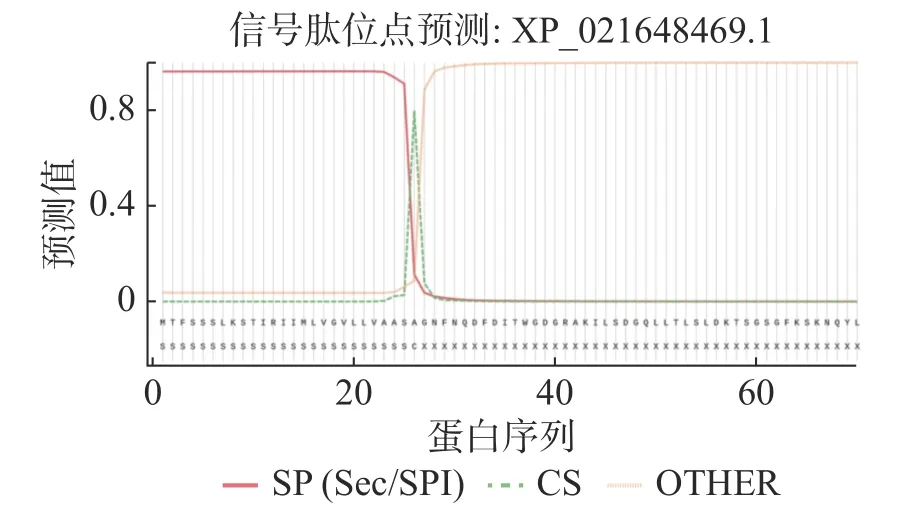
图9 HbXTH23的信号肽预测

图10 不同物种间XTH23蛋白的进化树分析
3 讨 论
木葡聚糖内转糖苷酶/水解酶(xyloglucan endotransglucosylase/hydrolase, XTH) 是植物细胞壁重构过程中的关键酶,是一种细胞壁松弛酶,在细胞壁木葡聚糖的断裂和再生及细胞壁重构中具有重要作用。XTH蛋白在植物细胞生长过程中不仅能够松弛细胞壁,而且参与细胞壁合成,能够强化细胞壁,还具有降解细胞壁功能作用。通过对莴苣和黄瓜下胚轴、豌豆节间,大麦叶伸长生长的过程[22−23],以及对猕猴桃、番茄等果实的成熟软化,浸水诱导的玉米通气组织的形成[24−26]的研究,发现XTH参与细胞壁的降解过程。YOKAYAMA等[27]研究表明XTH 基因可响应脱落酸、油菜内脂、生长素等植物激素,转录水平上调,说明 XTH可能参与植物激素对生长的促进作用。HE等[28]研究发现,拟南芥AtXTH23基因的表达水平在脱落酸ABA处理下显著上调,在拟南芥中油菜素甾醇BR通过增加XET表达量调控细胞壁伸长。以上前人研究结果表明,不同的XTH基因影响植物激素机制不同。本研究中,HbXTH23基因在橡胶树雄性不育的雄花中表达上调,该基因的高表达可能对脱落酸和油菜内脂等激素的信号的转导产生影响。在不育品种的雄花表达量明显高于在可育品种雄花的表达量而且也明显高于在其他组织的表达量,但在胶乳中几乎没有表达。橡胶树胶乳是其韧皮部乳管在受到伤害胁迫后排出的液体细胞质,乳管的一个重要功能是合成和储存天然橡胶,而本研究中该基因并未在胶乳中表达。该基因是否是在胶乳合成中或是在乳管中及其他与胶乳相关的组织中起作用需要进一步研究。
雄性不育的发生受到多种因素影响,其中花粉壁及花丝(柱)的异常均会导致雄性不育。在对萝卜的研究中发现不育花的花药干瘪, 瘦小、无粉、呈白色或乳白色, 且花柱大多弯曲,花丝缩短,花药大小有变化[29],拟南芥突变体ms1、dex1、nef1、rpg1、npu、efd和arf17都能造成花粉壁缺失进而导致花粉壁发育异常引起雄性不育[30]。在水稻中突变体wda1造成花药壁角质蜡层消失,小孢子发育迟缓,导致花药壁发育异常,最终导致雄性不育发生[31]。在水稻中不育系的浆片中的维管束数目少,缺少导管,花丝中无导管,细胞自溶慢,这可能是不育系开颖迟、闭颖慢,花丝伸长少及不易萎缩的主要原因[32]。在拟南芥中发现T-DNA插入突变体Salk_118 481株系的群体中, 筛选到1株雄性不育突变体,该突变体由基因FNE控制,通过花丝不能伸长完成授粉造成雄性不育[33]。本研究通过对HbXTH23基因的原位分析,发现该基因在花药壁及花丝(柱)上有表达,表明该基因在花丝柱与花药壁的表达异常可能是造成雄花败育的原因之一。HbXTH23蛋白的理化性质、亲疏水性、信号肽、跨膜结构及蛋白结构预测显示HbXTH23编码286个氨基酸,为疏水蛋白,具有信号肽,属于不跨膜蛋白,与刺毛黧豆蛋白、烟草蛋白的亲缘关系较近。本研究结果可为橡胶树雄性不育分子机制的研究提供参考,并为橡胶树的育种工作提供数据基础。
