茴香醛对变异链球菌的抗菌活性和抗生物被膜活性
2022-11-29倪雅丽
云 莉,倪雅丽
(海南省第二人民医院 药学部,海南 五指山市 572299)
龋齿是一种慢性进行性破坏性疾病,是由于口腔内共生菌和病原菌之间的生态失调而引起的。牙齿形成生物被膜(牙菌斑)后,牙齿残留的碳水化合物和糖经生物被膜内的细菌分解产生酸,导致牙齿表面的牙釉质脱落。生物被膜是由微生物群落在牙齿表面形成的生态环境,由细菌进行代谢产生的蛋白质、多糖和核酸组成的胞外聚合物(EPS)基质构成[1−2]。 变异链球菌(Streptococcus mutans)是口腔中常见的一种革兰氏阳性细菌,能引起口腔内微生物共生生态系统的失调。因此,变异链球菌也被认为是口腔内微生物形成生物被膜紧密相关的细菌之一[3]。变异链球菌通过复杂的生命活动定植于牙齿表面并形成生物被膜[4−5]。变异链球菌可以摄取口腔内残存的各种碳水化合物进行代谢活动,产生有机酸不断腐蚀口腔牙齿,导致龋齿的形成。变异链球菌代谢产酸是形成生物被膜中主要的毒力因素之一[6−7]。生物被膜表型在生理和功能上与浮游细菌有很大不同,生物被膜中的细菌表现出较低的代谢活性和生理机能,生物被膜结构可以作为细菌的物理屏障,限制抗生素渗透到生物被膜的深层。因此,在生物被膜中生长的细菌会增加其对抗生素的耐受性[8−9]。由于抗生素的滥用,导致常规疗法下细菌对抗生素的耐药性迅速增加,因此,迫切需要开发新型抗菌剂以抑制生物被膜的形成和降解成熟生物被膜。
近年来,使用天然植物产品治疗口腔疾病日益受到关注并被广泛研究[10]。茴香醛(p-methoxybezaldehyde)是广泛存在的一类天然产物,主要是从茴香、小茴香和大蒜中分离得到,目前已被广泛用于制药行业的抗菌药物生产[11−12]。《本草汇言》中记载,小茴香乃温中快气之药。最近研究结果表明,小茴香中主要成分之一茴香醛对许多微生物表现出很强的抗菌活性,包括金黄色葡萄球菌、念珠菌和酿酒酵母[13−15],在化妆品和药物的制备中也发挥着重要的作用。张冠楠等[16]的研究结果表明,茴香醛能改变金黄色葡萄球菌的菌体形态、细菌细胞膜的通透性;CHE等[17]的研究结果表明,茴香醛能改变细菌细胞壁完整性和细胞膜通透性发挥抑菌效果。然而,关于茴香醛对口腔致病菌中的变异链球菌抗菌活性尚未见报道。本研究旨在探讨茴香醛对口腔致病菌变异链球菌的抗菌效果及潜在的作用机制,以期将茴香醛开发为抗龋齿的天然药物。
1 材料与方法
1.1 菌种和试剂变异链球菌(S. mutans,ATCC25175)购自广东省微生物菌种保藏中心;茴香醛(货号A108958-5ml,阿拉丁)购自阿拉丁试剂(上海)有限公司;变异链球菌在脑心浸液肉汤(BHI,中国北京陆桥技术有限公司)培养基中培养;Live/Dead BacLight Kit试 剂 盒(ThermoFisher,L7012)。
1.2 最低抑制浓度检测采用GRENIER等[18]的二倍稀释法,将128 g·L−1茴香醛溶液和2.56 g·L−1洗必泰溶液稀释成系列溶液,测定茴香醛和洗必泰对变异链球菌的最小抑菌浓度(MIC)和最小杀菌浓度 (MBC)。变异链球菌培养至对数生长期后,无菌BHI 液体培养基稀释至2×105cfu·mL−1,取100 μL稀释菌液加至含有不同浓度茴香醛的96孔板中,使孔中总体积为200 μL,细菌终浓度1×105cfu·mL−1。菌液+PBS为阴性对照组,BHI液体培养基+PBS为空白对照组,洗必泰处理孔为阳性对照组。在37 ℃培养箱中培养24 h后观察不到混浊度的孔为茴香醛对变异链球菌的最低抑制浓度。
1.3 最小杀菌浓度测定将1.2实验组中未出现浑浊度的孔取100 μL涂布于BHI固体培养基上,在37 ℃培养箱中培养24 h后观察平板菌落生长情况,平板上无菌落形成视为茴香醛对变异链球菌完全杀灭,此浓度为最低杀菌浓度。每组设置3个复孔。
1.4 时间杀菌曲线实验根据CHEN等[13]的杀菌动力学测定方法,变异链球菌培养至对数生长期后,无菌BHI液体培养基稀释为2×106cfu·mL−1的菌悬液。稀释菌悬液与不同浓度的茴香醛(终浓度为0.5×MIC,1×MIC和2×MIC)等体积混匀,置于37 ℃恒温水浴0、10 、20 、30 、40 、60、90 、120、180 min。0.2%洗必泰(CHX)为阳性对照,无菌PBS+菌液作为阴性对照。孵育至指定时间后,4 ℃下6 000 r·min−1离心10 min,弃上清液,使用无菌BHI重悬,根据需要稀释10倍,取50 μL涂布于无菌BHI固体培养基上,在37 ℃ 温育24 h后计算细菌菌落。实验重复3次并取平均值。
1.5 细胞膜完整性实验
1.5.1 DNA 和 RNA泄露检测参考WANG等[19]的方法,通过检测细菌核酸的释放量判断细菌细胞膜的完整性。将变异链球菌在37 ℃培养至对数生长期,无菌PBS稀释至2×108cfu·mL−1,分别以终浓度1 ×,2×和4× MIC的茴香醛处理,细菌终浓度为1×108cfu·mL−1。空白对照组以PBS处理。37 ℃下孵育0、1、2和4 h后, 4 ℃下6 000 r·min−1离心10 min。取上清液,OD260下测定吸光值。在进行DNA和RNA实验的同时,采用平板涂布法检测活细菌数目,方法同“1.4 时间杀菌曲线实验”平板涂布部分,实验重复3次并取平均值。
1.5.2 对细菌可溶性蛋白质泄露的影响细胞完整性可以通过测定上清液中细菌蛋白质的释放量来确定,上清液中蛋白质含量测定参考BRADFORD等[19]实验方法。变异链球菌培养至对数生长期(浓 度 为1× 108cfu·mL−1)用 茴 香 醛(1×MIC和2×MIC)处理。以PBS处理为空白对照。实验组和处理组均在37 ℃下孵育0、1、2和4 h,4 ℃下2 500 r·min−1离心5 min,取上清液,OD595下测定吸光值。实验重复3次并取平均值。
1.5.3 激光共聚焦扫描显微镜实验参考钟亨任等[20]的方法,通过Live/Dead BacLight Kit试剂盒检测变异链球菌细胞膜的完整性。将变异链球菌培养至对数生长期,经PBS稀释至2×108cfu·mL−1。用500 μL的茴香醛(终浓度为1×MIC,2×MIC或4×MIC)与等体积的稀释菌液在室温下共同孵育60 min。等体积的异丙醇和无菌0.9%NaCl处理稀释菌液分别作为阳性和阴性对照。离心收集变异链球菌,并与Live/Dead BacLight Kit试剂盒在避光条件下孵育15 min。孵育后离心去除残余荧光试剂,通过激光共聚焦扫描显微镜(CLSM,Leica,TCS-Sp8)观察细菌。通过BioFilmAnalyzer v.1.0软件计算细胞活力。
1.6 茴香醛抑制变异链球菌的生物被膜活性测定参考HE等[21]测定茴香醛抑制变异链球菌形成生物被膜的活性。将变异链球菌培养至对数生长期后,含3%蔗糖的无菌BHI 液体培养基稀释至2×106cfu·mL−1备用。将变异链球菌稀释液接种到96孔板上,茴香醛的终浓度分别为0.5×MIC,1×MIC和 2×MIC,37℃下培养24 h。以PBS (pH 7.2) 作为空白对照。变异链球菌形成生物被膜通过结晶紫测定。最小生物被膜抑制浓度(MBIC50)定义为至少抑制细菌50%生物被膜形成时的最低茴香醛浓度。
1.7 生物被膜清除活性测定将变异链球菌培养至对数生长期,含 3% 蔗糖的无菌BHI稀释至1×106cfu·mL−1备用。将200 μL稀释菌液接种至96孔板中,在37 ℃下培养24 h后,轻轻将上清液去除,并取200 μL无菌液体培养基稀释的茴香醛(终浓度0.5×MIC,1×MIC和 2× MIC)加至各实验孔中。在37 ℃ 下孵育24 h,无菌 PBS (pH7.2) 用作空白对照,采用结晶紫法定量方法测定生物被膜的清除活性。
1.8 细菌表面疏水性测定变异链球菌表面疏水性变化采用微生物粘着碳烃化合物法进行测定。在37 ℃有氧条件下用相同浓度茴香醛(0.5×MIC,1MIC×和 2× MIC)分别孵育变异链球菌0或30 min后离心,均用无菌PBS洗涤2次,并重悬于相同的缓冲液中。在550 nm处测量吸光度(记录为OD1),加入 20% (v/v) 二甲苯后剧烈摇动试管,将混合物静置直至水相与有机相分离,在550 nm处测量水相的吸光度(记录为OD2)。疏水性百分比由下式计算:H= (OD1−OD2)/OD2×100%。使用0 min (H1)和30 min (H2)值之间的差异确定最终疏水性。
1.9RNA提取和RT-qPCR实验采用RT-qPCR方法评估茴香醛对变异链球菌毒力基因表达的影响。在37 ℃下将变异链球菌用不同浓度的茴香醛(0.25×MIC和0.5×MIC)孵育8 h,收集后按照Trizol™试剂(Invitrogen, CA, USA)说明进行总RNA 提取。将纯化的 RNA 溶解于20 μL DEPC水中,并在−80 ℃下储存备用。cDNA合成试剂盒(NOVA, CA,中国)用于合成 cDNA,茴香醛对变异链球菌gtf基因 (gtfB,gtfC和gtfD) 表达的影响通过qRT-PCR测定,引物如表1所示。

表1 引物序列
2 结果与分析
2.1 茴香醛对变异链球菌的抑菌活性茴香醛的对变异链球菌的抑菌活性通过测定MIC值进行定性和定量评估,洗必泰用作阳性对照,以确定茴香醛的抑菌作用。实验结果表明,茴香醛对变异链球菌的MIC为4 g·L−1,MBC为8 g·L−1, 洗必泰对变异链球菌的MIC为0.005 g·L−1,MBC为0.01 g·L−1。说明茴香醛对变异链球菌具有较好的抑菌活性。
2.2 茴香醛对变异链球菌的时间杀菌曲线0.5×MIC、1×MIC和2×MIC的茴香醛对变异链球菌的时间杀菌曲线如图1所示。0.2%洗必泰(CHX)在处理10 min后可完全杀死细菌,空白对照组中显示细菌数目快速增加,而经不同浓度的茴香醛干预后,作用0~10 min后能有效抑制细菌,在2×MIC浓度下作用30 min后可快速杀死细菌,即使在0.5×MIC的浓度下仍然能够抑制细菌的增长,呈现出浓度依赖性和时间依赖性的杀菌作用。

图1 茴香醛对变异链球菌的时间杀菌曲线
2.3 细胞膜完整性检测
2.3.1 DNA和 RNA泄露检测通过测定细菌培养液中细菌的核酸泄漏量,研究茴香醛能否靶向作用于变异链球菌的细胞膜。通常情况下,大分子物质(包括DNA和RNA)不能透过细菌完整的细胞膜。然而,一旦细菌细菌膜的完整性遭到破坏,大分子物质就会泄漏到细菌外环境中。图2结果表明,当变异链球菌用茴香醛处理时,随着茴香醛浓度的增加,细菌培养液在260 nm处的吸光值逐渐增加,表明细胞膜损伤程度和细胞膜通透性增强,从而导致细菌的DNA和RNA不断泄漏。相比之下,空白对照组的吸光度随着孵育时间的增加而略有变化,这是细菌进行生命活动而产生的代谢产物。结果表明,随着茴香醛浓度的增加,对变异链球菌的细胞膜造成损伤的程度和细胞膜通透性也在加大,导致大分子(DNA和RNA)外流。
2.3.2 细菌蛋白质泄露检测如图2-B所示,与空白对照组相比,以不同浓度的茴香醛处理变异链球菌后,菌液中可溶性蛋白质含量显著增加。2×MIC和4×MIC的茴香醛干预细菌1 h后,胞外可溶性蛋白质含量急剧增加,作用于3 h后胞外可溶性蛋白质含量整体趋于平稳状态。实验结果与2.3.1中茴香醛对变异链球菌胞外核酸泄漏的影响结果相似,进一步表明茴香醛可以改变细菌细胞膜的完整性,随着茴香醛浓度的增加细菌细胞膜完整性损伤程度也在加大,引起细菌内的DNA、RNA和蛋白质泄漏至细胞外。细菌细胞膜的完整性遭受损伤,干扰了细菌的正常生理活动,进而抑制细菌生长,甚至引起细菌死亡。
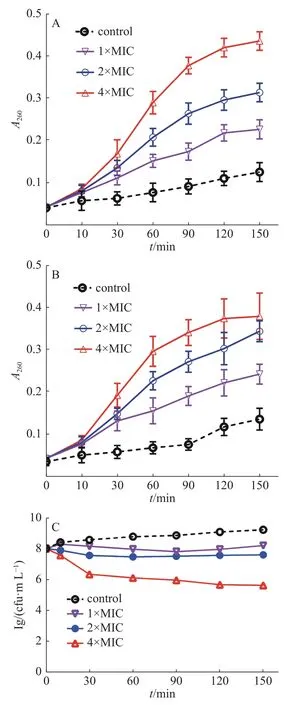
图2 茴香醛对变异链球菌核酸(A)、可溶性蛋白质泄漏(B)和活菌数目(C)的影响
2.3.3 激光共聚焦扫描显微镜实验茴香醛对变异链球菌细胞膜完整性的影响通过使用LIVE/DEADBacLight试剂盒检测(图3)。与阴性对照(图3-A)和阳性对照(图3-B)相比,不同浓度的茴香醛均能诱导变异链球菌的细胞膜完整性发生变化。用1×MIC茴香醛处理变异链球菌时(图3-C),细菌被染成橙色,表明茴香醛在该浓度下处理细菌后完整的细胞膜已经开始发生变化。当茴香醛浓度增加至2×MIC和4×MIC时(图3-D,E),细菌均变成红色,表明细菌细胞膜的完整性已经严重破坏。通过 BioFilmAnalyzer 计算细菌活力(图3-F),当变异链球菌在1×108cfu·mL−1的数量下,2×MIC茴香醛的浓度处理时,大部分的细菌均能被有效抑制。
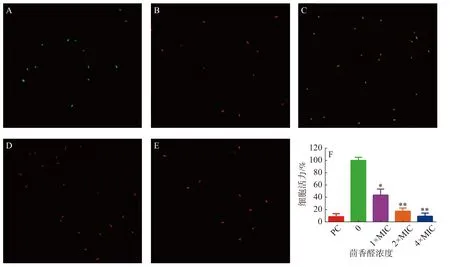
图3 茴香醛对变异链球菌细胞膜完整性的影响
2.3.4 抑制生物被膜活性通过结晶紫法测定茴香醛对变异链球菌形成生物被膜的抑制活性和形成生物被膜后的清除活性。如图4-A中所示,茴香醛在0.5×MIC,1×MIC和2×MIC浓度下均可有效抑制变异链球菌的形成和清除成熟生物被膜。如图4-B所示,茴香醛在0.5×MIC 浓度下对变异链球菌形成生物被膜初始附着量为45%~55%。与空白对照相比,变异链球菌预先铺板培养24 h后,茴香醛在1× MIC下对变异链球菌生物被膜降解至75%~80%,在 2×MIC 时生物被膜降解至60%~70%。结果表明,茴香醛能有效抑制变异链球菌形成生物被膜,也能有效降解成熟生物被膜。
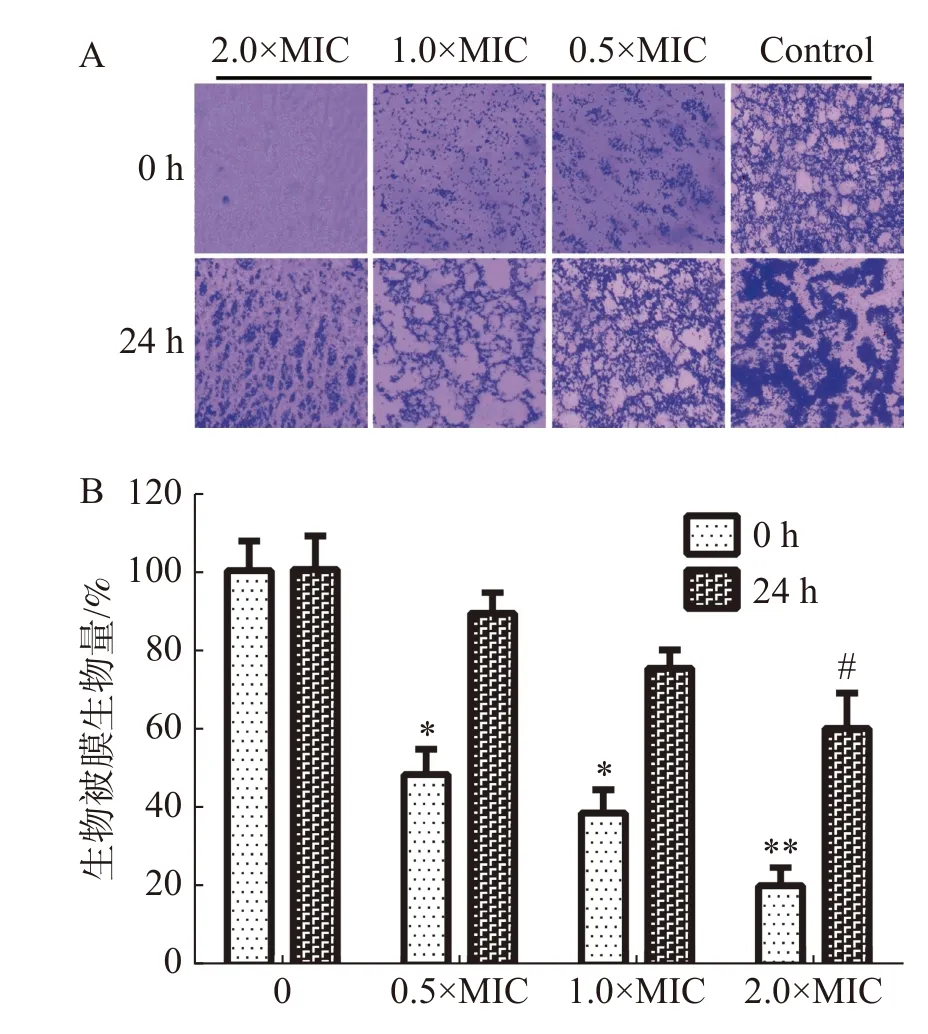
图4 茴香醛对变异链球菌生物被膜的影响
2.3.5 细菌表面疏水性的影响通过检测变异链球菌与碳氢化合物的粘附百分比确定细菌表面的疏水性。图5结果表明,茴香醛增加了变异链球菌的表面疏水性。不同浓度茴香醛(0.5×MIC,1×MIC和2×MIC)处理后的变异链球菌表面疏水率分别为(12.35±0.52)%、(14.68±0.44)%和(17.26±0.31)%,显著高于对照组(6.37±0.13)%。

图5 茴香醛对变异链球菌表面疏水性的影响
2.3.6 茴香醛对变异链球菌基因表达的影响茴香醛对变异链球菌生物被膜形成相关基因表达的影响如图6所示,结果表明,茴香醛在实验浓度范围内影响变异链球菌生物被膜形成。gtfB和gtfC基因是合成细菌胞外多糖中的非水溶性胞外多糖的基因,而gtfD是合成水溶性的细胞外多糖的基因。不同浓度的茴香醛处理变异链球菌后gtfB、gtfC和gtfD显著下调(P< 0.05),当0.5×MIC的茴香醛处理变异链球菌时,gtfB、gtfC和gtfD表达水平均低于0.8,表明亚浓度的茴香醛能显著下调gtfs的表达,抑制细菌胞外多糖的产生,干扰细菌生物被膜的形成。
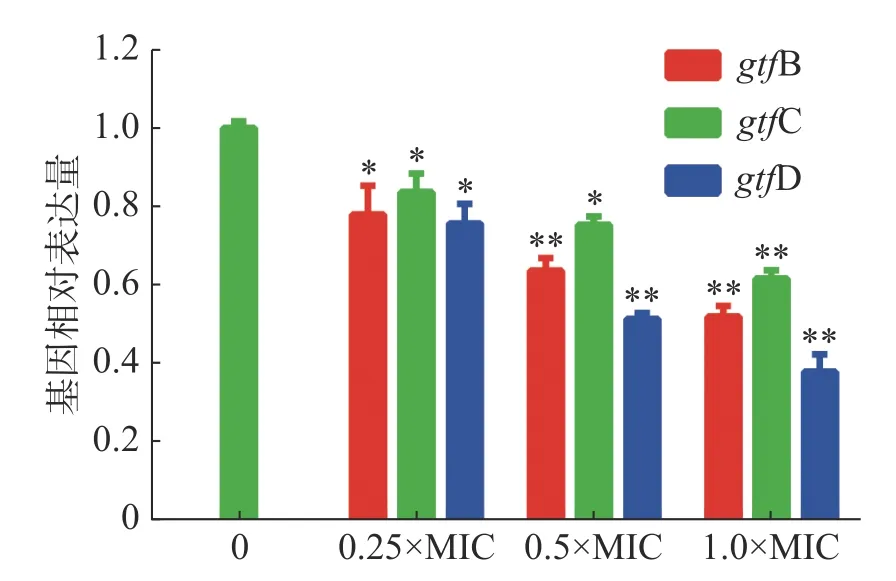
图6 茴香醛对变异链球菌基因表达的影响
3 讨 论
口腔疾病一直都是主要的健康问题之一,其中龋齿和牙周病是危害口腔健康的重要疾病。虽然目前医药市场上已有甲硝唑、替硝唑和奥硝唑等几种厌氧菌拮抗剂,但由于口腔环境下活性较低、剂量的使用和各种副作用导致此类药物的使用范围受到限制[14]。因此,急需寻找替代性和功能性更强的抗龋齿药物,天然植物来源药物由于具有强效抗菌特性和较小的副作用而成为一个重要的研究方向[22]。
茴香醛主要从茴香中分离出来,对许多酵母菌和霉菌菌株也表现出很强的抗真菌活性[23−24]。SHREAZ 等[11]研究结果表明茴香醛对念珠菌的MIC 值为 250 ~ 600 μg·mL−1。YU等[15]发现茴香醛对酿酒酵母和金黄色葡萄球菌的 MIC分别为256 μg·mL−1和 2~4 g·L−1。在本研究中,笔者观察到茴香醛对变异链球菌具有很强的抗菌活性,对变异链球菌的MIC 和 MBC 值分别为4 、8 g·L−1。茴香醛在2×MIC 浓度下30 min左右即可杀死所有细菌,即使在0.5×MIC 的浓度下仍然能够抑制细菌的增长。
细菌细胞膜在保护细菌内大分子物质和维持细胞活力方面起着至关重要的作用,细菌细胞膜完整性缺失将导致细菌死亡[16,21]。许多研究表明,从棕榈树、茴香、大蒜、茶树、百里香和八角中的提取物可以通过破坏细菌细胞膜完整性,抑制微生物的生长[25−28]。1×MIC的茴香醛处理变异链球菌60 min后,细菌的细胞膜完整性发生了很大变化,细胞膜内的核酸和蛋白质均发生不同程度的泄漏,导致细菌死亡。
细菌生物被膜的形成可以分为几个过程,包括最初粘附在固体表面上,可逆附着在固体表面,产生胞外聚合物(EPS),不可逆附着,最终发展为复杂的三维结构。结晶紫法测定表明,随着茴香醛浓度的增加,茴香醛在初始粘附阶段和成熟阶段更有效地减弱了变异链球菌生物被膜的形成,在高浓度下亦能降解成熟生物被膜。EPS由葡萄糖基转移酶 (GTF) 合成,在细菌形成生物被膜方面发挥关键作用。其中gtfB、gtfC催化蔗糖合成α-1,3和α-1,6键连接的非水溶性多糖,这有助于变异链球菌产生EPS基质并促进细菌聚集在稳定的生物被膜中,是斑块形成和细菌生物被膜结构稳定的重要物质。gtfD催化合成含有α-1,6键连接的水溶性多糖,促进细菌生物被膜表面与唾液蛋白相结合[28,29]。石榴皮原花青素能有效抑制变异链球菌生物被膜的形成和其毒力基因转录水平的表达[29]。在生物被膜形成过程中,茴香醛在亚浓度范围内能有效下调gtfB、gtfC和gtfD的表达。gtfs基因在变异链球菌生物被膜中的表达受到抑制,可能会减少生物被膜中葡萄糖基转移酶的数量,从而减少 EPSs 的产生,抑制生物被膜的形成。变异链球菌的产酸能力是变异链球菌的关键生理因素,作用于牙齿表面的脱矿质促进龋齿形成。积雪草酸和茶黄素对已形成的变异链球菌的生物被膜具有显著的抑制活性以及杀菌作用,并能降低其产酸和产EPS等致龋毒力[30−31]。本研究结果表明,随着茴香醛浓度的增加,pH下降的初始速率逐渐降低,茴香醛抑制变异链球菌产酸并防止牙齿脱矿,这可能是由于抑制了用于产酸的糖酵解酶。
4 结 论
茴香醛对变异链球菌表现出较强的抗菌活性,茴香醛抑制变异链球菌的机制之一可能与细菌细胞膜通透性的破坏有关,可能通过抑制葡萄糖基转移酶 (GTF) 合成进而抑制变异链球菌形成生物被膜。鉴于目前茴香醛在药物合成、化妆品、食品添加剂等领域的成熟应用,以及本研究中茴香醛对变异链球菌的抑菌活性和抑制生物被膜活性,未来有望进一步开发为抗龋齿药物或口腔保健品。
