克里本类芽孢杆菌TRCC 82001抑菌活性分析及发酵条件优化
2022-11-29黄华毅田呈明梁小文
黄华毅,田呈明,梁小文
(1.广东省林业科学研究院 广东省森林培育与保护利用重点实验室,广东 广州 510520;2.北京林业大学 林学院,北京 100083;3.江西天人生态股份有限公司,江西 吉安 343100)
植物病害的发生是引起农林作物产量损失和品质下降的主要原因之一。如何有效地预防和控制植物病害的发生一直是农林业生产上亟须解决的问题,伴随着传统农药对环境的污染和生态的破坏,建立环境友好型的农林业发展模式已经成为了人类共同的诉求[1-2]。生物农药的应用已被广泛认为可减少人类对传统农药的依赖,成为了国家“农药减量增效”的重要替代措施之一。目前,真菌、放线菌、细菌和病毒等微生物资源均被广泛应用于植物病害的防治中[3-5]。其中,类芽孢杆菌(Paenibacillus)是一类重要的生防微生物,其广泛分布于自然界的各种环境中。大量文献报道类芽孢杆菌对植物病害具有较好的抑制效果,且抑菌作用机制多样,如分泌抑菌活性物质、破坏真菌细胞壁、诱导植物产生抗性和促进植物生长等[6-7]。部分类芽孢杆菌已经获得了微生物农药的登记,如商品名为“康地蕾得”的类芽孢杆菌农药制剂,其有效成分为多粘类芽孢杆菌(P.polymyxa),目前市面上已经生产出了细粒剂和可湿性粉剂等产品种类,主要用于防治细菌性青枯病和真菌性枯萎病[6]。
克里本类芽孢杆菌(P.kribbensis)TRCC 82001是从土壤中分离获得一株生防细菌,该菌株生产性状好,代谢物质的抑菌活性强、抑菌谱广,可用于制备广谱性的植物病原真菌的生防菌剂,防治植物真菌病害[8]。本研究通过进一步研究克里本类芽孢杆菌TRCC 82001的抑菌谱和产真菌细胞壁裂解酶特性,优化其发酵条件并开展离体枝条防治试验,为该菌株及其抑菌物质的进一步开发和应用提供理论基础和科学依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 供试拮抗菌:克里本类芽孢杆菌TRCC 82001由江西天人生态股份有限公司提供,并保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.7996。供试植物病原真菌:金黄壳囊孢菌(Cytosporachrysosperma)、迂回壳囊孢菌(C.ambiens)、禾谷镰刀菌(Fusariumgraminearum)、葡萄座腔菌(Botryosphaeriadothidea)、茄立枯丝核菌(Rhizoctoniasolani)、胶孢炭疽菌(Colletotrichumgloeosporioides)和杨树炭疽菌(C.populi)和犁头霉菌(Absidiasp.)均由北京林业大学提供。
1.1.2 供试材料 离体枝条防治试验所用的杨树品种为欧美杨Populus×euramericana。
1.1.3 供试培养基 KMB培养基:蛋白胨20 g,甘油10 mL,K2HPO41.5 g,MgSO40.736 g,蒸馏水定容至1 000 mL,pH 7.2~7.4。
TYB培养基:胰蛋白胨10 g,酵母浸粉5 g,牛肉膏3 g,葡萄糖20 g,KH2PO40.5 g,MgSO40.3 g,MnSO40.07 g,FeSO40.3 g,柠檬酸0.3 g,蒸馏水定容至1 000 mL,pH 7.0~7.2。
改良的察氏培养基:蔗糖 30 g,NaNO31.5 g,K2HPO4·3H2O 1.0 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·7H2O 0.01 g,蒸馏水定容至1 000 mL,pH 7.0~8.0。
改良的3号培养基(modified medium No.3):葡萄糖22.64 g,蛋白胨11.93 g,大豆粉5.00 g,KH2PO41.00 g,MgSO4·7H2O 0.50 g,NH4Cl 3.00 g,Na2HPO41.00 g,酵母浸粉1.86 g,蒸馏水定容至1 000 mL,pH 7.0~7.2。
茯苓粉(ABP)培养基:KH2PO46.8 g,Na2HPO417.9 g,酵母浸粉6.7 g,茯苓粉4.0 g,苯胺蓝60 mg,琼脂12 g,蒸馏水定容至1 000 mL,pH 6.8。
胶体几丁质培养基:(NH4)2SO47 g,K2HPO41 g,NaCl 1 g,MgSO4·7H2O 0.1 g,酵母浸粉0.5 g,胶体几丁质5 g,琼脂15 g,蒸馏水定容至1 000 mL,pH 7.0~7.2。
羧甲基纤维素培养基:胰蛋白胨15 g,羧甲基纤维素钠10 g,大豆蛋白胨5 g,NaCl 5 g,琼脂15 g,蒸馏水定容至1 000 mL,pH 7.0~7.2。
脱脂牛奶培养基:脱脂牛奶 50 mL,NaCl 10 g,酵母浸粉5 g,琼脂15 g,蒸馏水定容至1 000 mL,pH 7.0~7.2。
脂酶检测培养基:蛋白胨10 g,NaCl 5 g,CaCl2·7H2O 0.1 g,Tween 80 10 mL,琼脂5 g,蒸馏水定容至1 000 mL,pH 7.4。
1.2 方法
1.2.1 拮抗菌抑菌谱的测定 克里本类芽孢杆菌TRCC 82001抑菌谱的测定采用平板对峙法[9]。在倒好的PDA平板(直径9 cm)中,距平板中央左右各2.5 cm的位置平行划线接种活化的拮抗菌株,30 ℃倒置培养1 d,然后在平板中央接种新鲜的病原真菌菌饼(6 mm),28 ℃倒置培养。对照组是在未接拮抗菌的平板中央直接接种病原真菌菌饼,每个处理3次重复,待对照组病原真菌菌落直径长至平板直径2/3以上,测定处理组病原真菌和拮抗菌之间抑菌带的宽度。
1.2.2 拮抗菌产真菌细胞壁裂解酶特性检测 将活化后的克里本类芽孢杆菌TRCC 82001单菌落分别接种至脱脂牛奶培养基、茯苓粉培养基、胶体几丁质培养基、羧甲基纤维素培养基和脂酶检测培养基平板中央,然后将平板倒置培养于30 ℃恒温培养箱中,连续观察7 d。观察脱脂牛奶培养基、茯苓粉培养基和胶体几丁质培养基平板中央菌落周围有无透明圈出现,出现透明圈则说明菌株能产生蛋白酶、β-1,3-葡聚糖酶和几丁质酶,反之,则说明不能产生[10];将质量浓度为1 mg/mL的刚果红染液对羧甲基纤维素培养基平板进行染色,静置染色15 min后,用移液枪缓慢吸去刚果红染液,再利用适量的1 mol/L的NaCl溶液洗涤平板,洗涤15 min后静置5 min,最后观察羧甲基纤维素培养基平板中拮抗菌菌株周围是否出现透明圈,出现则说明有纤维素酶产生,反之,则说明没有纤维素酶产生[11];观察脂酶检测培养基平板中生长的拮抗菌菌落周围是否出现模糊的晕圈,出现则说明有脂酶产生,反之,则说明无脂酶产生[12]。
1.2.3 拮抗菌最优发酵培养基的筛选 挑取活化的克里本类芽孢杆菌TRCC 82001单菌落接种至盛有100 mL LB培养液的三角瓶中(规格250 mL),于30 ℃、200 r/min的条件下振荡培养24 h得到种子液。按1%(体积比)的量将种子液分别接入装有100 mL不同的发酵培养基的三角瓶(规格500 mL)中,每种培养基各设置3个重复,于30 ℃、200 r/min条件下振荡培养6 d后,收集发酵液,于95 ℃条件下高压灭菌30 min,获得无活菌的发酵液。
无活菌发酵液的抑菌活性的测定采用菌丝生长速率法[13]。将发酵液分别按体积比1∶10、1∶20、1∶50、1∶100的比例与加热冷却至40~50 ℃的PDA混合,倒平板,在不同的平板中央分别接入直径6 mm的指示菌菌饼,28 ℃倒置培养,每隔1 d测量病原菌菌落直径,直至对照组菌落直径长至培养皿直径的3/4以上。以不加发酵液的平板作为对照,每个处理设3个重复,采用十字交叉法测量病原菌菌落直径,计算抑菌率。
抑菌率=[(对照组扩展直径-处理组扩展直径)/对照组扩展直径]×100%
(1)
1.2.4 拮抗菌发酵条件的优化 采用单因素分析法依次确定克里本类芽孢杆菌TRCC 82001的最优发酵时间(1、2、3、4、5、6、7 d)、温度(20、25、30、35、40 ℃)、pH(4、5、6、7、8、9、10)、转速(100、120、140、160、180、200 r/min)、装液量(20%、40%、50%、60%、80%)和接种量(1%、3%、5%、7%、9%),拮抗菌发酵培养和无活菌发酵液抑菌活性的测定分别参照1.2.3节中的方法。
1.2.5 拮抗菌对杨树腐烂病的离体枝条防治试验 挑取活化后的克里本类芽孢杆菌TRCC 82001单菌落,接种至盛有100 mL LB培养液的三角瓶中(规格250 mL),在30 ℃、200 r/min的条件下振荡培养24 h得到种子液。按1%(体积比)的量将种子液接入装有100 mL最优发酵培养基的三角瓶(规格500 mL)中,分别于30 ℃、200 r/min条件下振荡培养3d后,收集菌液备用。
采集粗细大小接近的1年生欧美杨枝条,剪成20 cm左右的长度,在0.1%的次氯酸钠溶液中浸泡1~2 min,无菌水冲洗干净后晾干,顶端封蜡。采用电烙铁对枝条进行烫伤处理,伤口直径6 mm,采用新鲜的杨树腐烂病病原菌金黄壳囊孢菌菌饼(6 mm)接种,利用无菌脱脂棉蘸上拮抗菌菌液对枝条烫伤伤口及周围部位进行涂抹从而接种拮抗菌。离体枝条防治试验共设3个组,每组设置12个枝条,其中空白对照组(CK1):在枝条烫伤的伤口处接种相同大小的空白PDA;对照组(CK2):在枝条烫伤伤口处接种新鲜的病原菌菌饼;处理组(TR):先在枝条伤口处涂抹拮抗菌的菌液,再接种新鲜的病原菌菌饼。枝条接种后均在伤口处覆盖1个湿的脱脂棉团,然后用保鲜膜缠绕固定,将处理好的枝条放置在底部垫有蘸有无菌水的脱脂棉的烧杯中水培,在25 ℃,12 h光照12 h黑暗交替的人工气候箱中培养,保湿48 h后解除保湿。在接种后14 d后测量病斑长度和宽度,并用透明硫酸纸裹缠发病枝条,用记号笔标记病斑范围,然后展开覆于方格纸上,测算病斑的面积,计算抑制效果,并在接种28 d后,观察枝条上杨树腐烂病子实体形成情况。发病率和抑制效果的计算公式如下[14-15]:
发病率=发病的枝条总数/总的枝条数×100%
(2)
抑制效果=[(对照组病斑面积-空白对照组病斑面积)-(处理组病斑面积-空白对照组病斑面积)]/(对照组病斑面积-空白对照组病斑面积)×100%
(3)
1.2.6 数据分析 采用Excel 2010和SPSS 20.0软件对实验数据进行统计分析,对不同处理组间的差异进行单因素方差分析,应用Duncan法进行差异显著性检验。
2 结果与分析
2.1 克里本类芽孢杆菌TRCC 82001的抑菌谱
对峙培养试验显示(图1),克里本类芽孢杆菌TRCC 82001对所测定的8种植物病原真菌的菌丝生长均表现出较强的抑制活性,抑菌带宽度范围在10.00~13.33 mm,其中对金黄壳囊孢菌的抑制作用效果最好,抑菌带宽度达到13.33 mm。
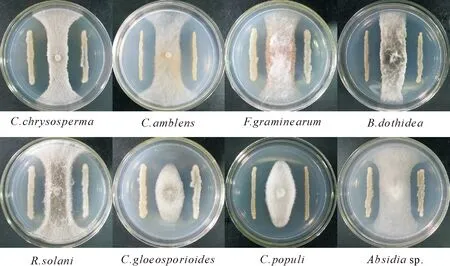
图1 克里本类芽孢杆菌TRCC 82001的抑菌谱
2.2 克里本类芽孢杆菌TRCC 82001产真菌细胞壁裂解酶特性
在蛋白酶(图 2a)、β-1,3-葡聚糖酶(图 2b)和纤维素酶(图 2c)检测平板中克里本类芽孢杆菌TRCC 82001菌体周围均出现明显的透明圈,而几丁质酶和酯酶的检测平板中克里本类芽孢杆菌TRCC 82001菌体周围则没有明显的透明圈或晕圈出现,表明克里本类芽孢杆菌TRCC 82001具有产生蛋白酶、β-1,3-葡聚糖酶和纤维素酶的特性,但不能产生几丁质酶和脂酶。
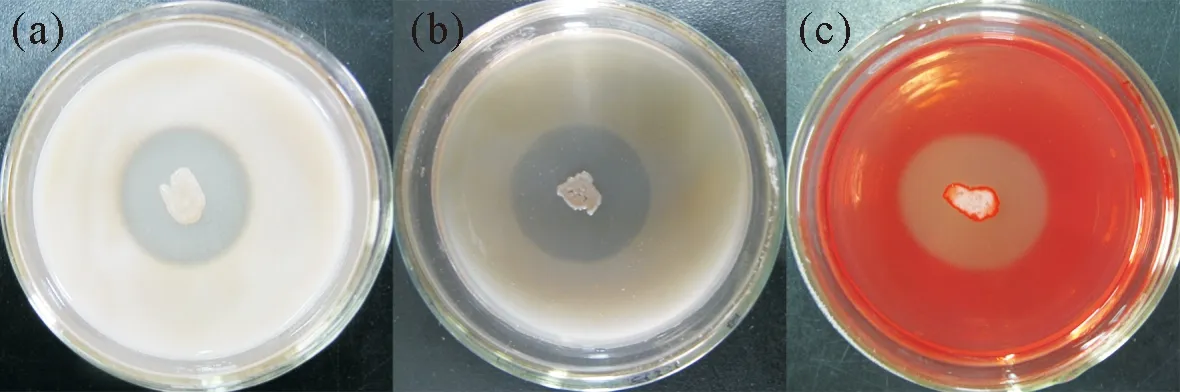
图2 克里本类芽孢杆菌TRCC 82001产生蛋白酶(A)、β-1,3-葡聚糖酶(B)和纤维素酶(C)
2.3 克里本类芽孢杆菌TRCC 82001最优发酵培养基的筛选
利用7种发酵培养基发酵培养克里本类芽孢杆菌TRCC 82001后,收集无活菌发酵液,测定其对指示菌金黄壳囊孢菌的抑制活性(发酵液按体积比1∶10与PDA混合),结果显示7种发酵培养基培养获得的无活菌发酵液均能抑制金黄壳囊孢菌的生长,其中抑菌活性最高的是PDB培养基的无活菌发酵液,其抑菌率明显高于其他6种发酵培养基的无活菌发酵液,抑菌率达到100%(图3),同时将PDB培养基发酵培养的无活菌发酵液稀释2、5、10倍后,其对金黄壳囊孢菌的抑菌率依然达到100%、100%和96.03%(图4),因此筛选出PDB培养基作为克里本类芽孢杆菌TRCC 82001的最优发酵培养基。
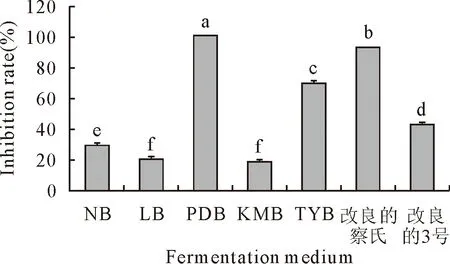
注:图中不同小写字母表示差异显著(P<0.05)。

图4 克里本类芽孢杆菌TRCC 82001不同质量浓度的PDB无活菌发酵液对金黄壳囊孢菌的抑菌活性
2.4 克里本类芽孢杆菌TRCC 82001发酵条件的优化
克里本类芽孢杆菌TRCC 82001分别依次在不同的发酵条件下发酵培养,获得无活菌发酵液并分别测定其对金黄壳囊孢菌的抑菌活性(发酵液按体积比1∶100与PDA混合),结果表明,发酵时间、温度、pH、转速、装液量和接种量对发酵获得的无活菌发酵液的抑菌活性均有影响(图5)。其中,无活菌发酵液的抑菌率随着发酵时间的延长先提高后逐渐稳定,抑菌率在发酵3 d前随着时间的增长而提高,达到97.22%,从第3天到第7天抑菌活性趋于稳定,因此3 d为最优发酵时间(图5a);温度和pH对无活菌发酵液的抑菌活性的影响均表现出先增长后降低的趋势,其中温度在30 ℃和pH为6时无活菌发酵液表现出最高的抑菌活性,分别达到95%和95.92%,因此温度为30 ℃和pH为6是最优发酵温度和pH(图5b、图5c);随着转速的提高,无活菌发酵液的抑菌活性逐渐提高至趋于稳定,其中转速低于180 r/min时,抑菌率随着转速提高而提高,而转速高于180 r/min后,转速的提高对于抑菌率的影响不大,抑菌率趋于稳定,在转速为180 r/min时,无活菌抑菌率达到96%,因此转速为180 r/min时为最优发酵转速值(图5d);发酵液装液量和种子液接种量对无活菌发酵液的抑菌活性的影响表现出先稳定后降低的趋势,其中装液量在50%以后和接种量在5%以后,无活菌发酵液的抑菌活性逐渐降低,在装液量为20%、接种量为1%时,无活菌发酵液的抑菌率分别达到96.01%和97.89%,因此装液量20%和接种量1%为最优的装液量和接种量(图5e、图5f)。
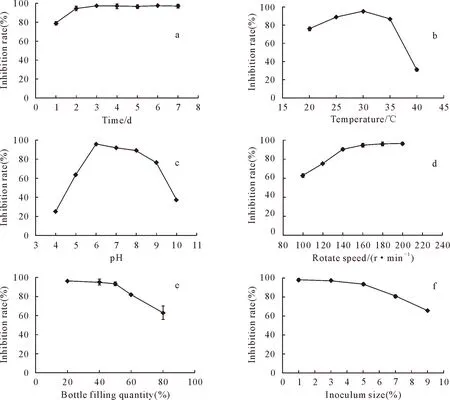
图5 不同发酵条件对克里本类芽孢杆菌TRCC 82001无活菌发酵液抑菌活性的影响
2.5 克里本类芽孢杆菌TRCC 82001对杨树腐烂病的离体枝条防治效果
在接种3 d后,对照组枝条表面以接种点为中心的褐色病斑逐渐开始扩展,并且褐变部位的表面较健康枝条部位有所下陷。接种14 d后,对照组枝条表面形成较大的褐色凹陷病斑,发病率达到100%,平均病斑面积达到(4.67±0.83)cm2;而空白对照组和处理组均未发现明显病斑形成,发病率为0,克里本类芽孢杆菌TRCC 82001能完全抑制金黄壳囊孢菌对杨树枝条的侵染危害,抑制效果达到100%。接种28 d后,对照组枝条病斑部位及周围表面有大量明显的分生孢子器突起,部分成熟的分生孢子器孔口处吐出大量卷曲的橘黄色分生孢子角,而空白对照组和处理组接种部位及周围均未见明显的突起的分生孢子器(图6)。

图6 克里本类芽孢杆菌TRCC 82001对杨树腐烂病的离体枝条防治效果
3 结论与讨论
本研究进一步验证了克里本类芽孢杆菌TRCC 82001对茄立枯丝核菌和禾谷镰刀菌的抑菌作用,同时还发现克里本类芽孢杆菌TRCC 82001能有效抑制金黄壳囊孢菌、迂回壳囊孢菌、葡萄座腔菌、胶孢炭疽菌、杨树炭疽菌和犁头霉菌的生长。克里本类芽孢杆菌TRCC 82001能产生蛋白酶、β-1,3-葡聚糖酶和纤维素酶。发酵优化结果表明,克里本类芽孢杆菌TRCC 82001的最优发酵培养基为马铃薯葡萄糖肉汤培养基;最佳发酵条件组合:时间3 d,温度30 ℃,pH 6.0,转速180 r/min,装液量20%和接种量1%。克里本类芽孢杆菌TRCC 82001对由金黄壳囊孢菌引起的杨树腐烂病的离体枝条抑制效果达到100%。
类芽孢杆菌是自然界中重要的一类生防细菌,具有抑菌活性强、抑菌谱广、抗逆性强和菌剂生产简单等优点。类芽孢杆菌及其发酵液已被广泛报道能有效抑制多种植物病原真菌的生长。Zhang等[16]研究发现多粘类芽孢杆菌ShX301对6种植物病原真菌具有较强的平板对峙抑菌活性,包括辣椒疫霉(Phytophthoracapsici)、尖孢镰刀菌(F.oxysporum)、平头炭疽菌(C.truncatum)、灰葡萄孢(Botrytiscinerea)、核盘菌(Sclerotiniasclerotiorum)和茄立枯丝核菌(R.solani)。卢美欢等[17]研究结果表明埃吉类芽孢杆菌(P.elgii)SWL-W8能抑制5种植物病原真菌的生长,包括串珠镰刀菌(F.moniliforme)、茄立枯丝核菌、扩展青霉(Penicilliumexpansum)、交链格孢菌(Alternariaalternata)和茄链格孢(A.solani)。Marcela等[18]研究报道类芽孢杆菌PNM200能有效抑制番茄枯萎病病原菌尖孢镰刀菌的生长。前期研究表明克里本类芽孢杆菌TRCC 82001能有效抑制13种植物病原真菌,包括灰梨孢(Phyriculariagrisea)、茄立枯丝核菌、根腐叶斑病菌(Drechslerasorokiniana)、大斑突脐孢菌(Exserohilumturcicum)、玉米蠕孢菌(Helminthosporiummaydis)、新月弯孢菌(Curvularialunata)、大丽轮枝菌(Verticilliumdahliae)、尖孢镰刀菌、禾谷镰刀菌、荔枝炭疽菌(C.litchi)、辣椒炭疽菌(C.capsici)、十字链格孢菌(A.brassicae)、香葱链格孢菌(A.porri)[8]。通过本研究进一步拓宽了克里本类芽孢杆菌TRCC 82001的抑菌谱。前期研究还表明,克里本类芽孢杆菌TRCC 82001无活菌发酵液对水稻稻瘟病具有较好的田间防治效果,防效最高达到84.92%[8]。由金黄壳囊孢菌引起的杨树腐烂病是严重危害杨树的病害之一,在我国广泛分布,尤其是在我国的东北、西北和内蒙古等干旱、半干旱地区常造成杨树大面积死亡[20]。克里本类芽孢杆菌TRCC 82001对杨树腐烂病具有较强的离体枝条防治效果,表明其具有应用于杨树腐烂病防治的潜力,进一步拓展了克里本类芽孢杆菌TRCC 82001在农林业植物病害防治上的应用。
由核糖体途径产生具有抑菌活性的蛋白质是类芽孢杆菌表现出抗菌特性的重要机制之一。而这些蛋白质大多数是真菌细胞壁裂解酶类,能通过裂解真菌病原菌细胞壁,导致病原菌细胞裂解,从而导致病原菌细胞死亡,如几丁质酶、纤维素酶、蛋白酶、脂肪酶和β-1,3-葡聚糖酶[1,19]。Li等[21]研究发现多粘类芽孢杆菌A21对多种植物病原真菌具有较强的抑菌活性,同时能产生葡聚糖酶。Kim等[22]研究结果表明拮抗细菌埃吉类芽孢杆菌HOA73分泌的几丁质酶可有效防治番茄灰霉病的发生。Yu等[23]认为土地类芽孢杆菌(P.terrae)产生的β-1,3-葡聚糖酶与其表现出的抑菌活性有一定关系。因此,克里本类芽孢杆菌TRCC 82001能产生真菌细胞壁裂解酶可能是其表现出抑菌活性的重要机制之一。
微生物产生代谢物质的水平不仅与微生物本身的特性有关,还与其生长所用的发酵培养基成分和发酵条件有密切关系,科学合理地优化发酵工艺,不仅可以提高发酵产物的水平还可以有效降低发酵成本[13]。胡亮亮等[24]通过单因素和正交试验结合得到了克里本类芽孢杆菌PS04产抗菌物质的最优发酵培养组分含量(蔗糖3%、NaNO30.15%和K2HPO40.1%)和发酵条件(初始pH 7~8、温度30 ℃、转速180 r/min、装液量10%和发酵时间84 h)。陈浩[25]利用单因素和正交试验结合的方法,确定了多粘类芽孢杆菌X33的最优发酵配方(g/L):甘露醇7 g,NH4Cl 9 g,NaCl 1 g,牛肉膏5 g,酵母粉5 g和最优发酵条件(接种量6%,初始pH为8,装液量40%,温度30 ℃,培养时间72 h)。本研究通过利用单因素试验方法确定了克里本类芽孢杆菌TRCC 82001的最优发酵培养基为马铃薯葡萄糖肉汤培养基和最优发酵条件(时间3 d、温度30 ℃、pH 6、转速180 r/min、装液量20%和接种量1%),使优化后的无活菌发酵液对金黄壳囊孢菌的抑菌率达到97.89%(发酵液按体积比1∶100与PDA混合)。这对于克里本类芽孢杆菌TRCC 82001的进一步开发利用具有重要意义。单因素试验对于发酵培养基和发酵条件优化有很大的局限性,本研究对发酵培养基的优化也只是局限于整体发酵培养基的选择,而对于培养基中的组分配比也未能进行优化,后期研究应进一步结合正交试验、响应面法等更为科学的优化策略对发酵培养基的配方和发酵条件进行综合优化,以期获得更为优化的发酵培养基组分和发酵条件[26]。
本研究进一步探究了克里本类芽孢杆菌TRCC 82001及其抑菌物质的抑菌活性,分析了其产生真菌细胞壁裂解酶特性,初步明确了其产抑菌活性物质的发酵培养基和发酵条件,并通过离体枝条防治试验进一步验证了其在植物病害防治上的作用效果,研究结果为后期深入研究克里本类芽孢杆菌TRCC 82001的抑菌机制、抑菌物质组分种类、工业化生产及田间应用等方面奠定了基础。
