柳树痂囊腔菌的基因组测序和比较基因组分析
2022-11-29赵丽娟
程 强,赵丽娟
(南京林业大学,林木遗传与生物技术省部共建教育部重点实验室,南方现代林业协同创新中心,江苏 南京 210037)
柳树(Salixspp.)具有适应性强、易繁殖的特点,在北半球温带地区广泛分布[1]。柳树是我国园林绿化和生态防护的主要树种,然而柳树人工林往往通过无性扦插种植,林分单一,常受到各种病害威胁。目前威胁柳树种植的主要是一些真菌病害,如栅锈菌属真菌(Melampsoraspp.)导致的叶锈病[2],壳囊孢属真菌(Cytosporaspp.)导致的烂皮病[3]等。病原真菌的基因组学研究,包括比较基因组、候选基因筛选和分析基因组进化动态,是发现关键致病基因和阐述致病机制的主要途径之一;这些基因和机制的阐述可为病害防治提供新的思路[4],因此有必要针对柳属植物的病原真菌基因组开展全基因测序研究。
柳树痂囊腔菌(Elsino⊇murrayae,简写为Emu)是座囊菌纲多腔菌目真菌,可在柳属植物叶片上引起疮痂状叶斑病症。柳树疮痂叶斑病危害范围广,在欧洲、大洋洲和南北美洲的各种乔木和灌木柳树上均有描述[5-6]。笔者在中国南京的垂柳(S.babylonica)叶片上分离获得了柳树痂囊腔菌,发现其可侵染乔木柳中的垂柳和爆竹柳(S.fragilis)、灌木柳中的簸箕柳(S.suchowensis),但在毛白杨(Populustomentosa)上可快速诱导类似超敏反应的细胞死亡;组织化学染色发现在该真菌的侵染早期柳树叶片无明显症状,侵染2 d后细胞出现死亡。笔者还克隆了1个侵染第2天高表达NLP(necrosis-and ethylene-inducing-like protein)基因,并且证实了NLP蛋白具有显著的植物细胞毒性。这些初步的研究提示柳树痂囊腔菌是柳属植物的病原真菌,而且在分子水平上可与柳树寄主发生相互作用[7]。另外,对甜橙痂囊腔菌(E.australis,简写为Eau)的杨树疮痂病致病型(poplar spot anthracnose,PSA)的基因组序列进行分析,该致病型可侵染多种杨属植物及甜橙栽培品种‘爱媛38’,但不能侵染垂柳[8]。本研究使用高通量测序技术对柳树痂囊腔菌NL1菌株(E.murrayaeNL1)进行基因组测序、组装和注释,在具有基因组信息的痂囊腔菌中进行系统进化分析显示其近缘种是甜橙痂囊腔菌杨树致病型NL1[E.australisNL1 (PSA)]菌株,两者的比较基因组分析鉴定了可能参与寄主适应性的候选基因,进而还分析了柳树痂囊腔菌的交配类型。这些信息有助于柳树病原真菌的相互作用研究,为柳树病害防治和抗性育种提供参考。
1 材料与方法
1.1 真菌培养和DNA提取
柳树痂囊腔菌NL1菌株生长于土豆葡萄糖琼脂(PDA)培养基平板,温度25 ℃,生长20 d。收集菌落经液氮研磨后,使用多糖多酚植物基因组DNA提取试剂盒(Tiangen, 北京)提取基因组DNA。使用ND 1000 Nanodrop(NanoDrop Technologies, 美国)和凝胶电泳检测基因组的DNA质量和浓度。
1.2 基因组测序、组装和注释
基因组DNA经超声随机打断,电泳回收小于500 bp片段,加接头后于南京集思慧远生物科技公司应用Illumina HiSeq 2500 测序仪,双端(Paired-end)150 bp测序。原始数据进行过滤,包括去除接头,去除低质量读序(Phred质量值≤19的碱基占总碱基的15%以上的读序),去除含N比例大于5%的读序。使用SOAPdenovo软件[9]组装过滤后数据,与BUSCO V3 的真菌数据库(the fungi_odb9)[10]比对,评估组装基因组的完整性。蛋白编码基因的预测使用GeneMark-ES[11],采用默认参数;rRNA 和 tRNA 基因预测分别使用 RNAmmer V1.2[12]和tRNAScan-SE V1.4[13]。碳水化合物活性酶筛选采用 dbCAN2 工具中的3种方法(HMMER,DIAMOND和Hotpep),采用默认参数[14]。分泌蛋白预测使用SignalP 5.0[15]和 TMHMM[16]。小分泌蛋白在NCBI NR数据中BLASTp比对,采用Evalue≤1×10-10;小分泌蛋白在Pathogen Host Interactions(PHI)数据库中BLASTp比对,采用Evalue≤0.001。 次生代谢物合成基因簇预测采用antiSMASH 5.0的真菌版本[17]。
1.3 系统进化与全基因组共线性分析
在BUSCO的 fungi_odb9数据库中随机选取100个真核通用基因[10],在Elsino⊇属真菌基因组中通过BLASTp(Evalue≤1×10-10)确定其同源基因,将这些同源基因的核苷酸序列串联起来构建系统进化树,使用近缘的多腔菌目真菌Myriangiumduriaei为外类群。进化树构建使用MEGA 7.0软件[18]的邻接法(Neighbor-Joining),1 000次Bootstrap自抽样验证。全基因组共线性分析使用CoGe比较基因组平台的SynMap模块[19],BLASTn (Evalue≤ 0.000 1)和quota-align-merge模型。
1.4 柳树痂囊腔菌(Emu)NL1菌株和甜橙痂囊腔菌杨树致病型NL1菌株[Eau NL1 (psA)]比较分析
筛选共有特异性蛋白: 结合使用OrthoMCL软件[20]和TBtools软件中的双向BLAST方法[21],寻找Emu NL1相对于其他Elsino⊇属真菌(不包括Eau NL1 (PSA)的特异性蛋白,寻找Eau NL1 (PSA)相对于其他Elsino⊇属真菌(不包括Em uNL1)的特异性蛋白,然后在两个特异性蛋白集合中寻找Emu NL1和Eau NL1 (PSA)的共有蛋白(OrthoMCL和双向BLAST同时支持)。
筛选差异蛋白: OrthoMCL和双向BLAST方法均不支持存在有直系同源关系的蛋白,为两个真菌之间的差异蛋白。利用BLAST程序(Evalue≤1×10-10)将差异蛋白序列在GO(gene ontology)数据库中进行比对,获得注释信息。使用TBtools软件中的GO Enrichment功能进行富集分析。
1.5 交配类型位点分析与检测
使用近缘的Eau NL1 (PSA)的MAT1-1-1,MAT1-2-1,HP1和HP2蛋白,在Emu NL1基因组和蛋白组中分别进行tBLASTn和BLASTp查找(Evalue≤1×10-10)。针对6个Emu菌株(NL1—NL6),使用Emu的MAT1-2位点的特异性引物进行PCR检测,引物基于MAT1-2-1基因序列设计,分别为MAT1-2-1-F (5′-GTTTGCGGTAGAGTATGAAGGAGT-3′)和MAT1-2-1-R (5′-AAAGATTCCAACATCATCTCCATT-3′)。
2 结果与分析
2.1 Emu NL1基因组与注释
针对Emu NL1的基因组测序原始数据(6.36 Gb,42 404 556个读序)进行了过滤,获得了6.26 Gb,41 741 302个读序的高质量数据。高质量数据经组装产生了1个20.7 Mb的基因组,GC含量为54.49%。该基因组包含98个scaffold,测序量覆盖组装基因组241.09倍。最长的12个scaffold(L50)占据基因组的一半,最小的scaffold大小为0.6 Mb(N50)。通过与BUSCO真菌数据库中290个单拷贝直系同源基因比对,显示99%基因(288/290)具有匹配结果,表明基因组组装结果完整度较高。在Emu NL1基因组中预测出8 256个蛋白编码基因,50 tRNA,11个RNA基因(表1)。

表1 柳树痂囊腔菌(Emu)NL1菌株基因组组装注释统计
2.2 Emu NL1致病相关基因注释
通过比对dbcan2数据库共筛选出486个基因编码碳水化合物活性酶(carbohydrate-active enZyme, CAZyme),其中包括14个多糖裂解酶(polysaccharide lyase, PL)、228个糖苷水解酶(glycoside hydrolases, GH)、54 个糖酯酶(carbohydrate esterase, CE)、68个辅助活性酶(auxiliary activitie, AA)、110个糖基转移酶(glycosyl transferases, GT)和12个具有糖结合模块(carbohydrate-binding module, CBM)的蛋白。184个碳水化合物活性酶是具有信号肽序列的分泌蛋白或膜蛋白,它们主要集中在PL(13个)、GH(110个)、CE(23个)和AA(31个)类型,表明这4种类型的CAZyme可接近植物细胞壁,具有参与植物细胞壁降解的潜力(图1A)。
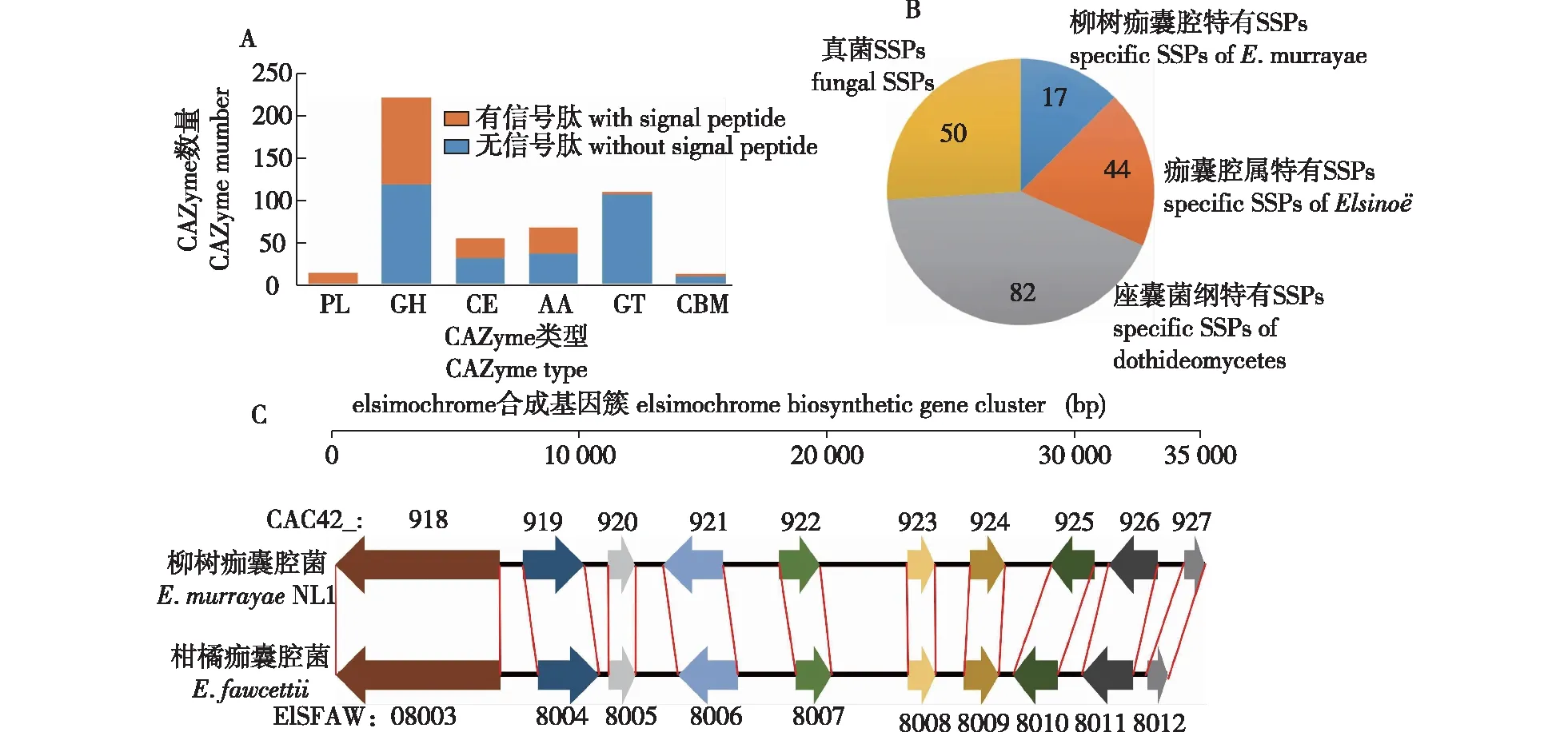
A.碳水化合物活性酶CAZymes;B.小分泌蛋白的特异性the specificity of SSPs;C.E. murrayae NL1和E. fawcettii的痂囊腔菌素合成基因簇the biosynthetic gene clusters of elsinochrome in E. murrayae NL1 and E. fawcettii。箭头代表基因与转录方向,相同颜色箭头代表同源基因Arrows represent genes and their transcription directions, and arrows with the same color represent homologous genes。 CAC42_918/ELSFAW08003. 聚酮合成酶polyketide synthase; CAC42_919/ELSFAW08004.依赖FAD的单加氧酶FAD-dependent monooxygenase;CAC42_920/ELSFAW08005.依赖FAD/FMN的氧化还原酶FAD/FMN-dependent oxidoreductase;CAC42_921/ELSFAW08006. MFS转运体MFS transporter;CAC42_922/ELSFAW08007. O-甲基转移酶O-methyltransferase;CAC42_923/ELSFAW08008.锌指转录因子zing-finger transcription factor;CAC42_924/ELSFAW08009. MFS转运体MFS transporter;CAC42_925/ELSFAW08010.依赖氧或FAD/FMN的氧化还原酶oxygen-,FAD/FMN-dependent oxidoreductase;CAC42_926/ELSFAW08011.漆酶laccase;CAC42_927/ELSFAW08012, beta-ig-h3成束蛋白beta-ig-h3 fasciclin。
植物病原真菌通过效应因子干扰寄主免疫系统,操纵寄主各种生物学过程,以此实现成功的定殖。效应因子通常是小分泌蛋白(small secreted protein,SSP),且常与已知蛋白无明显同源关系[22]。Emu NL1有783个蛋白具有信号肽序列,其中小于300个氨基酸且无穿膜结构域的小分泌蛋白有193个。在NCBI非冗余蛋白数据库中BLASTp比对发现17个小分泌蛋白是Emu特有蛋白(Table S1),这些蛋白可能作为Emu特有候选效应因子参与柳树的定殖;另外发现了44个只存在于Elsino⊇属真菌的小分泌蛋白,这些候选效应因子蛋白可能与该属真菌共有的致病性机制相关(图1 B)。部分小分泌蛋白与PHI数据库中已验证的效应因子具有较高的相似性,包括CAC42_7312对应诱导寄主细胞死亡的NLP(比对上的病原真菌为Zymoseptoriatritici),CAC42_5568对应可抑制寄主对寡聚几丁质识别的Ecp6(Cladosporiumfulvum),CAC42_2337对应结合寄主葡聚糖酶抑制蛋白的XLP1(Phytophthorasojae),CAC42_875对应为Cf-2抗性蛋白识别的无毒蛋白VAP1(Globoderarostochiensis)。
根据在antiSMASH真菌数据库中的比对结果,Emu NL1基因组具有16个次生代谢产物基因簇,分别为4个聚酮(polyketides,PKS),7个非核糖体多肽(non-ribosomal peptides,NRPS),1个杂合PKS-NRPS和4个多萜(Terpene)合成基因簇。痂囊腔菌素(elsinochrome)是一种真菌毒素,在氧和光存在时,痂囊腔菌素释放活性氧,对植物组织产生毒害。Emu NL1基因组具有痂囊腔菌素合成基因簇(PKS类型),与该基因簇的原型(柑橘痂囊腔菌E.fawcettii的EfETB基因簇)[23]相比,所有10个成员(CAC42_918-CAC42_927)具有高度的共线性,其编码蛋白的平均一致性达81.2%,这表明Emu NL1具备产生痂囊腔菌素的遗传基础(图1 C)。另外Emu NL1具有1个DHN 黑色素合成基因簇 (CAC42_1176-CAC42_1179)(PKS类型)和1个镰刀菌素(fusarin)合成基因簇(CAC42_1916-CAC42_1924)(PKS-NRPS类型);其他13个次生代谢物合成基因簇未找到高度相似的原型,产物未知。
2.3 痂囊腔菌属真菌系统进化关系
目前已报道的痂囊腔菌属真菌的基因组序列有6个,分别是葡萄痂囊腔菌(E.ampelina)YL-1菌株、3个柑橘痂囊腔菌(E.fawcettii)菌株,甜橙痂囊腔菌甜橙疮痂致病型(sweet orange scab, SOS)Ea-1菌株[E.australisEa-1 (SOS)]和甜橙痂囊腔菌杨树致病型NL1菌株(E.australisNL1 (PSA))[8,24-26]。为了解Elsino⊇属真菌的系统进化关系,使用100个通用真核基因构建了系统进化树,结果(图2、表2)显示Emu NL1与2个Eau菌株在1个高支持的进化枝,而Eau和E.ampelina在另外一个进化枝。此项结果与痂囊腔菌属的已经报道的多基因分型结果一致[7,27],即,在痂囊腔菌属中Emu与Eau具有临近的系统进化关系。E.murrayae与其他痂囊腔菌属真菌以及近缘的Myriangiumduriaei全基因组比对和共线性分析发现,Emu NL1与Eau NL1 (PSA)具有最长的共线性长度19.86 Mb,最高的平均一致性(74.5%),以及最多的共线性基因数量(6 561个)。

图2 痂囊腔菌属7种真菌的系统进化关系
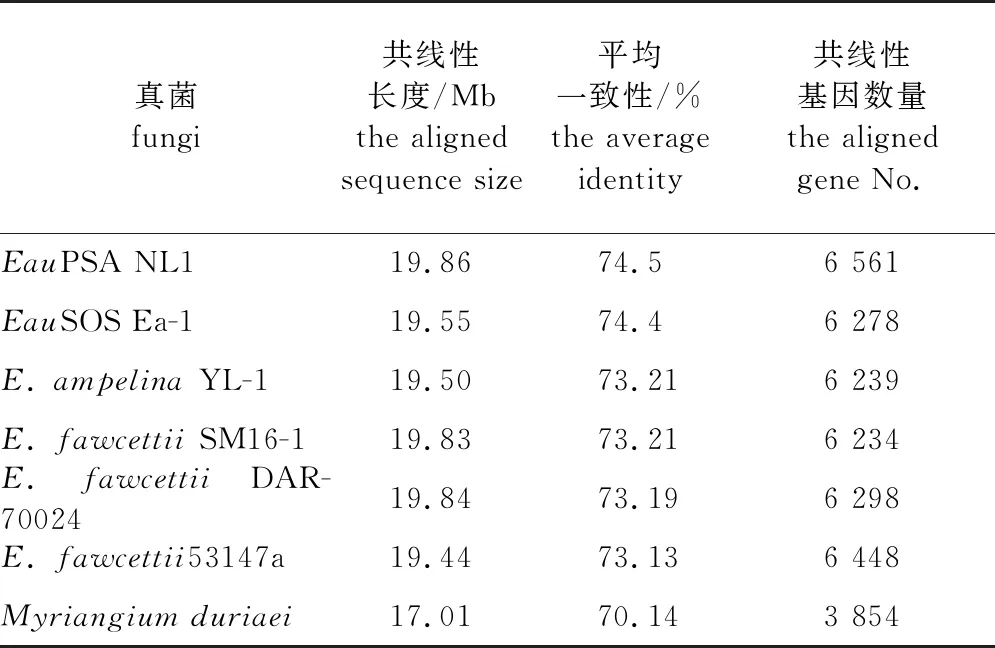
表2 柳树痂囊腔菌 NL1与痂囊腔属和多腔菌属真菌的共线性分析
2.4 Emu NL1与Eau NL1 (PSA)比较及Emu NL1交配类型位点
Emu NL1与Eau NL1 (PSA)本身是近缘物种,而且侵染的寄主也是近缘物种(杨柳科的柳树和杨树)。这2种真菌共有的,同时在其他Elsino⊇属真菌中缺失的基因,可能参与特异性定殖杨柳科植物。结合OrthoMCL和双向BLAST方法在Emu NL1和Eau NL1 (PSA)中筛选出12个共有特异性蛋白,其中CAC42_7074/B9Z65_8229是1个有64/65个氨基酸的小分泌蛋白,无明显的结构域特征,并且在公共数据库中没有同源蛋白;CAC42_1565/B9Z65_5438和CAC42_817/B9Z65_6139是这两个真菌中特有的分泌蛋白;CAC42_4946/B9Z65_8048和CAC42_7243/B9Z65_1695是两个涉及氧化还原过程的酶类,CAC42_1526/B9Z65_5383是丝裂原活化蛋白激酶,其他6对基因是功能未知的细胞内蛋白。
Emu NL1和Eau NL1 (PSA)分别特异性的侵染柳属和杨属植物,因此两种真菌可能存在差异的蛋白参与寄主的选择。在两种真菌之间比较分析分别筛选出752个Emu NL1和1 746个Eau NL1 (PSA)差异蛋白。267个Emu NL1和676个Eau NL1 (PSA)差异蛋白获得了GO 注释,GO富集显示2种真菌的差异蛋白的注释信息存在相同之处,即差异蛋白多集中于碳水化合物代谢过程和毒素代谢过程,多位于质膜和内质网,多具有转运活性和裂解酶活性(图3)。
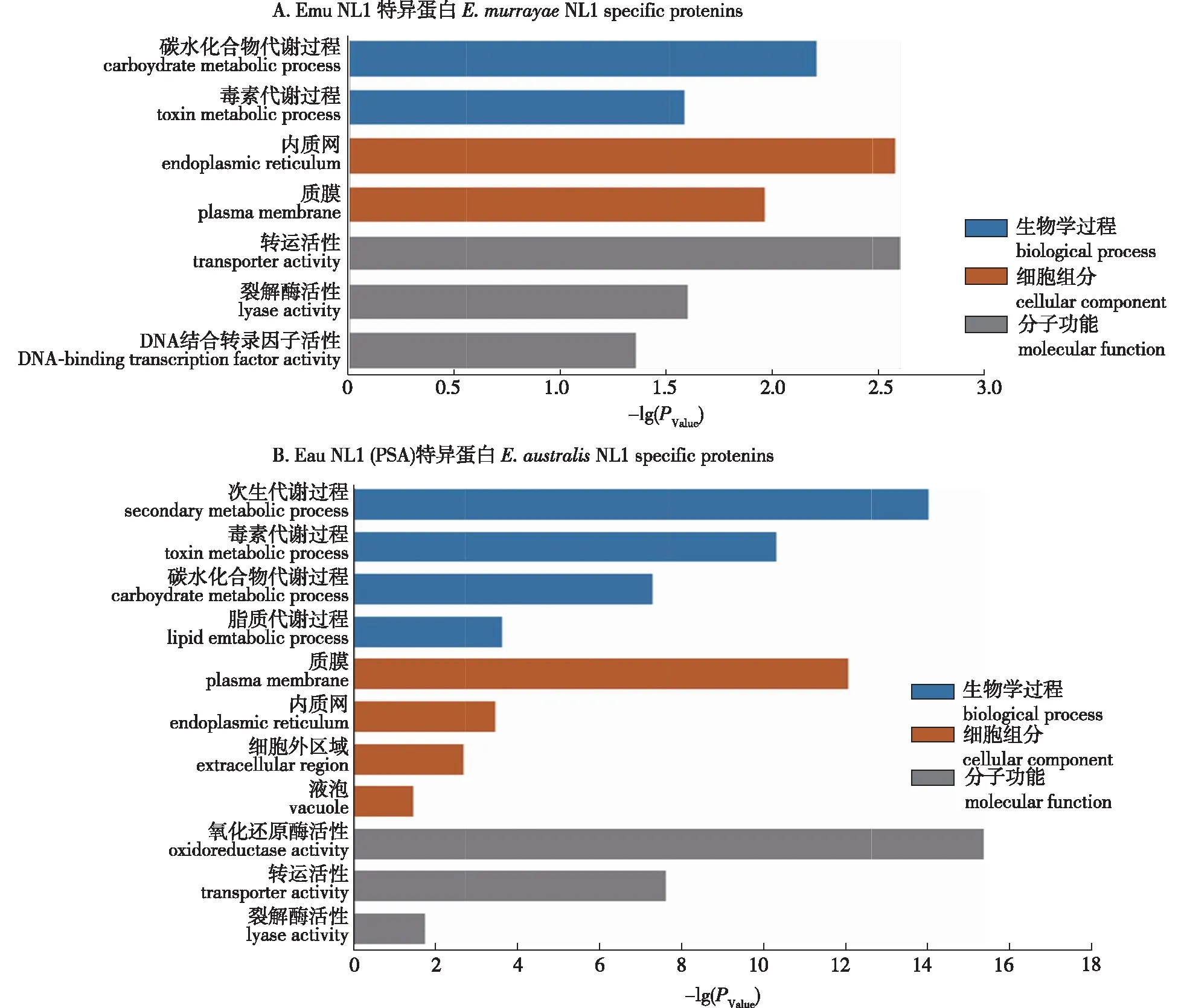
图3 Emu NL1和Eau NL1 (PSA)之间差异蛋白的GO富集分析
在病原微生物和寄主的协同进化中,寄主进化出抗性蛋白(R蛋白)识别病原微生物的效应因子(无毒蛋白),启动超敏应答,以此限制病原微生物的增殖。笔者前期实验显示Emu NL1可在毛白杨上迅速诱导类似超敏反应的细胞死亡[7],进一步分析Emu NL1所编码的差异蛋白发现,其中有42个蛋白是小分泌蛋白(候选效应因子),这个蛋白集合可能包含被毛白杨识别效应因子(表3),可为将来无毒基因的筛选提供线索。
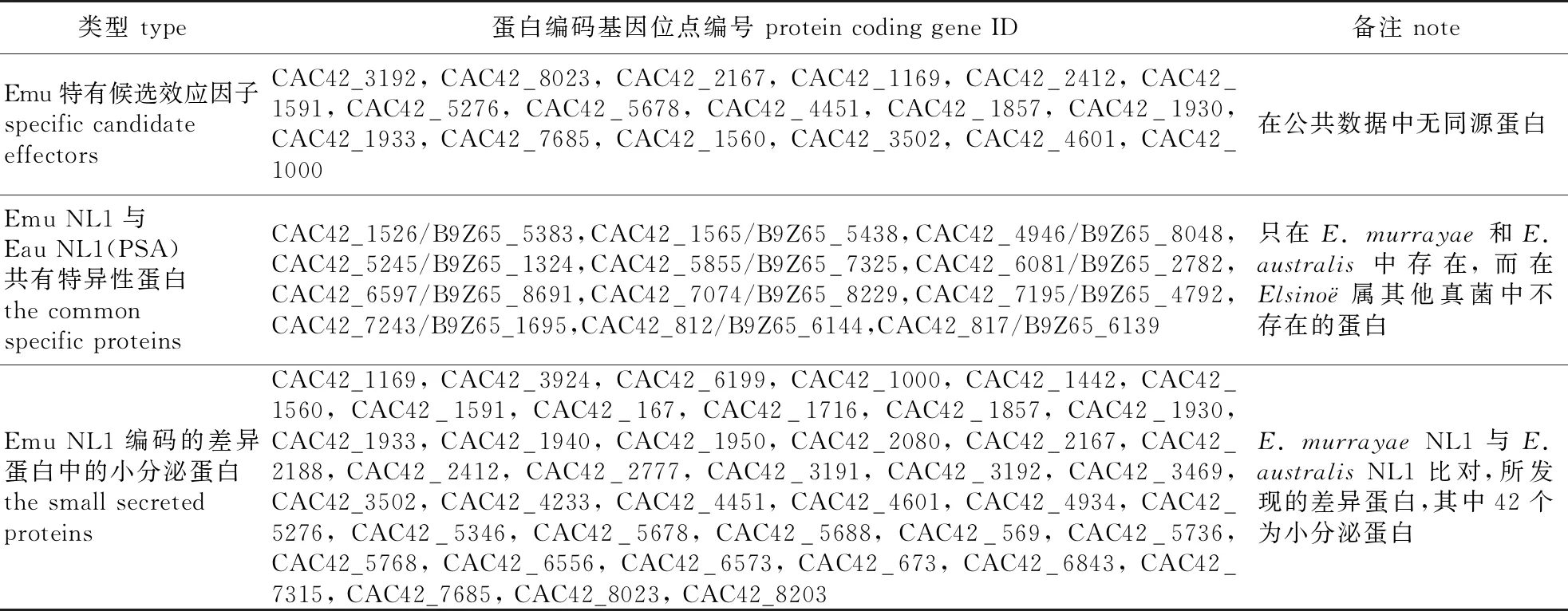
表3 Emu致病相关蛋白
前期研究已经揭示了Eau NL1 (PSA)致病型交配系统,并且绘制两种交配类型(mating type, MAT)位点的完整结构。Eau NL1 (PSA) 的MAT位点两侧是保守的AP核酸内切酶2(AP endonuclease, APN2)基因和Phox同源结构域蛋白(Phox homology domain protein, Px)基因,MAT1-1位点携带典型的α盒(α-box)蛋白基因MAT1-1-1和假定蛋白基因HP1,MAT1-2位点携带典型的高迁移(high mobility group, HMG)蛋白基因MAT1-2-1和另一个假定蛋白基因HP2[8]。
使用Eau NL1 (PSA)的MAT位点基因在Emu NL1基因组中BLAST比对,只发现了同源的MAT1-2-1基因[基因位点编号(下同)为CAC42_7534],两者所编码蛋白的一致性为46%。 CAC42_7534一侧的基因(CAC42_7533)编码APN2蛋白,另一侧基因(CAC42_7535)编码一个假定蛋白,然而这个假定蛋白与Eau NL1 (PSA)的HP2没有明显相似性。CAC42_7535的另一侧即为Px蛋白基因。因此Emu NL1菌株携带MAT1-2位点(图4A)。根据CAC42_7534序列设计引物,使用实验室现有的6个Emu菌株(NL1—NL6)的DNA进行扩增,均获得了目标大小的扩增产物(图4B),因此这6个菌株均属于MAT1-2交配类型。

灰色矩形代表基因外显子,黑色箭头代表转录方向,红色箭头代表MAT1-2检测引物。Solid boxes represent the coding regions of the predicted genes interrupted by introns. Black arrows indicate the orientations of the coding sequences. Red arrows indicate MAT-specific primers。M.marker;2~7泳道为6个E. murrayae分离株lanes; 2-7. six E. murrayae isolates。
3 讨 论
3.1 杨树和柳树的两个痂囊腔菌的寄主适应性
痂囊腔属真菌具有高水平的寄主特异性。Fan等[27]对73种痂囊腔菌的调查分析发现其中69种仅发生于单一的寄主的种或属。痂囊腔菌的致病分子机制研究仅见于痂囊腔菌素,包括其合成基因簇和调控方式,然而这种真菌次生代谢物可以对大部分植物造成毒害,不具备寄主选择性[23]。E.ampelina、E.fawcettii和E.australis是葡萄、柑橘和甜橙最为严重的病害之一,主要侵染寄主果实,降低果实的产量和质量。目前这3个痂囊腔菌的多个菌株的基因组测序已经完成,揭示了大量的碳水化合物活性酶基因、候选效应因子基因和次生代谢物合成基因簇,但这些研究尚未涉及寄主的适应性研究[8,24-26]。
笔者最近在杨属和柳属植物的叶斑中分离鉴定了两种痂囊腔菌,分别是甜橙痂囊腔菌杨树致病型和柳树痂囊腔菌。对Emu NL1菌株进行基因组测序,通过系统发生分析和共线性分析发现,在已测序的痂囊腔菌中,Emu NL1和Eau NL1 (PSA)具有最为接近的系统进化关系、最多的共线性基因和最高的核苷酸一致性。杨树和柳树同属于杨柳科,是典型的近缘树种,Eau NL1 (PSA)侵染杨树,目前尚未发现其侵染柳树的证据,而Emu NL1则侵染柳树,在毛白杨上诱导类似超敏反应的应答,这两种真菌之间也具有高度的近缘关系,因此可以作为分析痂囊腔菌属真菌寄主专化性或适应性的研究对象。
本研究通过Eau NL1 (PSA)和Emu NL1比较基因组分析,发现了两者之间有12个共有蛋白在其他痂囊腔菌中缺失,因此这12个蛋白可能与特异性侵染杨柳科植物相关。另外本研究筛选了Eau NL1 (PSA)和Emu NL1之间的差异基因,发现这些差异基因的编码蛋白集中于碳水化合物代谢和毒素代谢的生物学过程,这表明两种真菌在降解寄主细胞壁、获取营养和产生具有毒性的次生代谢物方面等存在差异,这可能是两种真菌分别适应杨树和柳树寄主的原因。本研究在Emu NL1中还筛选出不存在于Eau NL1 (PSA)的42个小分泌蛋白(候选效应因子),这些蛋白可能包含毛白杨识别对象(无毒蛋白),其能诱导之前观察到的超敏反应。
3.2 痂囊腔菌的交配类型
病原真菌通过有性繁殖创造新的遗传组合,提高后代对寄主和环境的适应性[28],因此具有有性繁殖能力的异宗配合真菌具有更高的进化潜力,其病害防治具有更大的挑战性。大部分子囊菌的有性繁殖受单一位点控制,即交配类型(MAT)位点。异宗配合真菌的菌株要么携带MAT1-1位点,要么携带MAT1-2位点;而同宗配合真菌的菌株往往同时携带MAT1-1和MAT1-2位点[29]。本研究中的测序菌株Emu NL1携带单一的MAT1-2位点,并且没有在基因组上发现MAT1-1-1基因的痕迹,因此Emu很可能具有异宗配合的交配系统,然而基于MAT1-2-1基因的特异性PCR扩增发现,现有的6个菌株的交配类型均为MAT1-2。考虑到痂囊腔菌无性孢子通过水溅传播[30],而这6个菌株分离于距离接近的叶片,需要进一步扩大样品采集的范围来验证Emu是否具有异宗配合的交配系统。
4 结 论
目前已经有多种柳树完成了基因组测序,然而目前还未见柳树病原真菌的全基因组测序报道,这制约了柳树-病原真菌的相互作用研究。本研究针对柳树疮痂叶斑病菌-柳树痂囊腔菌进行了全基因组测序,预测了致病相关的蛋白编码基因,证实了柳树痂囊腔菌和甜橙痂囊腔菌杨树致病型具有接近的进化关系,筛选出这2个病原真菌中参与寄主适应性的候选基因,分析了柳树痂囊腔菌的交配类型。本研究所提供的柳树痂囊腔菌基因组信息以及比较基因组的结果对于柳树病害防治和柳树-病原真菌相互作用研究具有重要参考价值。
