血清IL-1Ra、IL-2、IL-10及TNF-α在活动性结核病判定中的应用研究*
2022-11-29胡艳霞杨宇梁坚傅庆荣吕艳丽叶金钟
胡艳霞 杨宇 梁坚 傅庆荣 吕艳丽 叶金钟
(佛山市第三人民医院监管病区,广东 佛山 528000)
我国是全球结核病流行大国,也是全球耐多药结核病流行严重国。随着近年来我国的严格管控、防治,结核病患病率、死亡率得到了有效控制,但结核感染率仍居高不下,结核病防治依然是我国传染性疾病防治工作的重点内容[1]。临床认为结核病的发生与免疫反应密切相关,免疫反应在感染过程中发挥着主导作用,而在结核病免疫应答过程中有多种细胞因子的参与,结核病也被认为是一种免疫紊乱性疾病。虽然γ干扰素释放试验分析技术(IGRA)用于结核病诊断有较高的灵敏度与特异度,但该技术操作复杂且费用昂贵,并且对潜伏结核感染与活动性结核难以区分[2]。相关研究认为血液中部分细胞因子生物标志物对结核病诊断有潜在价值,但该方法尚未在不同人群中得到验证。近期有研究指出[3],分枝杆菌抗原刺激的细胞因子反应可能为潜在结核感染与活动性结核的区分提供思路。有文献显示[4],结核感染与未感染者的白细胞介素-1受体拮抗剂(IL-1Ra)、白细胞介素-2(IL-2)、白细胞介素-10(IL-10)及肿瘤坏死因子-α(TNF-α)等细胞因子应答差异显著。为明确血清IL-1Ra、IL-2、IL-10、TNF-α与活动性结核、潜伏结核感染的关系,为找寻一组能够区分活动性结核病与潜伏结核感染的生物标志物,本文开展了如下回顾性 研究。
1 对象与方法
1.1 一般资料
纳入本院2020年5月至2021年12月 收治的活 动性结核病患者(TB组)、结核潜伏感染患者(LTBI组)及同期进行健康体检的健康志愿者(HC组),各30例。
纳入标准:(1)TB组患者为初期诊断为结核病,患者有结核病临床症状体征,并经结核分枝杆菌病原学、病理性、影像学等检查确认有活动性结核证据,尚未接受任何抗结核治疗;(2)LTBI组患者的IGRA检测结果为阳性,但无结核病临床症状体征,细菌学、影像学检查均未见活动性结核证据;(3)HC组IGRA检测阴性,无临床症状,影像学检查结果正常,且无陈旧性结核病病灶;(4)年龄≥18岁。
排除标准:(1)合并肝肾功能障碍、恶性肿瘤、免疫系统疾病者;(2)合并乙肝、人类免疫缺陷病毒(HIV)等病毒感染者;(3)处于妊娠期或哺乳期者。
1.2 方法
(1)资料收集。收集三组患者的病历资料,包括患者的年龄、性别、结核部位、共患病、疾病活动性、血常规、尿常规等信息。
(2)标本采集与检验。采集研究对象的晨起空腹静脉血5 mL,使用高速离心机以3000 r/min的速度离心15 min,保留血清于-20℃的冰箱中待检。仪器选用日立7600 i型全自动生化分析仪,采用酶联免疫吸附法测定血清IL-1Ra、IL-2、IL-10、TNF-α水平。
1.3 观察指标
(1)比较三组的血清IL-1Ra、IL-2、IL-10、TNF-α水平;(2)分析血清IL-1Ra、IL-2、IL-10、TNF-α对活动性结核与潜伏结核感染的鉴别诊断效能;(3)建立多元线性回归模型,分析血清IL-1Ra、IL-2、IL-10、TNF-α联用对活动性结核的诊断效能。
1.4 统计学方法
采用SPSS 25.0处理数据。计数资料以[n(%)]表示,采用χ2检验;计量资料以(±s)表示,采用方差分析或t检验。绘制受试者工作特征(ROC)曲线,并建立Logistic线性回归方程,分析各细胞因子单用及联用对活动性结核的诊断效能。以P<0.05为差异有统计学意义。
2 结果
2.1 三组一般资料比较
三组患者的性别、年龄、卡介苗接种史、感染部位比较,差异均无统计学意义(P>0.05),见表1。
表1 三组患者一般资料比较[n(%),±s]
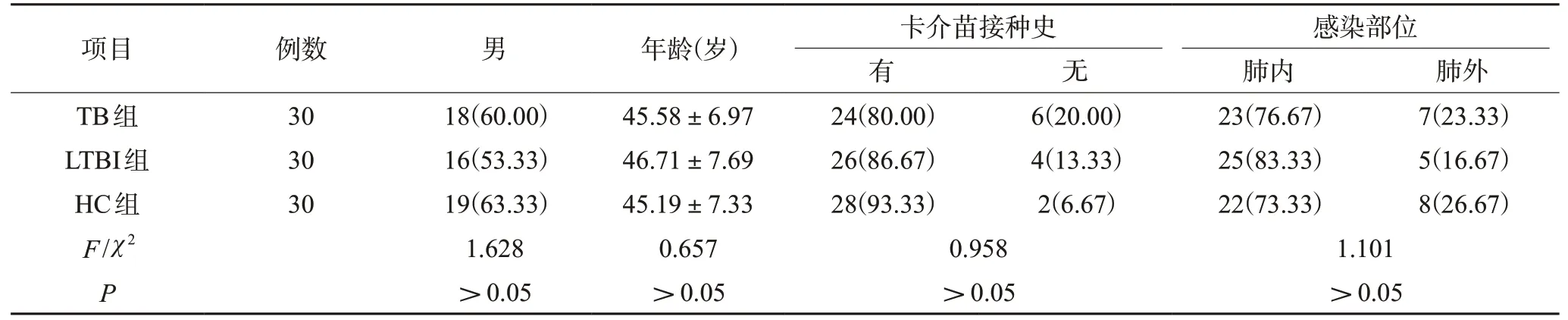
表1 三组患者一般资料比较[n(%),±s]
项目 例数 男 年龄(岁)卡介苗接种史感染部位有无肺内 肺外TB组 30 18(60.00) 45.58±6.97 24(80.00) 6(20.00) 23(76.67) 7(23.33)LTBI组 30 16(53.33) 46.71±7.69 26(86.67) 4(13.33) 25(83.33) 5(16.67)HC组 30 19(63.33) 45.19±7.33 28(93.33) 2(6.67) 22(73.33) 8(26.67)F/χ2 1.628 0.657 0.958 1.101 P>0.05 >0.05 >0.05 >0.05
2.2 三组血清细胞因子水平比较
三组的血清 IL-1Ra、IL-2、IL-10、TNF-α水平比较,差异均有统计学意义(P<0.05)。与HC组相比,TB组和LTBI组的血清IL-1Ra、IL-2、IL-10、TNF-α均明显更高(P<0.05)。TB组与LTBI组相比,LTBI组的血清IL-1Ra、IL-2水平更高,IL-10、TNF-α水平更低,差异均有统计学意义(P<0.05),见表2。
表2 三组研究对象的血清细胞因子水平比较(±s)
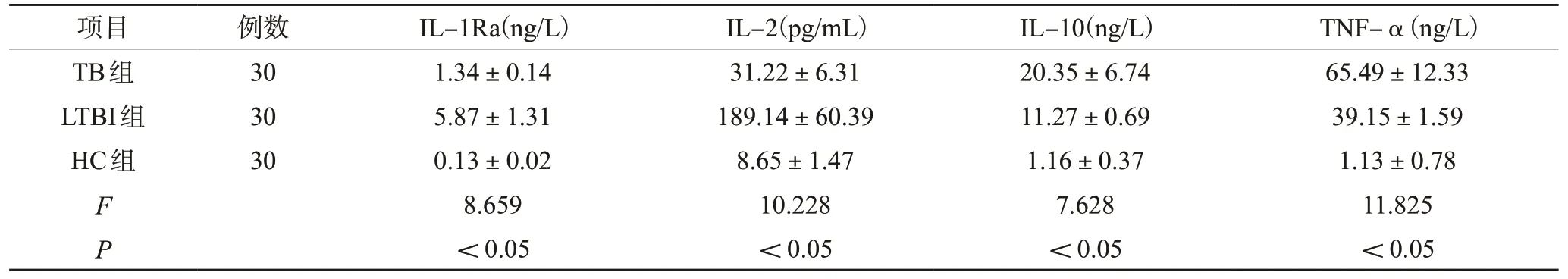
表2 三组研究对象的血清细胞因子水平比较(±s)
项目 例数 IL-1Ra(ng/L) IL-2(pg/mL) IL-10(ng/L) TNF-α(ng/L)TB组 30 1.34±0.14 31.22±6.31 20.35±6.74 65.49±12.33 LTBI组 30 5.87±1.31 189.14±60.39 11.27±0.69 39.15±1.59 HC组 30 0.13±0.02 8.65±1.47 1.16±0.37 1.13±0.78 F 8.659 10.228 7.628 11.825 P<0.05 <0.05 <0.05 <0.05
2.3 各血清细胞因子对活动性结核的预测价值
绘制各血清细胞因子预测活动性结核的ROC曲线(图1),各细胞因子预测活动性结核的曲线下面积(AUC)均>0.7,均有一定的诊断效能。AUC值显示:IL-1Ra最高(0.825),其次为IL-2(0.817),IL-10和TNF-α的AUC值分别为0.762和0.709。IL-1Ra的特异性最高(95.24%),IL-10和TNF-α的灵敏性相对更高,均为77.78%,见表3。

表3 各血清细胞因子预测活动性结核的ROC曲线参数
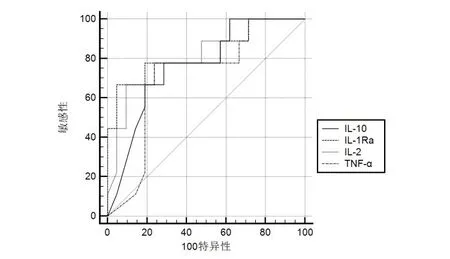
图1 IL-1Ra、IL-2、IL-10、TNF-α单用预测活动性结核的ROC曲线
2.4 血清细胞因子联合对活动性结核的预测价值
利用四项细胞因子构建多元线性回归模型,Y=0.6 05X1+0.492χ2+0.324X3+0.301X4,X1为IL-1Ra、χ2为IL-2、X3为IL-10、X4为TNF-α。绘制该模型预测活动性结核的ROC曲线图(图2),AUC值为0.831,95%CI为0.650~0.942(P<0.001),Youden指数为0.571,敏感性、特异性分别为80.67%和90.48%。

图2 多元线性模型预测活动性结核的ROC曲线
3 讨论
近年来,耐药结核病的流行使得结核菌病的疫情呈现出了较为严重的复发趋势,临床急需找寻一种快速、有效的方法来进行结核感染筛查,最好还能进一步鉴别活动性结核与潜伏性结核感染,从而指导临床对活动性结核患者尽早采取有效的标准抗结核治疗,对潜伏性结核感染患者采取预防性治疗,实现医疗资源的合理分配。
结核菌素皮试试验是临床检测结核分枝杆菌感染的主要手段,但该方法对正常免疫反应人群也可能有高敏感性,虽然监测成本低,但由于结核分枝杆菌纯蛋白衍生物含有的分枝杆菌抗原混合物种类多达200种,其中不仅有结核分枝杆菌抗原,还有其他分枝杆菌抗原,所以该方法对结核分枝杆菌的诊断特异性并不高,有过卡介苗接种史或其他非结核杆菌接触史者都可能出现阳性反应[5]。既往研究证实[6],人体在对抗结核分枝杆菌感染的过程中,细胞介导的免疫反应发挥着关键性作用,故结核杆菌特异性的T细胞抗原及T细胞免疫反应检测成为了结核杆菌诊断的新思路。IL-2、IL-10、IL-4等是与结核免疫相关的细胞因子,有研究认为其具有用于结核病免疫诊断的潜质[7]。有报道指出[8],IL-1Ra等细胞因子在活动性结核与潜伏结核感染中存在着表达差异,这种表达差异可为临床区分活动性结核与潜伏结核感染的依据。
本研究通过对比分析发现,相比非结核感染者,不论是活动性结核还是潜伏结核感染患者,其血清IL-1Ra、IL-2、IL-10、TNF-α均明显更高。这一结果与郎清等[9]报道结论相符,这表明多种结核病相关炎症标志物可为结核病诊断提供依据。IL-2为辅助性细胞形成免疫调节因子,其生物学作用多样,在免疫细胞增殖与应答调节过程中发挥着关键性作用[10]。本研究通过对比发现,IL-2在活动性结核患者血清中的浓度低于潜伏结核感染患者。这可能是因为相比潜伏结核感染,活动性结核患者的细胞免疫功能受损更为严重。IL-2最重要的作用是诱导抑制T细胞增殖、分化,T细胞受到结核杆菌抗原刺激导致IL-2无法形成,并且IL-2作用于T细胞还会诱导其自身的增长、分化,进而降低免疫机能,抑制IL-2合成。另一方面,活动性结核患者单核细胞分泌的前列腺素E2等活性物质能够活化T抑制细胞亚群,抑制IL-2分泌[11]。IL-1可诱导成形其他细胞因子来参与正常T细胞的表达,IL-1Ra可对IL-1与IL-1R结合过程产生竞争性抑制作用,通常由巨噬细胞、单核细胞、中性粒细胞分泌形成,其能结合同Ⅰ型IL-1R对IL-1 β产生抑制作用。本研究显示活动性结核患者的血清IL-1Ra水平低于潜伏结合感染患者,这与相关报道相符[12]。这表明机体感染结核杆菌病进入活动期后,单核细胞平衡炎症因子免疫应答能力减弱,抗炎症细胞因子释放IL-1Ra的过程受到抑制,从而导致了IL-1Ra水平的降低。
IL-10为典型的抗炎因子,其能对炎症因子合成过程加以抑制,发挥免疫抑制作用。有报道显示[13],活动性肺结核患者的血清IL-10水平显著升高,而患者在得到有效治疗后IL-10水平会显著下降。本研究也显示活动性结核患者的血清IL-10水平高于潜伏结核感染者,这与前述报道相符。这是因为IL-10作为抑炎因子,其过度表达可引起免疫抑制,降低机体对结核杆菌的清除能力,从而是潜伏结核感染发展为活动性结核。
TNF-α为重要的机体炎症反应免疫应答调节因子,其水平过高可使机体相关组织发生干酪样改变,引起发热、盗汗、恶病质等症状而使潜伏结核感染转变为活动性结核。此外,局部肺组织缺氧会刺激肺泡巨噬细胞,引起TNF-α水平升高。结核杆菌入侵后造成局部损伤并释放出的内毒素脂多糖也能活化淋巴细胞和单核巨噬细胞系统而产生大量TNF-α,并释放出多种促炎因子参与肺结核的局部炎症反应及免疫反应。本研究显示活动性结核患者的血清TNF-α水平高于潜伏结核感染患者,这与国内相关报道相符[14]。其作用机制可能与病变刺激巨噬细胞,巨噬细胞被激活后释放大量的TNF-α有关。另有研究指出[15],TNF-α分泌过多会发挥细胞毒性作用,破坏肺组织,不利于肺结核恢复。本研究通过ROC曲线分析证实IL-1Ra、IL-2、IL-10、TNF-α对活动性结核均有一定的预测价值,而四项联合用于预测活动性结核有较高的敏感性和特异性,可为临床早期识别活动性结核提供有效的参考依据。
综上所述,血清IL-1Ra、IL-2、IL-10及TNF-α与活动性肺结核密切相关,联合检测血清IL-1Ra、IL-2、IL-10及TNF-α水平对活动性肺结核的发生有较高的预测价值。但本研究作为样本量偏小的单中心研究,且未对潜伏结核感染患者发生活动性结核的影响因素进行分析,研究结果可能存在一定偏倚,未来还有待更大样本量的多中心研究予以验证。
