C30色谱柱HPLC法分析测定蔬菜中阿维菌素残留量
2022-11-28林洋郁蕉竹许文雅张宏宏王韵刘瀛
林洋,郁蕉竹,许文雅,张宏宏,王韵,刘瀛
沈阳食品药品检验所(沈阳 110136)
阿维菌素类药物(avermectins,AVMs)是由链霉素产生的一组十六元环内酯双糖类化合物,是经过微生物发酵、提取的新型抗生素类杀虫杀螨剂,对螨类和昆虫具有胃毒和触杀作用,是现代农业广泛应用的一种抗寄生虫农药[1-3]。关于阿维菌素的检测方法国内外已有大量报道,张红艳等[4]建立甲醇提取测定黄瓜中阿维菌素残留量。王晓菁等[5]建立酸性乙腈溶液提取来分析枸杞中阿维菌素残留量。此外阿维菌素检测方法还有液质联用法[6-11]、高效液相色谱荧光法[12-14],但液相质谱法运营成本相对较高,而荧光法前处理又较为复杂繁琐,稳定性差。检测阿维菌素残留量大多使用GB 23200.19—2016《食品安全国家标准 水果和蔬菜中阿维菌素残留量的测定 液相色谱法》,采用C18色谱柱进行色谱分离,但此方法对于基质复杂的蔬菜样品的测定杂质干扰问题较为严重,主峰与杂质峰分离效果不理想[15]。在液相色谱检测阿维菌素残留量中采用C30色谱柱进行色谱分离的方法鲜有报道,试验选用乙腈作为提取溶剂替代国标中的丙酮提取,选用C30色谱柱进行色谱分离,通过优化色谱条件,减少蔬菜基质中杂质峰的背景干扰,从而提高方法的准确性和重复性,优化阿维菌素的高效液相色谱检测方法,为同行业蔬菜中阿维菌素残留量的测定提供参考依据。
1 材料与方法
1.1 主要材料与试剂
乙腈(色谱纯,赛默飞世尔科技有限公司);甲醇(色谱纯,赛默飞世尔科技有限公司);氯化钠(分析纯,国药集团化学制药有限公司);阿维菌素标准品(100 mg/L,安谱实验科技股份有限公司);C18固相萃取柱(60 mg,3 mL,安谱实验科技股份有限公司);Athena C30色谱柱(4.6 mm×250 mm,5 μm,安谱实验科技股份有限公司);试验用水均为一级水;菠菜、大白菜、萝卜、马铃薯、豇豆、小白菜(市购)。
1.2 主要仪器与设备
Waters e2695高效液相色谱仪(配2998二极管阵列检测器,美国Waters公司);超声波清洗仪(KQ-250DB,昆山市超声仪器有限公司);德国IKA涡旋混合器;高速冷冻离心机(H1750R,湖南湘仪离心机仪器有限公司);莱伯泰科多通道平行浓缩仪(M64);常熟双杰电子天平(JJ600);Milli-Qreference纯水机(Millipoer SAS公司);移液器(20~200 μL,705878及100~1 000 μL,705880,普兰德公司)。
1.3 试验条件
1.3.1 样品前处理
蔬菜样品采用四分法取样,经粉碎机绞碎后均匀混合,准确称取10.00 g均匀试样于具塞塑料离心管中,加入10 mL乙腈,涡旋振荡,超声提取30 min,加入3~4 g氯化钠,振荡摇匀,按10 000 r/min离心5 min,取上清液于离心管中,用10 mL乙腈重复提取1次,合并提取液。在40 ℃水浴下氮吹近干。加入1 mL甲醇复溶,涡旋溶解,加入3 mL水涡旋混匀待净化。将固相萃取柱依次用5 mL甲醇活化、5 mL水平衡,将上述溶液完全转入C18固相萃取柱,用5 mL水淋洗小柱,弃去全部淋洗液,最后用5 mL甲醇洗脱并抽干,收集洗脱液,用氮气吹至近干。准确加入0.5 mL甲醇溶解残渣,用0.22 μm有机滤膜过滤,滤液供液相色谱测定,外标法定量。
1.3.2 色谱条件
色谱柱C30柱(4.6 mm×250 mm,5 μm);流动相为甲醇-水(85∶15,V/V);流速1.0 mL/min;检测波长245 nm;进样量20 μL;柱温35 ℃;检测器采用二极管阵列检测器。
1.3.3 标准溶液的配制
分别准确移取0.050,0.075,0.100,0.200和0.500 mL质量浓度为100 mg/L的阿维菌素标准溶液于10 mL容量瓶中,加甲醇定容到刻度,轻摇混匀,标准系列工作溶液中阿维菌素的质量浓度分别为0.50,0.75,1.00,2.00和5.00 mg/L。
2 结果与分析
2.1 前处理方法的选择与比较
2.1.1 提取溶剂的选择
已报道的阿维菌素提取溶剂有丙酮[16]、甲醇[17]、乙酸乙酯[18]和乙腈[19-20]溶液等,提取方式包括超声、涡旋、振荡或均质等,试验分别采用丙酮、乙腈、甲醇作为提取剂对样品进行超声提取,发现甲醇和丙酮作为提取剂时基质干扰较多,且样品中水分对下一步净化效果也有影响,因此试验方法采用乙腈提取,并加入氯化钠进行盐析来分离水相有机相,促进目标分析物与有机相融合,该方法有较高提取率同时也减少样品中杂质的提出;且国家标准中使用的丙酮提取剂属易致毒易致爆溶剂,而乙腈毒性和安全性相对丙酮较小。因此通过综合操作安全性简便性、提取效率和净化效果方面,最终选用乙腈作为提取剂。
2.1.2 净化方法的比较
常见净化方法有液-液萃取法、固相萃取小柱净化法等,由于蔬菜样品提取液色泽较深,基质干扰较多,含有大量色素、有机质和盐类,选取最优的分离纯化方法会在最大程度降低样品基质干扰,提高分析方法的准确性和精密度。试验分别测试直提后上样、C18固相萃取净化柱、氨基柱、氧化铝层析柱的净化方法,其中乙腈提取后直接上样基质干扰严重,氧化铝层析柱和氨基柱对基质除杂和回收效果均不理想;试验对比待净化液中甲醇含量对回收效果影响,甲醇含量分别为20%,25%和30%时上样净化的回收率分别为95.2%,97.6%和96.2%,其中用25%甲醇含量的待净化液过净化柱回收率最高。因此该方法采用甲醇含量25%的待净化液过C18固相萃取柱进行净化。
2.2 色谱条件的选择与比较
使用的C18色谱柱大多数都是使用单官能团硅烷化试剂键合形成的单层键合相,也有使用双官能团或三官能团硅烷试剂键合形成的多层键合相,也称为聚合型键合相。C30键合相具有比C18更长的烷基链,有更强的疏水性,在硅胶表面形成致密的多层C30烷基链。由于多层键合相可以形成更为致密的键合层,能更加有效地掩蔽硅胶表面的硅羟基,同时具有更强的溶质保留能力和对强极性物质更小的非特异性吸附,对非极性溶质的保留能力和分辨率更高,具有非常好的分离能力。基于多层聚合型键合相的优势和C30烷基链优异的分离效果,试验以甲醇和水为流动相,以加标菠菜样品为基质,对比C18色谱柱和C30色谱柱及不同流动相比例条件下的中阿维菌素与杂质峰的分离效果,见图1~图5。图谱表明,使用C30色谱柱分离菠菜基质中阿维菌素效果明显优于C18色谱柱,其中采用C30色谱柱、甲醇-水(85∶15,V/V)作为流动相时,阿维菌素主峰与杂质峰分离度R>1.5,分离效果最佳,杂质干扰最小。

图1 C18色谱柱、甲醇-水(90∶10,V/V)为流动相分离菠菜基质中阿维菌素色谱图
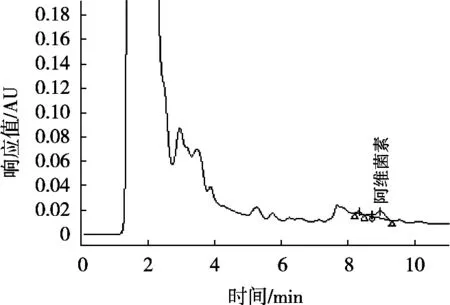
图2 C18色谱柱、甲醇-水(85∶15,V/V)为流动相分离菠菜基质中阿维菌素色谱图
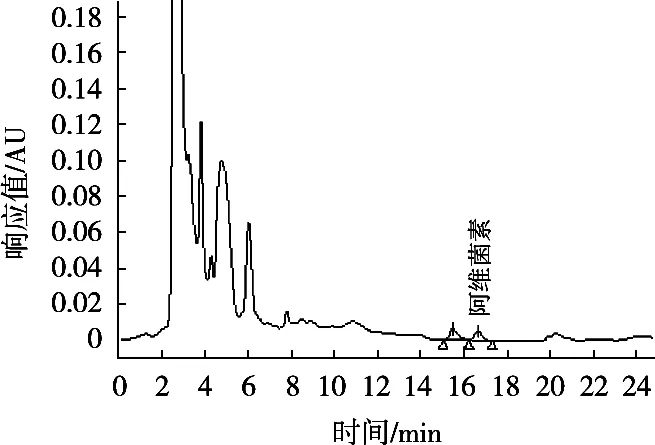
图3 C30色谱柱、甲醇-水(90∶10,V/V)为流动相分离菠菜基质中阿维菌素色谱图
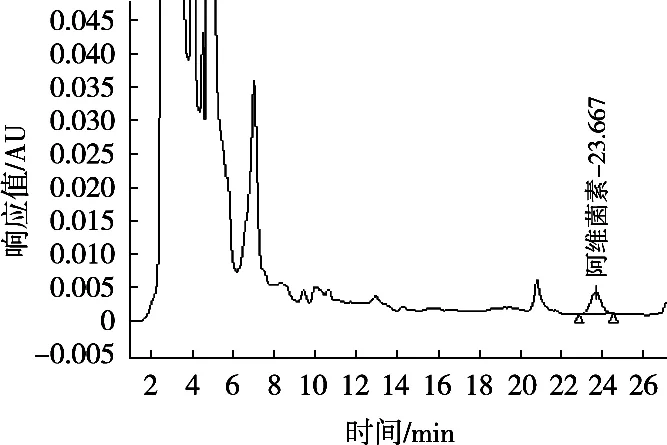
图4 C30色谱柱、甲醇-水(85∶15,V/V)为流动相分离菠菜基质中阿维菌素色谱图
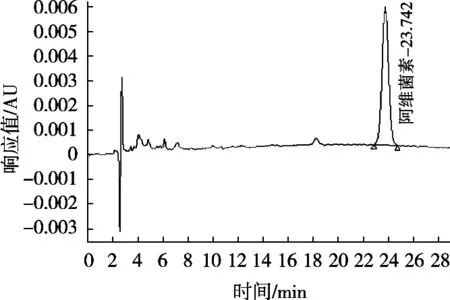
图5 C30色谱柱、甲醇-水(85∶15,V/V)为流动相阿维菌素标准品色谱图
2.3 线性关系和定量限
在上述试验条件下测定0.50,0.75,1.00,2.00和5.00 mg/L系列质量浓度的阿维菌素标准溶液,以峰面积为纵坐标,质量浓度为横坐标绘制线性关系曲线,得到的线性方程为Y=40 800X-355,其中r2值为0.999 8,结果表明在0.50~5.00 mg/L范围内有良好的线性关系。配制适当浓度的阿维菌素标准溶液,在上述条件下平行测定6次,按照rSN=10计算得出方法定量限为0.01 mg/kg,满足食品安全国家标准GB 23200.19—2016要求。
2.4 准确度和精密度
在菠菜样品空白基质中分别添加0.01,0.05和0.10 mg/kg的阿维菌素标准品,按照上述试验条件进行加标回收试验,每个加标水平重复测定6次,外标法定量测得阿维菌素的平均回收率和相对标准偏差(SRSD),结果见表1。阿维菌素的加标平均回收率为93.7%~97.5%,其SRSD值为1.1%~2.2%,满足GB/T 27404—2008《实验室质量控制规范 食品理化检测》要求,且方法具有良好的重复性。
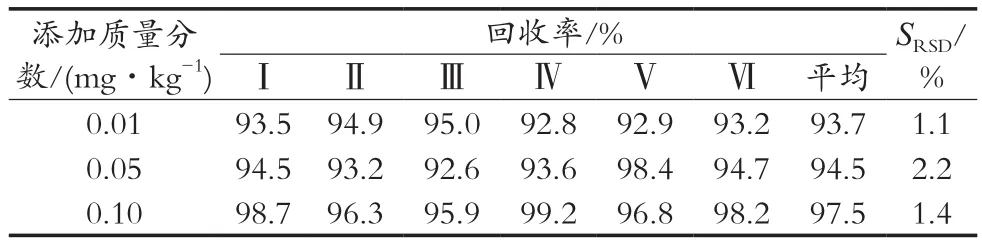
表1 回收率与相对标准偏差(n=6)
2.5 蔬菜样品参考分析
随机选取大白菜、萝卜、马铃薯、豇豆、小白菜5种实际蔬菜样品,在基质中分别添加0.05 mg/kg的阿维菌素标准品,按上述测试条件进行加标回收试验,试验结果见表2。测得5种蔬菜样品中阿维菌素含量的回收率为92.8%~102.4%,SRSD值为1.1%~4.5%(n=6),回收率和精密度均满足试验要求。

表2 实际样品中阿维菌素残留量回收率和精密度试验结果(n=6)
3 结论
建立蔬菜中阿维菌素残留量分析检测的高效液相色谱法,前处理方面采用乙腈进行超声提取,盐析分离,SPE小柱固相进行萃取,减少色素和脂质的吸附,与国家标准中采用丙酮提取前处理方法相比,毒性小、操作简便快捷、基质干扰影响小;仪器测定方面采用二极管阵列检测器,普及率高,结果定量准确,试验方法选用C30色谱柱进行色谱分离纯化,由于C30键合相具有比C18更长的烷基链,具有更好的分离效果,通过有效调节流动相比例最大限度降低基质干扰峰的影响。试验结果表明在0.50~5.00 mg/L范围内阿维菌素色谱峰面积与质量浓度之间有良好线性关系,准确度高,蔬菜样品中阿维菌素0.05 mg/kg水平加标回收率可达92.8%~102.4%;重复性好,相对标准溶液偏差为1.1%~4.5%(n=6),试验优化标准方法,降低基质干扰,具有较强的可操作性,稳定性好,可有效适用于蔬菜中阿维菌素残留的定量分析,满足日常检测需求,为阿维菌素残留量的快速检测提供参考依据,便于在基层实验室推广使用,为保障果蔬质量安全检测提供技术支撑。
