培养基中添加植物生长调节剂的蛹虫草转录组学分析
2022-11-28王哲王升厚李梦雪柳叶飞王泽徐方旭
王哲,王升厚,李梦雪,柳叶飞,王泽,徐方旭*
1.沈阳师范大学生命科学学院(沈阳 110034);2.沈阳师范大学实验教学中心(沈阳 110034)
蛹虫草(Cordyceps militaris)又称北冬虫夏草、北虫草,2009年被批准为新资源食品[1-4]。蛹虫草富含多种生物活性成分,如虫草素、喷司他丁、腺苷、虫草酸、虫草多糖、超氧化物歧化酶、麦角甾醇及黄酮类物质等[5-9],具有抗肿瘤、免疫调节、抗炎抗菌及抗氧化等药理作用[10-12]。蛹虫草通过人工培育实现规模化生产,但在产业发展中仍存在亟待解决的技术性瓶颈问题,其中之一就是蛹虫草在生长后期常出现“白毛病”,即学术界统称的因感染“吃草菌”引起的真菌性病害,这种寄生性病原真菌会导致蛹虫草产量严重下降[13-16]。
植物生长调节剂是一类与植物激素具有相似生理和生物学效应的物质,其主要成分有水杨酸、茉莉酸、多效唑和多胺。由于植物生长调节剂大多取自植物本身产生的天然产物,具有微量、高效、低毒等作用,同时还可调节作物的生长发育、提高生物转化率、改善品质外,在作物抗病中具有显著功效[17-20]。有研究表明,细胞壁是植物防御病原物侵染的第一道屏障。当病原物物侵染植物后,引起细胞壁的防御反应,参与细胞生命活动的某些信息传递,并发生防御反应,细胞壁在植物抗病过程中起着重要的能动作用[21-22]。除了细胞壁能够抵御病原菌的侵染外,近年来,更多研究表明,一些抗病蛋白需要转移到细胞核内才能启动免疫反应,进而发挥抗病防御作用,而细胞核质转运受体是实现这些抗病蛋白核质转运必不可少的“载体”。因此,细胞核质转运及转运受体在抗病防御中发挥重要作用[23]。何茂华[24]研究表明,植物生长调节剂在诱导棉花抗黄萎病期间,其棉苗体内与抗病相关酶活性和一些次生代谢物质含量的变化与棉苗抗黄萎病性相关。肖翔等[25]研究表明,脱落酸通过拮抗水杨酸抗病信号通路负调控拟南芥对白粉菌的穿透后抗性。因此,了解植物对病原菌的防御机制及病原菌对植物的感染过程和分子机理尤为重要,有利于掌握设计植物的持久抗性所需的必要知识,为改善作物对不良环境的抵御能力提供方案和对策[26]。
关于植物生长调节剂诱导蛹虫草抵抗寄生性病原真菌分子机制的研究鲜见报道。为揭示培养基中添加GN-01的蛹虫草与对照组蛹虫草鲜品的基因表达差异,试验利用RNA-seq技术进行高通量测序和生物信息学分析,对GN-01抵抗蛹虫草寄生性病原真菌的抗病机理在转录组学层面进行探究,为后期开展蛹虫草真菌病害的防控提供理论依据。
1 材料与方法
1.1 材料与试剂
对照组(CK):栽培培养基为小麦40 g和清水60 g培养的蛹虫草。
试验组(DK):栽培培养基中加入稀释3 000倍GN-01培养的蛹虫草。
蛹虫草PT07(沈阳师范大学特种菌业研究所);总RNA提取试剂RNAiso Plus[宝生物工程(大连)有限公司];脱氧核糖核酸酶I(北京凡知医学科技有限公司);NEBNext Ultra RNA文库制备试剂盒(美国NEB公司);Oligo(d T)磁珠(苏州海狸公司);fragmentation buffer(上海恒斐生物科技有限公司);NEBNext Ultra RNA文库制备试剂盒(美国NEB公司)。
1.2 仪器与设备
Illumina HiSeq 4000高通量测序平台系统(上海派诺森生物科技有限公司);Agilent 2100生物分析仪(安捷伦科技有限公司)。
1.3 方法
1.3.1 总RNA提取和转录组测序
称取对照组和试验组蛹虫草样本,各200 mg,每组样品选取3个生物学重复,转录组测序委托上海派诺森生物科技有限公司完成[27]。
1.3.2 差异基因筛选
将表达差异倍数|log2Fold Change|>1和显著性P值<0.05作为筛选差异表达基因条件,满足此筛选标准的基因即为差异表达基因。
1.3.3 差异基因的功能注释和富集
应用基因本体论联合会建立的数据库所建立的数据库GO对所获得差异基因的GO进行分类注释,同时利用京都基因与基因组百科全书(KEGG)数据库对差异基因进行KEGG通路的功能富集分析[17]。
2 结果与分析
2.1 质控数据分析
CK组和DK组蛹虫草转录组测序原始数据读序分别为45 086 267和44 293 419,经过对数据去除杂质及接头序列后,相应的干净读序为42 704 425和41 868 819,其中各组中质量值≥20的碱基所占比例Q20均在97.39%以上,质量值≥30的碱基所占比例Q30均在93.58%以上,表明测序结果理想,可用于后续分析。
2.2 差异基因表达分析
对照组和试验组共有9 618个差异基因,根据P值<0.05和|log2Fold Change|>1筛选显著差异表达基因。从图1可以看出,培养基中添加GN-01后,蛹虫草子实体显著差异基因共189个,其中上调基因83个、下调基因106个。

图1 差异表达基因的火山图
2.3 差异基因的GO富集分析
GO功能分类结果(图2)表明:差异基因在细胞组分这类中,核小体、DNA复合包装、蛋白质-DNA复合体3个条目上富集较显著;在分子功能这类中,蛋白质异源二聚体活动、糖基键的水解酶活性2个条目上富集较显著;在生物过程这类中,碳水化合物分解代谢过程和跨膜转运2个条目富集较显著。
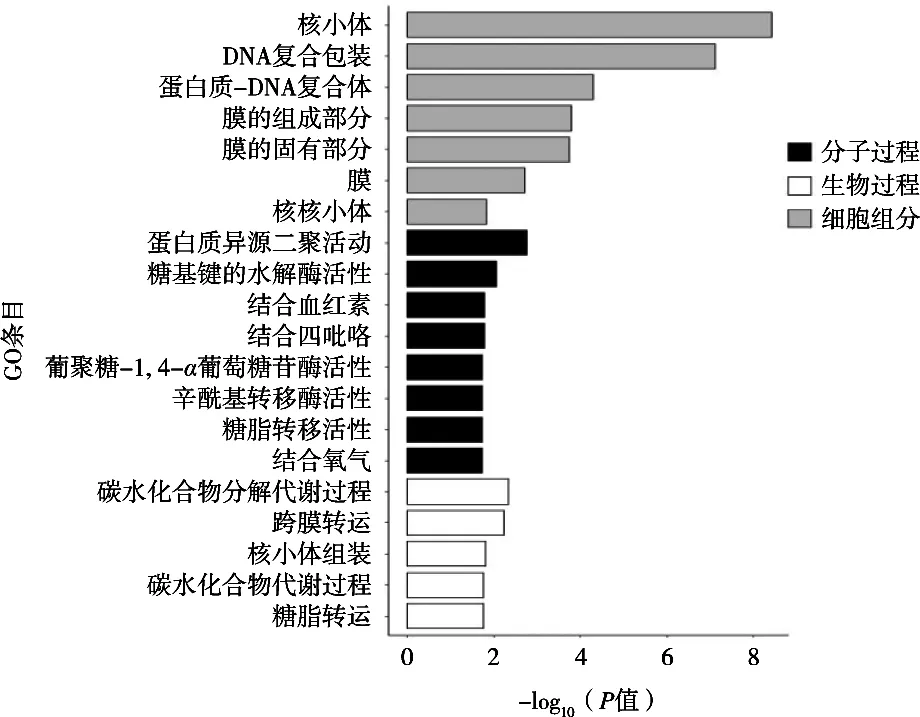
图2 GO功能注释
2.4 差异基因的KEGG富集分析
从图3可以看出:189个差异基因共富集到29条通路,其中,显著富集到糖鞘脂生物合成-globo和isglobo系列、淀粉和蔗糖代谢、酮体的合成与降解、糖胺聚糖降解、生物素代谢这5条通路,说明蛹虫草子实体中的差异表达基因在这5条通路上受GN-01的影响较大。

图3 KEGG功能富集图
2.5 关键KEGG通路与差异表达基因解析
栽培培养基中添加GN-01后蛹虫草子实体中关键KEGG通路与差异表达基因详见表1。其中:与次生代谢产物生物合成有关的基因为MGAM,FabG和GALM;P4HA主要参与精氨酸和脯氨酸的代谢;GSTK1主要参与植物过氧化物酶体路径。由此可见,在蛹虫草栽培培养基中添加GN-01,可有效激活次生代谢产物合成通路、脯氨酸代谢途径和过氧化物酶体途径,从而提高蛹虫草在生长过程中的抗病能力。
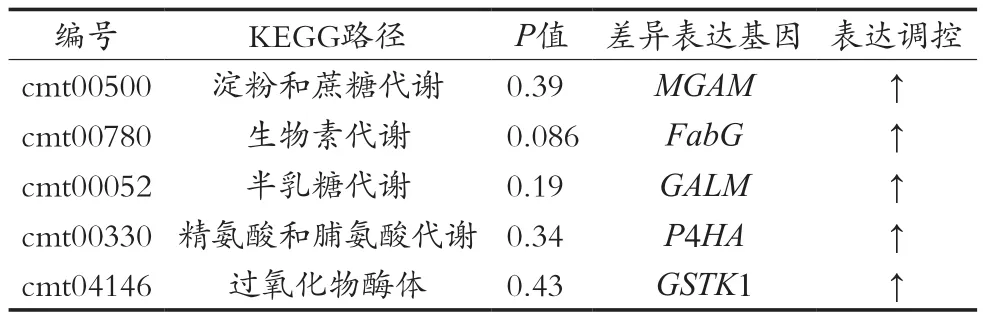
表1 关键KEGG通路与差异表达基因
3 讨论与结论
植物生长调节剂是人工合成或提取的具有天然植物激素生理活性的化合物,可用于调节或控制植物生长发育的某些过程。研究表明,植物生长调节剂通常可在植物体内传导至作用部位,以很低的浓度促进植物生长和繁殖,其特点为效用高、用量小、毒性低,在全球农业生产中被广泛应用,达到稳产增产、改善品质、缩短生长周期、延长保鲜期等作用[28-29]。试验结果表明,在栽培培养基中添加GN-01后,蛹虫草子实体中显著差异基因189个,共富集到代谢通路29条。其中,差异基因MGAM,FabG和GALM主要参与次生代谢产物的生物合成,试验发现,次生代谢产物广泛参与植物生长、发育、防御等生理过程,可作为生化壁垒抵抗病原物的侵染过程,还可作为信号物质参与植物的抗病反应,在植物的抗病防御反应中发挥重要的作用[30]。差异基因P4HA主要参与精氨酸和脯氨酸的代谢,高水平的脯氨酸可通过维持细胞膜的完整性和增强抗氧化能力以提高植物的抗病能力。GSTK1主要参与植物过氧化物酶体路径,过氧化物酶体的功能是可以使毒性物质失活,这种作用是过氧化氢酶利用过氧化氢氧化各种底物,如酚、甲酸、甲醛和乙醇等,氧化的结果使这些有毒性的物质变成无毒性的物质,从而提高植物的抗病性。由此可见,在蛹虫草栽培培养基中添加GN-01,可有效激活次生代谢产物合成通路、脯氨酸代谢途径和过氧化物酶体途径,从而提高蛹虫草在生长过程中的抗病能力。
