外泌体miRNA在骨质疏松中的调控作用及中医药干预研究
2022-11-27孟菲菲杨长伟高志礼王花欣
孟菲菲 杨长伟 高志礼 王花欣*
1.山东中医药大学,山东 济南 250355 2.山东省中医经典名方协同创新中心,山东 济南 250355 3.华东交通大学,江西 南昌 330013
骨质疏松症(osteoporosis,OP)是一种全身代谢性骨病,其特征为骨量降低、骨组织微结构被破坏。近年来,中医药疗法被广泛应用于OP的防治,大量研究开始从不同角度探究其分子机制。外泌体作为新近研究热点,在细胞与细胞之间信息传递中发挥着不可取代的作用。miRNA作为外泌体的重要活性成分,可经由外泌体转运至受体细胞,调控靶基因表达,参与骨重建过程。
1 外泌体miRNA与骨质疏松
外泌体是具有双层脂质膜结构的一种囊泡小体,其直径为40~160 nm,主要由蛋白质、RNA和脂质等生物大分子组成,在细胞间的信息传递过程中发挥着重要作用[1]。外泌体最初是由内吞作用形成,是从多种类型的细胞中,通过旁分泌释放到细胞外的囊泡。人体各种具有活性的细胞在生理或者病理的条件下几乎都可以产生外泌体,广泛分布在各种体液,如血液、唾液、尿液和母乳中。miRNA是一类微小的内源性非编码RNA,由19~25个核苷酸组成,作为外泌体的一种功能性成分,可通过结合靶基因mRNA的 3’ UTR区,影响靶基因的转录后表达,调控受体细胞的生命活动。
OP是一类以骨量减少,骨骼结构塌陷及易骨折为主要特征的代谢性疾病,在50岁以上人群中发病率约为30 %。临床上制定了以DXA测量BMD的诊断方法,即T值低于同种族、同性别正常青年人的2.5个标准差[2]。OP的发病机制在于成骨细胞介导的骨形成和破骨细胞介导的骨吸收之间的动态平衡即骨重建平衡被打破。外泌体miRNA可通过多种途径直接或间接作用于骨重建过程,影响着OP的发生发展。见图1。
2 外泌体miRNA参与骨形成过程
骨形成是骨重建的重要环节,涵盖了骨髓间充质干细胞(BMSCs)分化为成骨细胞,成骨细胞分泌胶原纤维及骨基质矿化的过程[3]。外泌体miRNA可通过调控骨形成相关因子的表达,调节成骨细胞的分化及功能,干预骨重建进程[4]。
骨形态蛋白2(BMP-2)是间充质干细胞(MSCs)分化为成骨主要因素,通过与靶细胞上的酶受体结合,调节下游Smad信号通路,最终激活成骨基因,从而促进新骨形成[5]。研究[6-7]发现,BMSCs来源的外泌体(BMSCs-EXOs)miR-153与miR-214可以通过直接靶向BMP-2抑制成骨细胞增殖分化,参与调控骨形成。Runt相关转录因子2(Runx2)作为骨骼发育的重要转录因子,通过激活多个信号通路调节成骨细胞介导的骨形成过程[8]。研究[9-11]发现,BMSCs-EXOs miR-150-3p、miR-1275及miR-21可通过上调Runx2的表达来提高成骨细胞的分化,促进骨形成。而miR-30a、miR-23a、miR-189和miR-106则通过抑制Runx2的表达来降低成骨细胞分化,抑制骨形成[12-14]。此外,BMSCs-EXOs miR-122-5p和miR-182-5p分别通过下调靶基因SPRY2和腺苷酸环化酶6(ADCY6)的表达,激活MAPK信号通路,促进MSCs的增殖,诱导成骨细胞分化[15-16]。而miR-144通过下调分泌型卷曲相关蛋白 1(Sfrp1),激活Wnt信号通路,减少细胞的凋亡,促进新骨生成[17]。
MSCs成骨和脂肪分化之间的平衡对于维持骨稳态非常重要,在减少骨量丢失方面,可以通过抑制成脂分化来促进骨形成及成骨分化,从而增加骨量来实现。研究[18]发现,miR-424在脂肪组织来源的间充质干细胞(hAD-MSCs)成脂诱导过程中的表达量下调,进一步的研究表明其可通过调节蛋白EID-1和转录因子PPARγ的表达量,有效抑制hAD-MSCs的脂肪分化,促进骨形成。
3 外泌体miRNA参与骨吸收过程
骨吸收主要由巨噬细胞衍生的破骨细胞介导,通过分泌多种酶,使周围骨组织溶解。随后,成骨细胞迁移到这个部位进一步骨形成,维持骨稳态。核因子-κB配体受体激活剂(RANKL)是破骨细胞分化的重要启动因子,通过刺激活化T细胞胞核因子(NFATc1)转录因子的表达,促进巨噬细胞向破骨细胞分化[19]。
研究[19-20]发现,miR-124与miR-506-3p可通过调节转录因子NFATc1的表达来调节破骨细胞生成,但作用相反。miR-124可通过抑制NFATc1的表达,负向调控破骨细胞分化,减少骨吸收;而miR-506-3P则通过促进NFATc1的表达,导致各种骨吸收酶的下游分泌,正向调控破骨细胞分化,加速骨吸收,进而致使骨量丢失。
证据表明,miR-31是骨髓来源的巨噬细胞(BMMs)向破骨诱导分化的过程中表达最为上调的miRNA之一[21-22];而在此过程中miR-503-3p和miR-218的表达水平降低[23-24]。随后的研究发现,miR-503-3p通过下调靶基因肝素酶基因(Hpse)的表达来达到抑制破骨细胞分化的目的,而miR-218通过抑制TNFR1的表达,减少破骨细胞生成,从而抑制骨吸收。此外,miR-21既可通过增加骨保护素(OPG)水平来促进新骨形成,也可以通过靶向PTEN激活PI3K/Akt信号通路来促进破骨细胞生成和骨吸收[21-22]。

图1 外泌体的形成及其在骨重建中的作用Fig.1 Formation of exosomes and their role in bone reconstruction
4 外泌体miRNA与血管生成
血管的生成对促进骨形成,维持骨稳态具有重大意义。在骨骼发育以及骨折愈合这一过程,血管的生成和骨的形成是耦合的,由骨细胞分泌的血管内皮生长因子(VEGF)是骨生成和血管生成耦合的重要调节因子[25]。
研究[26-27]发现,BMSCs-EXOs miR-214-3p和miR-195都能够参与调控VEGF的表达,从而影响血管的生成。不同的是,miR-214-3p通过降低VEGF的表达,释放负调节血管生成信号,抑制血管生成;miR-195的高表达能够降低MSCs对血管生成的旁分泌效应以及VEGF的表达水平,对血管生成具有负调节作用。
此外,有证据证明,miR-29a、miR-672、miR-126及miR-136-3p对血管生成具有积极作用[28-31]。miR-29a能够有效的促进小鼠血管的生成和成骨,miR-672在BMP-2诱导的血管生成过程中显著上调,而miR-126和miR-136-3p则能够通过触发人脐静脉内皮细胞(HUVEC)产生信号应答,从而促进血管生成加速骨形成过程,为OP提供新的治疗靶点。
5 外泌体miRNA与骨免疫学
骨免疫学是研究骨骼与免疫系统之间相互调控的交叉学科,其研究内容包含了骨骼与免疫两系统之间密切且复杂的相互作用机制。越来越多的研究[32]证明,外泌体miRNA可通过调控骨免疫相关的细胞因子,维持骨平衡稳态,控制骨骼系统和免疫系统之间的通讯。
IL-6促进破骨细胞生成以及提高其活性,是通过调节破骨细胞祖细胞分化实现的[33]。研究[34-37]发现miR-495、miR-200c、miR-146a、miR-27a等可通过抑制IL-6的表达,促进新骨形成。
TNF-α作为抑制成骨细胞增殖分化的促炎症因子,可降低其活性,并且能够加速成骨细胞的凋亡[38]。研究[39-45]表明,miR-21、miR-183、miR-181、miR-335-3p、miR-203、miR-145、miR-107等通过调控TNF-α表达,抑制RANKL诱导的破骨生成,减少细胞凋亡,促进骨形成。
M-CSF作为破骨细胞的调节剂,能够诱导破骨细胞分化。而miR-146a、miR-21、miR-143-3p等通过减少骨微环境中M-CSF的水平,抑制破骨细胞分化,从而减少骨量丢失[46-48]。
6 中医药调节外泌体miRNA作用于骨质疏松
中国传统医学将OP归属于“骨痿”“骨枯”和“骨极”等范畴。《医经精义》曰:“肾藏精,精生髓,髓生骨,故骨者肾之所合也。髓者肾精所生,精足则髓充,髓充者则骨强。”书中认为骨髓的充盈可以决定骨骼的生长与发育,肾精充足,则骨髓化生泉源不竭。若肾精亏损,骨髓不能正常化生,逐渐枯竭,就会出现腰膝酸软、步履不稳等骨痿病的症状。因此,中医学认为肾精亏损为该病的主要致病因素,肾虚为该病的主要发病机制。《内经》提出了其治疗原则:“骨痿者补肾以治之”。而多种补肾壮骨的中药单体、复方制剂及针灸已用于OP的防治,外泌体作为一种新型的生物标志物,参与多种生物学及病理过程,且在物质交换以及信息传递等方面发挥重要作用,由于外泌体miRNA具有稳定的细胞通讯功能,使其成为潜在的中医药物载体,大量的研究资料证实其药效机制与外泌体miRNA密切相关。见图2。
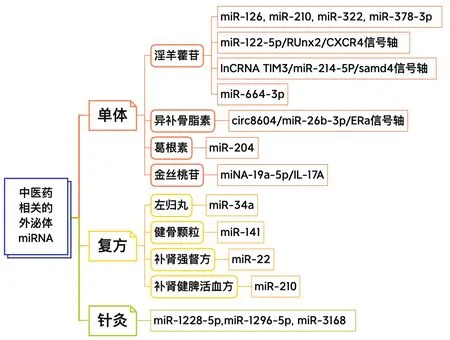
图2 中医药调节的外泌体miRNA作用于骨质疏松症Fig.2 The effect of medically regulated exosome miRNA on osteoporosis
6.1 单体
淫羊藿苷是淫羊藿主要的黄酮类活性物质,具有促骨形成、抗炎及调节免疫等药理作用。袁雯霞等[49]研究发现淫羊藿苷在缺氧环境下可进一步促进MSCs的增殖活性,抑制细胞的凋亡,并且显著提高了miR-126、miR-210、miR-322和miR-378a-3p在MSCs当中的表达。杨傲飞[50]发现,当淫羊藿苷处理BMSCs后,通过调控miR-122-5p/Runx2/CXCR4信号轴,促进BMSCs的成骨分化。孙海涛[51]在体外实验中发现淫羊藿苷能够通过调控lncRNA TIM3/miR-214-5P/samd4轴促进成骨细胞分化,而miR-664-3p通过下调靶基因Smad4和Osx的表达而抑制成骨细胞分化,阐释了淫羊藿苷治疗OP的分子机制[52]。异补骨脂素是补骨脂的主要活性成分,具有较强的抗骨质疏松活性。研究[53]发现,异补骨脂素刺激BMSCs后分泌的外泌体能够上调ALP、OPG、BMP2的表达,并可能通过调控circ8604/miR-26b-3p/ERα信号轴影响成骨前体细胞(MC3T3-E1)的成骨分化,进而调控骨代谢。此外,葛根素是从葛根中提取的异黄酮类化合物,张莹莹[54]在体外实验中发现,miR-204可负调节Runx2抑制成骨分化,并进一步验证了葛根素通过下调miR-204促进Runx2的蛋白表达,从而调节成骨细胞分化,金丝桃苷作为一种具有抗氧化应激和细胞凋亡等多种作用的中药单体,安宏强[55]推测金丝桃苷可能通过调控miRNA-19a-5p/IL-17A信号轴预防OP的发生。
6.2 复方
已有研究表明,中药复方可通过影响外泌体miRNA分泌量或内含成分延缓OP的发展,左归丸、健骨颗粒、补肾强督方、补肾健脾活血方等均可通过调节外泌体miRNA防治骨质疏松。
左归丸可通过上调miR-34a,抑制其靶基因Tgif2的表达,同时下调成脂相关因子PPRAγ,上调成骨核转录因子Runx2,促进BMSCs的增殖及成骨分化[56]。张楚天等[57]在体外实验中观察到健骨颗粒含药血清组miR-141的表达量降低,证明了健骨颗粒可抑制miR-141的表达,提高Runx2的表达,从而达到促进成骨分化的作用。孙文婷[58]研究显示补肾强督方可能部分通过下调IncRNA H19表达来上调miR-22表达,同时调控Wnt信号通路,从而干预hBMSCs的成骨分化。汪悦东[59]研究表明补肾健脾活血方可以通过调控miR-210提高成骨细胞活性,促进Runx2、OPG、OPN的表达,从而促进成骨矿化。
6.3 针灸
有学者[60]发现,针灸疗法能够改善骨代谢过程,抑制骨吸收的同时促进新骨形成,使机体处于平衡状态,从而达到治疗OP的效果。外泌体作为细胞间沟通传输的必要信使,可在不同细胞和系统之间传递信息[61]。刘小亚[62]提出外泌体在针灸干预的过程中充当信使,广泛的接受针灸刺激信号并作出回应,继而激发针灸的双向调节作用,维持体内稳态。
叶静等[63]为进一步探究针刺治疗骨病中外泌体的作用,检测了血清外泌体miRNA的释放趋势,发现针刺可以降低血清外泌体miR-1228-5p、miR-1296-5p和miR-3168的表达,并通过调控MAPK信号通路,影响细胞凋亡及自噬,从而发挥治疗作用。
7 展望
OP作为骨科常见的疾病之一,目前其发病机制已经有较为成熟的研究。但从微观角度上来说,其发病机制需要进一步的研究。外泌体miRNA作为近年来的研究热点,可通过调控成骨细胞及破骨细胞的增殖分化,影响血管生成及参与骨免疫学等途径参与OP的发生发展,但作为OP的特异性生物标志物及治疗靶点仍有相对局限性。此外,中医药作为我国独特的治疗方式,已有一些学者从微观角度上研究中医药可能通过影响外泌体miRNA的表达,参与疾病的发生发展及防治,但相关研究较少,且存在一些局限性,如体外实验用含药血清进行干预时,血清本身对外泌体的分泌会产生影响,增加了研究药物机制的不确定性。而外泌体作为药物载体,已成为当前的研究热点,而外泌体是否可用于中药的靶向研究将会成为将来的研究方向。
