自噬相关miRNAs、lncRNAs、circRNAs在骨质疏松症中的作用
2022-11-27李志超薛海鹏苏辉徐展望谭国庆
李志超 薛海鹏 苏辉 徐展望 谭国庆*
1.山东中医药大学,山东 济南 250014 2.山东中医药大学附属医院,山东 济南 250014
骨质疏松症(osteoporosis, OP)是一种以骨密度降低,骨结构恶化以及骨折风险增加的慢性骨骼疾病[1]。在我国,50岁以上人群中约有19.2%患有骨质疏松,65岁以上人群患病率更是高达32.0%[2]。骨内稳态决定着OP发生发展,而机械刺激、表观遗传调节和激素等因素造成的骨代谢紊乱导致骨内稳态发生异常变化,常表现为骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)分化失衡,成骨细胞功能衰减、骨形成不足与破骨细胞活性增强、骨吸收加快,最终导致净骨量丢失[3]。来源于成骨细胞的骨细胞也在骨内稳态中发挥重要作用,通过嵌入基质中充当能够将机械刺激转换为生物化学信号的传感器,其功能的紊乱将导致成骨细胞和破骨细胞的形成失衡[4]。非编码RNAs(non-coding RNAs, ncRNAs)作为重要调节因子,在细胞增殖、分化、凋亡和自噬等细胞过程中发挥重要作用。其中,自噬作为细胞成分循环的关键,在维持骨内稳态中扮演重要角色。最近,许多研究阐明了ncRNAs和自噬之间的联系在各种疾病中全新和关键的作用。防治OP是骨骼疾病研究中的重要领域,为了充分发挥ncRNAs与自噬相互作用在OP中的治疗效果,需要分析ncRNAs与自噬之间的串扰对骨内稳态的影响。因此,笔者总结了自噬相关ncRNAs,主要是微小RNAs(microRNAs, miRNAs)、长链非编码RNAs(long non-coding RNAs, lncRNAs)和环状RNAs(circular RNAs, circRNAs)在OP中作用的最新研究进展,并就它们对调节BMSCs、成骨细胞、骨细胞和破骨细胞生理功能的作用机制展开讨论。
1 自噬相关ncRNAs与OP的关系
ncRNAs,主要包括miRNAs、lncRNAs和circRNAs等,miRNAs是一类长度约为22个核苷酸的ncRNAs,可以通过互补碱基配对识别靶mRNAs的3’UTR区域,进而降解或抑制靶mRNAs表达[5]。lncRNAs是一类长度大于200个核苷酸的ncRNAs,可以通过自身核苷酸序列或折叠的二级结构与底物结合,并通过转录和转录后水平的多种机制调节基因表达[6]。circRNAs主要由反向剪接形成,是内源性共价闭合环状RNA分子,可作为miRNAs海绵调节miRNAs相关细胞过程[6]。随着深度测序技术的发展,越来越多影响骨代谢的具有生物学意义的ncRNAs被挖掘。例如,Jin等[7]使用基于Illumina测序确定了260个circRNAs、70个lncRNAs和13个miRNAs在绝经后OP患者与健康人群中存在差异表达。
自噬作为主要分解代谢途径之一,可以去除和回收受损蛋白质和细胞器,是细胞必要的动态平衡过程。在基础水平上,该过程在质量控制中发挥作用,从而参与细胞稳态;在各种压力下,例如营养剥夺或缺氧,自噬作为应激反应机制,有助于细胞存活直到条件改善[8]。骨形成和骨吸收之间的动态平衡亦是协调持续的,在BMSCs、成骨细胞、骨细胞和破骨细胞功能协同作用下,骨骼系统被不断重塑以保持强度发挥正常功能[9]。由于自噬的循环特性和持续的骨重塑,自噬被认为在骨内稳态中起着至关重要的作用。最近,自噬相关ncRNAs被证明参与多种疾病的发生发展,包括癌症、神经系统疾病、椎间盘退变和内分泌疾病等[10]。因此,可以认为ncRNAs与自噬的相互作用也可能是OP的潜在分子机制,并可能为OP药理学控制提供新的治疗靶点。见图1。
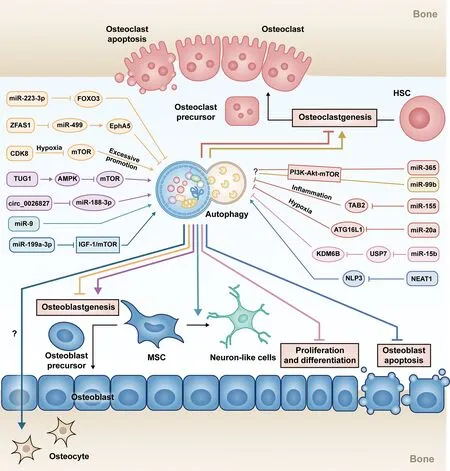
图1 自噬相关miRNAs、lncRNAs、circRNAs在OP中作用机制图Fig.1 Mechanism diagram of autophagy-related miRNAs, lncRNAs and circRNAs in OP
2 自噬相关ncRNAs调控BMSCs和成骨细胞作用机制
BMSCs分化去向在骨形成和吸收之间的平衡方面发挥着重要作用,其通常分化为成骨细胞、软骨细胞和脂肪细胞等,但衰老过程中其成骨分化逐渐减弱,这种分化失衡造成骨形成减少,进而导致OP。大量自噬小体在BMSCs分化初期被发现,抑制自噬将导致BMSCs凋亡,并减少其成骨分化[11-12]。成骨细胞来源于BMSCs,具有合成骨基质并促进骨基质矿化的功能,Nollet等[12]发现自噬体可作为运输钙磷结晶的载体,为成骨细胞发挥骨形成功能提供先决条件。并且,自噬还在各种不利环境下,对成骨细胞发挥保护作用[13-15]。最近,自噬相关miRNAs、lncRNAs和circRNAs作为关键因子,被认为在BMSCs和成骨细胞增殖、分化、凋亡等方面具有重要作用。
2.1 促进成骨分化和骨形成
部分自噬相关ncRNAs表现出对成骨分化的干预作用。Lu等[16]报道了lncRNA TUG1在骨形成中的作用,BMSCs成骨分化过程中TUG1表达明显增加,通过阻断AMPK通路和抑制自噬可以消除TUG1在BMSCs成骨分化中的积极作用,证明TUG1可以通过调控AMPK/mTOR自噬轴促进BMSCs成骨分化,具有治疗OP的潜力。Runt相关基因1(Runx1)被认为是协调BMP和WNT信号通路来调节骨稳态的成骨中心调节因子[17]。Ji等[18]观察到circ_0026827表达在成骨分化过程中增加,而circ_0026827敲除则抑制人牙髓干细胞(DPSCs)成骨分化,并促进miR-188-3p表达,而Runx1和自噬相关蛋白Beclin-1是miR-188-3p的下游靶标,表明circ_0026827通过海绵化miR-188-3p并靶向Runx1和Beclin-1介导的自噬促进DPSCs成骨分化。
炎症是导致骨内稳态失衡的主要原因之一,表现为骨形成受损以及骨过度退化[19]。Dai等[20]用脂多糖(LPS)刺激人成骨细胞系MG63细胞以构建炎症模型,发现LPS刺激的MG63细胞中有427个差异表达基因,其中lncRNA NEAT1显著下调,LPS上调炎性细胞因子和Nod样受体蛋白3(NLRP3)表达,抑制自噬相关和成骨相关蛋白表达,并促进成骨细胞凋亡,而这一作用可被NEAT1的过表达逆转,表明NEAT1通过激活自噬和抑制NLRP3炎性体来改善LPS诱导的细胞炎症并恢复其正常功能。
2.2 抑制成骨分化和骨形成
BMSCs成骨和成脂分化之间的转变决定了骨量,在老年性OP中起重要作用[21]。Wu等[22]发现lncRNA ZFAS1表达在成骨分化过程中下调,在成脂分化过程中上调,ZFAS1敲除则促进成骨分化并抑制成脂分化,有效抑制细胞衰老并促进自噬,其机制可能与通过海绵化miR-499,从而上调酪氨酸蛋白激酶A5受体(EphA5)表达有关。同样,Long等[23]观察到miR-223-3p的过表达将抑制下游靶点叉头盒转录因子O3(FoxO3)表达,通过抑制自噬和成骨分化相关因子水平,抑制BMSCs的成骨分化。此外,先前的研究揭示了泛素特异性蛋白酶7(USP7)和组蛋白去甲基化酶(KDM6B)在成骨分化中的重要作用[24-25]。最近,Lu等[26]在OVX小鼠模型中观察到miR-15b高表达,USP7和KDM6B低表达,注射miR-15b激动剂后发现USP7表达降低并进一步抑制KDM6B表达,从而导致成骨细胞自噬、增殖和分化受到抑制。另一方面,部分自噬相关ncRNAs还具有促进BMSCs其他方向分化的能力。Zhang等[27]通过调节miR-9表达水平,发现自噬标志物LC3数量、LC3Ⅱ/Ⅰ比值以及神经元标志物NSE和MAP2表达水平随miR-9表达增加,表明当miR-9过表达时自噬活性增加,BMSCs易于分化为神经元细胞,而减少成骨分化。
自噬在各种应激微环境(如炎症、缺氧或氧化应激)中维持着细胞存活。自噬失调则与人类疾病许多生理和病理过程有关,例如牙周炎组织中缺氧炎症环境使得自噬过度激活,扰乱成骨和吸收之间的平衡,导致骨质流失[28]。Zheng等[29]发现circRNA CDK8和缺氧诱导因子-1α(HIF-1α)水平在牙周炎组织中显著增加,在使用氯化钴(CoCl2)诱导的缺氧模型中进一步发现成骨细胞标志物(Runx2、ALP、OCN)表达水平在24~72 h内显著下降,此外,CDK8过表达通过mTOR信号诱导自噬和凋亡,CDK8沉默则逆转了CoCl2对人牙周膜细胞(PDLSCs)成骨分化的抑制作用。因此,抑制过度自噬,恢复适度水平自噬是维持骨内稳态的重要机制,可能在多种病理性骨质流失的骨病中发挥重要作用。
3 自噬相关ncRNAs调控骨细胞作用机制
在成骨细胞向骨细胞转换过程中,细胞空间位置和形态的剧烈变化需要细胞器的积极循环以提供营养并适应新环境[30]。考虑到成熟骨细胞作为终末分化细胞被动分裂,需要细胞内降解机制来保护它们免于经历细胞死亡[31]。同时,数十年的寿命决定了它们将长期生存在低氧、高氧化应激、营养匮乏和机械应力的环境中。这些生物学证据强调了自噬是确保骨细胞在独特微环境中存活的潜在机制。骨细胞是力学感受细胞,能够感知机械力并转化成梯级结构和发生生化变化[32]。周期性机械拉伸改变了骨细胞的大小和形状,并促进了骨细胞的网络发育,这与上调的自噬有关[33]。最近几年,人们才逐渐意识到骨细胞在调控骨代谢过程中的重要作用,这与很难获得嵌入坚硬矿化基质中的骨细胞有关。目前,仅有一项研究[34]关注了自噬相关ncRNAs在骨细胞中的作用,然而该项研究仅证明了过表达miR-199a-3p可以激活骨细胞样MLO-Y4细胞中的自噬,其机制可能与抑制IGF-1/mTOR转导通路有关,而并未确定miR-199a-3p是否调节骨细胞代谢。期待更多的相关研究展开,为我们认识骨细胞相关的骨发育、损伤、修复和再生过程提供帮助。
4 自噬相关ncRNAs调控破骨细胞作用机制
破骨细胞来源于单核造血系,主要受巨噬细胞集落刺激因子(M-CSF)和核因子κB配体受体激活剂(RANKL)的调控[35]。目前大量证据表明自噬相关蛋白Beclin-1、ATG5、ATG7、LC3均在破骨细胞分化和生理功能上发挥着重要作用[36-38]。并且,破骨细胞骨吸收过程与miRNAs、lncRNAs和circRNAs表达的调控失调密切相关。因此,通过干预自噬相关ncRNAs从而抑制破骨细胞分化可能是治疗OP的有效方向。
4.1 抑制破骨细胞分化
炎症微环境在骨量丢失中起着关键作用,由于炎症以细胞类型和组织特异性方式调控miRNAs组表达,炎症诱导的miRNAs可能导致与炎症相关的过度骨量丢失[39]。转化生长因子β活化激酶1结合蛋白2(TAB2)已被证明是一种新的Beclin-1相互作用分子,也是转化生长因子激酶1(TAK1)在自噬刺激下的共激活因子[40]。Sul等[39]发现在LPS诱导的破骨细胞中miR-155表达显著升高,而过表达的miR-155降低TAB2表达使得Beclin-1从TAB2和Beclin-1的复合物中高效解离,并增加TAK1与复合物的结合,通过升高LC3Ⅱ水平和降低p62水平诱导自噬小体形成,从而增加破骨细胞形成和活性,证实miR-155通过靶向TAB2调控LPS诱导的破骨细胞自噬的新作用,抑制miR-155表达可作为一种治疗靶点,通过抑制自噬抑制炎症环境下破骨细胞分化。
缺氧常见于多种病理性骨质流失的骨病中,通过抑制成骨细胞增殖、分化和矿化能力来抑制骨形成,同时,由于缺氧后破骨细胞分化和活性增强,导致骨吸收亦增加[41]。而自噬作为缺氧等条件下细胞应激反应,与破骨细胞分化和活性密切相关。Sun等[42]探索在M-CSF和RANKL刺激的RAW264.7细胞中缺氧对自噬和破骨细胞的影响,发现缺氧诱导自噬和破骨细胞分化标志物(Nfatc1、Traf6和TRAP)表达,并抑制miR-20a的表达。当过表达miR-20a后,其可以直接靶向Atg16L1从而抑制自噬,并显著下调破骨细胞分化标志物的表达,证明miRNA-20a/Atg1L1轴可能是缺氧诱导破骨细胞自噬和分化的关键机制。
4.2 介导自噬相关信号通路影响破骨细胞分化
目前研究认为,PI3K/AKT/mTOR信号通路是参与细胞自噬的中心通路[43]。mTOR作为自噬过程中的“监控器”和“守门人”,直接参与调节自噬标志蛋白的活动,而PI3K/AKT轴作为其上游调节因子,能够整合来自细胞环境的信号通路,最终参与调控自噬[44]。并且,mTOR作为破骨细胞分化的关键正向调节因子已被广泛报道,而自噬可能通过mTOR途径在骨吸收负性调节中起关键作用。在Franceschetti等[45]研究中发现,mTOR和PI3K/AKT可能是miR-365和miR-99b的重要靶点,在小鼠骨髓破骨前体细胞中,抑制miR-365可以增加破骨细胞数量但降低其细胞体积,而抑制miR-99b则降低它们的数量和体积,因此miR-365和miR-99b可能在微调和整合mTOR信号以促进最佳破骨细胞分化中发挥作用。见表1。
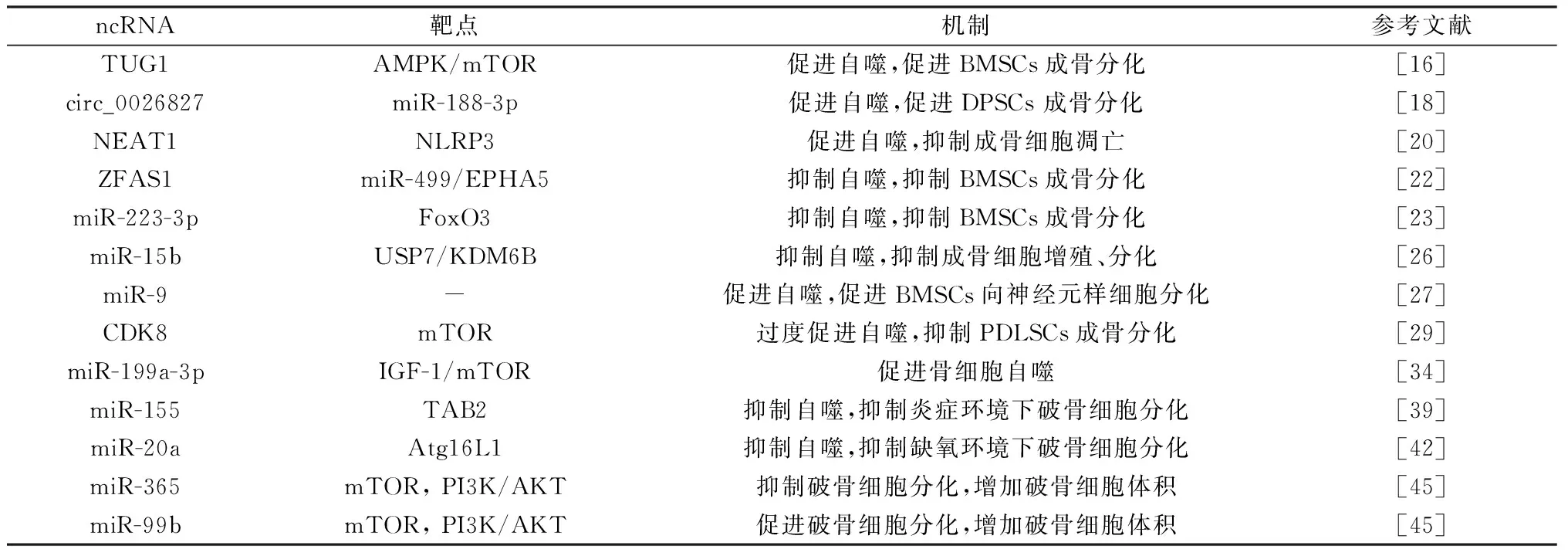
表1 自噬相关ncRNAs调控骨相关细胞作用机制Table 1 The mechanisms of autophagy-related ncRNAs regulating bone cells
5 小结与展望
OP逐渐成为老龄化社会主要负担之一,虽然各种合成代谢药物用于骨质疏松治疗,但存在的不良反应和限制仍在不断降低患者的生活质量。鉴于ncRNAs和自噬在骨组织中重要生物学作用,确定自噬相关ncRNAs在OP中治疗潜力是非常有必要的。通过文献整理,我们发现自噬相关ncRNAs在BMSCs、成骨细胞、骨细胞和破骨细胞分化、增殖、活性、凋亡中调节功能的有关研究明显增多。然而,大部分研究集中在细胞模型,而在体内进行的研究很少,多数研究也是以自噬相关通路为媒介探讨ncRNAs在OP中的作用,并未对自噬标志蛋白进行明确动态监测。lncRNAs和circRNAs都可以作为海绵直接结合miRNAs来影响OP进程,有关lncRNAs和circRNAs参与OP的研究相对较新,特别是circRNAs与自噬的相互作用如何更好维持骨稳态需要进一步研究。例如,自噬相关circRNAs在骨质疏松成骨细胞和破骨细胞中的调节作用数据十分有限,但作为重要调节因子,其治疗潜力是毋庸置疑的。此外,这些自噬相关ncRNAs在多种疾病中也同时发挥着特定的调控作用,因此,有必要探索它们与OP及其他器官疾病之间联系的精确机制,这对于ncRNAs相关药物在OP中的治疗应用具有重要意义。并且,尽管近期有大量研究探讨了ncRNAs在OP进展中的机制,但有关重要ncRNAs的临床转换研究仍然有限,在OP不同阶段骨组织中差异表达ncRNAs的体内研究也存在欠缺。骨质疏松不同阶段自噬水平也缺乏相应的实时动态监测。因此,识别更多与OP相关的重要ncRNAs,探索自噬、ncRNAs、OP的关系,开展有意义的临床转化研究,对于理解OP的病理机制、预防和治疗具有重要意义。
