身痛逐瘀汤疏通淋巴管瘀滞促进骨修复的实验研究
2022-11-27郑扬康王鹏禹赵力徐浩孙悦礼赵永见梁倩倩王拥军
郑扬康 王鹏禹 赵力 徐浩 孙悦礼 赵永见 梁倩倩* 王拥军*
1.上海中医药大学附属龙华医院,上海 200032 >2.上海中医药大学脊柱病研究所,上海 200032 3. 筋骨理论与治法教育部重点实验室,上海 200032 4.上海中医药大学,上海 201203
淋巴管系统具有免疫监控和维持体液平衡的重要生理功能[1]。在皮肤、筋膜、肌肉组织和骨膜等器官含有较丰富的淋巴管,可将组织间液和代谢废物回流至淋巴循环[2-4]。Szczesny等[5]发现创伤性骨折早期会出现淋巴管“瘀滞”,淋巴管回流功能若未及时恢复会继发创伤后淋巴水肿[6-7]。Arslan等[8]将大鼠后肢回流淋巴管和淋巴结摘除,成功建立慢性淋巴水肿模型后再造成胫骨骨折,发现慢性淋巴水肿会延迟骨折愈合。因此,及时恢复创伤后淋巴管回流,可能是促进骨折愈合的潜在靶点。
中医学认为骨折早期以“活血化瘀、消肿止痛”为治疗原则[9],身痛逐瘀汤是清代名医王清任的五逐瘀汤之一,临床常用于骨折伴有明显疼痛患者[10-13]。身痛逐瘀汤能否通过改善淋巴管回流功能以促进骨修复的机制尚需深入研究。因此,本研究拟通过建立胫骨骨折复合髓内固定小鼠模型,采用身痛逐瘀汤灌胃,从疏通淋巴管瘀滞角度探究身痛逐瘀汤促进骨修复的药效。
1 材料与方法
1.1 实验材料
1.1.1动物:6~8周龄SPF级雄性C57BL /6小鼠共40只,购于上海杰思捷实验动物有限公司,动物合格证号:SCXK(沪) 2018-0004,饲养于上海中医药大学实验动物中心。饲养室的温度和湿度各控制在23 ℃和60 %,保证充足的日照、鼠粮和饮用水。本研究通过上海中医药大学动物伦理委员会审核批准,伦理批号为PZSHUTCM211101023。
1.1.2药物与试剂:身痛逐瘀汤由秦艽3 g、川芎6 g、桃仁9 g、红花9 g、甘草6 g、羌活3 g、没药6 g、当归9 g、五灵脂6 g、香附3 g、牛膝9 g、地龙6 g组成[11],上述中药材均购自上海中医药大学附属龙华医院中药房。按照小鼠与人体表面积等效剂量比值为9.1计算小鼠(20 g)与人(60 kg)的临床用药剂量,则身痛逐瘀汤组小鼠灌胃身痛逐瘀汤的生药浓度为1.375 g/mL。取上述中药3剂加水浸泡过夜,共煎煮两次,去除药渣后混合两次汤剂,分装后于50 mL离心管中并-80 ℃冷库保存。
异氟烷(沃瑞德,中国),Veet脱毛膏(利洁时,中国),吲哚菁绿(Acorn,美国),TM-100型医用超声耦合剂(津亚,中国)。
1.1.3主要仪器:vivaCT40小鼠Micro-CT 扫描机(Scanco Medical AG公司,瑞士);电子数字称(KUBEI,中国);多通道小动物气体麻醉机(Matrx VMR,美国);近红外成像系统(Olympus MVX10,日本);微量注射器(HAMILTON,中国),1 mL无菌注射器(0.45×16 mm,山东威高);ElectroForce 3200生物力学机(TA-Bose,美国);痛阈测量仪(Ugo Basile,意大利),自制软组织肿胀测量仪。
1.2 分组与造模
采用随机数字表法标记小鼠,随机分为生理盐水组和身痛逐瘀汤组,每组各20只。造模前两天将小鼠右后肢用Veet脱毛膏脱毛,避免损伤皮肤。右侧胫骨骨折复合髓内固定造模方法:小鼠经异氟烷麻醉后,取仰卧位,从小鼠右膝中点以下作约1.5 cm纵行切口,暴露胫骨中段外侧缘,钝性分离胫骨周围肌肉,避免损伤后肢回流淋巴管与淋巴结。将1 mL无菌注射器针头从胫骨平台中点穿入,沿胫骨长轴刺入骨髓腔约1.5 cm,回退针头至胫骨平台近侧0.2 cm,用刀片轻轻割断胫骨中段,骨折断端对合齐后将针头再向下插入髓腔至髓内固定。当髓内针与骨骼髓腔内壁接触紧密,轻轻顺时或逆时针旋转髓内针,可见踝关节随同方向转动即证明对位对线良好,造模成功。剪断外露于胫骨平台的针帽,缝合皮肤并涂抹抗菌药膏以预防感染[14]。
1.3 干预方法
造模后30 min后,身痛逐瘀汤组给予浓度1.375 g/mL身痛逐瘀汤药液0.2 mL/d,生理盐水组给予同体积0.2 mL的0.9 % NaCl溶液,两组均连续灌胃5 d。至造模后14 d和28 d分别取骨折侧胫骨进行Micro-CT扫描和三点弯曲试验。
1.4 检测项目与方法
1.4.1近红外成像监测后肢淋巴管回流功能:在术前及术后第1天和7天,分别皮内注射小鼠足底0.2 μg/mL的吲哚菁绿溶液5 μL,即刻采用NIR-ICG淋巴成像技术记录足底荧光信号标记为0 h,24 h后再次记录足底荧光信号标记为24 h。运用Image J软件定量分析图片中ICG的荧光强度,并计算0 h和24 h两个时间点的足底ICG荧光强度差值,即足底ICG清除率=(S0 h-S24 h)/S0 h×100 %[15]。
1.4.2改良肢体肿胀测量仪检测骨折处软组织肿胀度:造模前及成功后第1天、2天、3天、5天、7天,将小鼠右后肢膝关节以下完全浸入新型实用测肿仪,测量3次后取平均值记为实验结果,计算骨折处软组织肿胀度=造模后肿胀体积/造模前肿胀体积×100 %。
1.4.3足底热敏痛阈检测:造模后第1天,将提前禁食禁水的小鼠提前放入痛阈测量仪的封闭小室适应2 h,待其安静后,使用30 %的辐射热诱导小鼠缩爪反应。当小鼠感到疼痛并抬起后爪时,仪器自动记录小鼠的爪子收缩时对应的反应时间。每只老鼠需重复测试5次。去掉5次测量结果的最高与最低值后,剩余3个值的平均值即为每只小鼠的平均反应时间[16]。
1.4.4Micro-CT扫描:取75 %乙醇处理过的小鼠胫骨组织标本,放入 Micro-CT仪检测舱,进行X线扫描,观察各组小鼠胫骨骨折愈合及骨痂形成情况。随后对胫骨样本(胫骨平台至踝关节之间的部位)进行断层扫描成像,检测参数:电压70 kV、电流142 μA、9 μm分辨率,0.5 mm铝过滤器。应用配套软件三维重建骨组织形态结构,并对骨痂的骨小梁参数进行定量分析[14]。
1.4.5三点弯曲试验:取材后小心地将胫骨标本剔除所有附着肌肉,并用生理盐水溶液浸泡后的纱布包裹于4 ℃保存。待所有标本收集齐后,将标本逐个平放于力学分析机器内,保持骨痂部位统一角度放置于测试仪中点,锁定标本两端,打开电脑设置程序,进行实验分析。
1.5 统计学处理
统计结果均为计量资料,采用均数±标准差描述,应用SPSS 20.0统计分析。两组独立数据如果服从正态分布且方差齐,则采用t检验;若方差不齐则采用t’检验。两组独立数据如果不服从正态分布,则使用非参数Mann-WhitneyU检验。两组多个时间点测量数据采用重复测量方差分析和简单效应检验。检验水准α=0.05,P<0.05代表差异有统计学意义。
2 结果
2.1 对下肢淋巴管回流功能的影响
图1显示,造模后第1天和第7天,身痛逐瘀汤组残留的ICG荧光染料显著少于生理盐水组。表1显示,造模后第1天和第7天,身痛逐瘀汤组骨折侧足底NIR-ICG清除率均显著高于生理盐水组(P<0.001)。
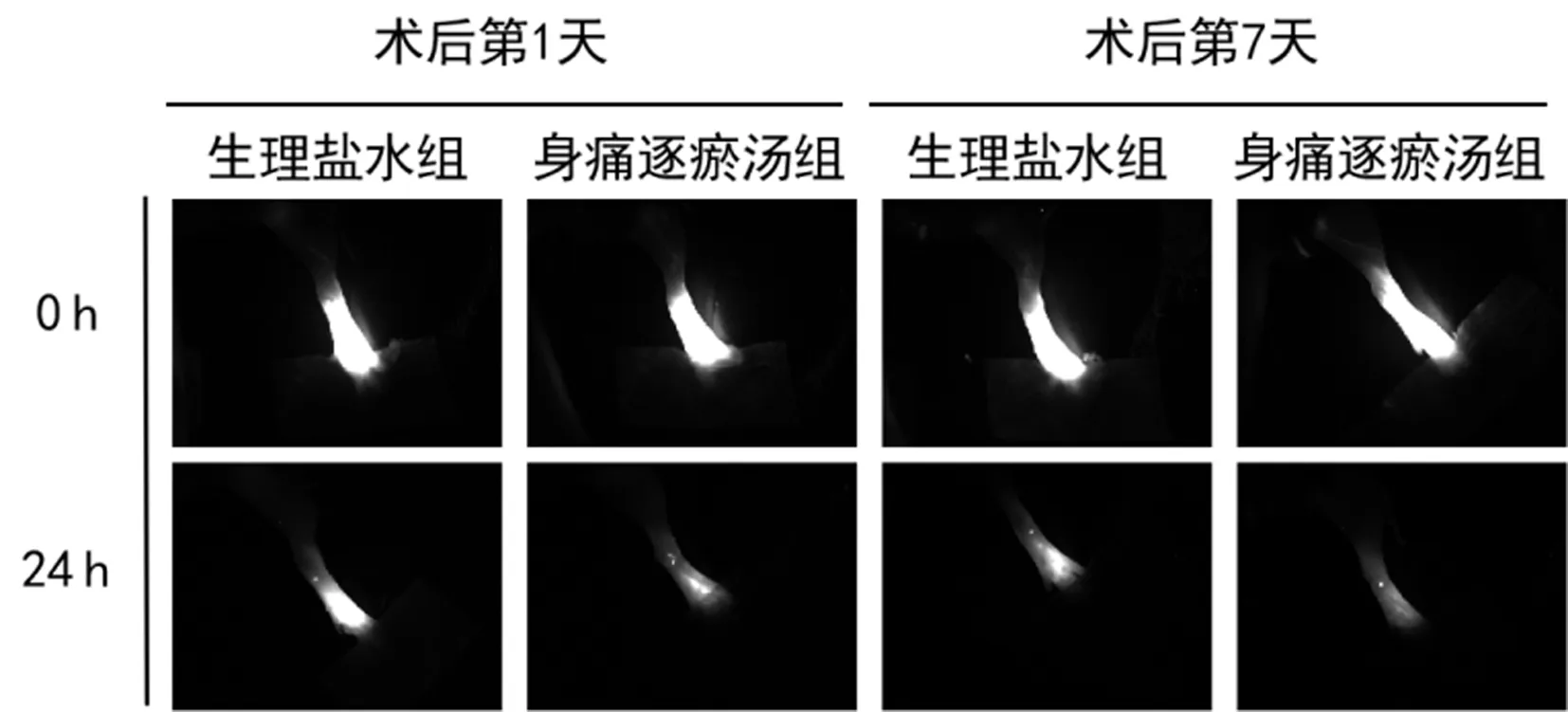
图1 两组小鼠骨折侧足底NIR-ICG的代表性图片Fig.1 Representative images of plantar ICG clearance at fractured hindlimbs by NIR

表1 两组小鼠骨折侧足底ICG清除率比较(%)Table 1 Plantar ICG clearance at fractured hindlimb(%)
2.2 对骨折断端软组织肿胀度的影响
图2显示,骨折后第2天,和身痛逐瘀汤组对比,生理盐水组骨折侧胫骨和踝关节等部位有明显的软组织肿胀,皮肤表面伴小面积溃疡。表2显示,造模后第2、3、5、7天,身痛逐瘀汤组骨折侧后肢的软组织肿胀度均明显低于生理盐水组(P<0.001)。

图2 术后第2天两组小鼠骨折断端软组织肿胀的代表图Fig.2 Representative picture of soft tissue swelling at fractured hindlimb on day 2
2.3 对足底热敏痛阈的影响
表3显示,骨折后第1天,身痛逐瘀汤组的热敏痛阈反应时间明显高于生理盐水组(P<0.01)。

表2 两组骨折处软组织肿胀度比较(%)Table 2 Soft tissue swelling degree of fractured side(%)

表3 两组小鼠的热敏痛阈反应时间比较(s)
2.4 对骨痂形态计量学的影响
图3显示,骨折后第14天,身痛逐瘀汤组小鼠比生理盐水组的骨痂量更多且更致密,骨折线更模糊。表4显示,与生理盐水组相比,身痛逐瘀汤组小鼠骨痂组织的骨体积分数(BV/TV)和骨小梁厚度(Tb.N)均显著性升高(P<0.05),但两组的骨小梁数量(Tb.Th)和骨小梁分离度(Tb.Sp)差异无统计学意义(P>0.05)。

图3 两组小鼠Micro-CT重建代表性图片Fig.3 Micro-CT reconstruction images of callus morphology

表4 两组骨痂计量学比较Table 4 Quantitative analysis of callus morphology
2.5 对骨折愈合生物力学性能的影响
表5显示,骨折后第28天,身痛逐瘀汤组小鼠骨痂的最大应力、屈服应力明显高于生理盐水组(P<0.001)。

表5 两组小鼠胫骨骨折愈合后的生物力学比较(MPa)Table 5 Biomechanical comparison of healing tibia(MPa)
3 讨论
当人体遭受外伤,骨骼断裂,经脉受损,血液离开血液循环之“经道”,停留于脏腑、胞宫、腠理之间则形成脉外瘀血。查阅既往古籍与文献,瘀血不利于骨修复的原因包括纤维蛋白未及时清除会减少骨折断端软骨内血管生成和骨化[17],不利于局部组织的血供[18],血液高凝状态造成肺栓塞[19],瘀血留滞、气血不畅、不通则痛。然而,目前未有研究从淋巴管瘀滞的角度探讨瘀血对骨修复的影响。
Szczesny等[5]推测创伤后淋巴管瘀滞的机制可能与渗入组织间隙的血液发生凝固进而堵塞毛细淋巴管或淋巴液直接凝固有关,Wandolo等[20]发现瘀血里的红细胞裂解物(血红蛋白、含铁血黄素和肌红蛋白)可直接抑制淋巴管的搏动。淋巴管作为引流组织间液、转运组织代谢产物的主要通道之一,对维持人体津液输布和平衡有重要作用[21]。故疏通淋巴管瘀滞是缓解骨折早期血瘀证的重要切入点。
身痛逐瘀汤出自王清任的《医林改错》,具有活血祛瘀、通络止痛无功效。方中君药为川芎,性辛温发散,善走窜,为血中之气药;辅以臣药当归、桃仁、红花共同活血祛瘀;佐以没药和五灵脂以化瘀止痛,地龙、秦艽和羌活以祛风除湿,香附可疏肝理气,牛膝可引血下行;使甘草调和诸药。现代研究证实身痛逐瘀汤具有明显的抗血栓、抗炎、镇痛等多种药效[22]。由于复方具有多成分与多靶点的复杂性,以上药效可能均是身痛逐瘀汤明显改善创伤后淋巴管瘀滞的药理机制。
既往临床研究评价身痛逐瘀汤促进骨修复的可信度不高,因其设计多叠加其他治疗方法进行评价,且存在样本量少、缺乏合理的对照组、以次要指标(如关节活动度、炎症因子水平)评价骨修复、纳入不同部位和不同程度骨折患者等不足。本研究采用空白对照设计,以Micro-CT和三点弯曲试验作为主要指标直接评价身痛逐瘀汤对骨修复的疗效。综上所述,本研究基于疏通淋巴管瘀滞,增强淋巴管回流的角度,采用小鼠骨折模型证实身痛逐瘀汤具有明显促进骨修复的作用,为中医骨伤科早期活血化瘀法促进骨修复提供科学依据,开拓了中医活血化瘀法促进骨修复药理机制研究的新领域。
