水稻BCAT4基因突变株幼苗对PEG模拟干旱胁迫的响应
2022-11-26陶宝杰李思崎景凝浩刘立军
陶宝杰,李思崎,景凝浩,沈 月,吕 冰,刘立军,陈 云*
(1 江苏省作物遗传生理重点实验室,江苏扬州225009;2 扬州大学生物科学与技术学院,江苏扬州225009)
干旱会降低土壤水势,使细胞无法维持膨压,并伴随着活性氧爆发,膜脂和蛋白质等大分子发生氧化损伤[1],最终导致作物减产。为抵御氧化损伤,植物进化出一套高效的防御机制:一方面依靠超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等抗氧化酶清除体内过多的活性氧[2],另一方面积累脯氨酸、可溶性糖等渗透调节物质来抵御水分流失,结合蛋白质等大分子维持其构象[1]。目前普遍认为通过分子手段提高抗氧化能力是培育节水耐旱水稻品种的有效方式[3]。
植物中支链氨基酸转氨酶(branched-chain amino acid transaminase,BCAT,EC2.6.1.42)是支链氨基酸(branched-chain amino acid,BCAA)代谢的关键酶[4]。研究表明BCAT参与对干旱胁迫的响应[5]、ABA信号通路[6]、氮饥饿胁迫[7]、病原体免疫[8]等多种生理功能。拟南芥AtBCAT3蛋白在干旱胁迫下表达量显著升高,突变体AtBCAT3对干旱敏感[9]。大麦幼苗Hvbcat-1的转录水平随干旱胁迫的增加而上升,其产生的BCAAs可以作为一种储能物质在胁迫条件下降解供能[10]。硬粒小麦TdBCAT-A和TdBCAT-B的启动子序列中存在脱水响应元件结合位点,干旱胁迫特异性诱导TdBCAT-A和TdBCAT-B的转录水平显著上升并导致BCAAs积累[5]。水稻BCAT4是AtBCAT3的同源蛋白,定位在叶绿体,参与合成异亮氨酸和缬氨酸[11],具有调控水稻矿质元素积累的作用[12]。目前鲜见水稻BCAT蛋白响应干旱胁迫的相关研究报道。
本实验以野生型水稻‘日本晴’(NIP)及BCAT4缺失突变体bcat4-1为材料。用不同浓度的PEG-6000高渗溶液处理水稻幼苗,测定BCAT4表达量的变化及NIP和bcat4-1植株的相关形态生理指标,以探讨BCAT4参与水稻幼苗响应干旱胁迫的生理机制,为耐旱水稻品种的培育提供思路。
1 材料和方法
1.1 试验材料
本试验材料为野生型水稻‘日本晴’(OryzasativaL.japonica.cv.Nipponbare,NIP)及以NIP为背景通过CRISPR/Cas 9技术获得的BCAT4突变体bcat4-1。与NIP相比,突变体bcat4-1中BCAT4基因的cDNA序列第65个碱基后插入了一个腺嘌呤而引入了一个终止密码子TAG,导致其蛋白质序列在第22个氨基酸残基后提前翻译终止。
1.2 试验设计
NIP与bcat4-1种子用2%次氯酸钠消毒20 min,再用清水冲洗后28 ℃浸种1 d,37 ℃催芽1 d,转移至去底的PCR板,置于培养箱中(光照16 h/8 h,温度28 ℃/26 ℃,湿度70%)用水培营养液[13]培养21 d(清水3 d,1/2营养液7 d,全营养液11 d)后分别置于含质量浓度分别为15%、20%和25%的PEG-6000的营养液中进行胁迫处理,以不加PEG为对照。每处理300株苗,重复3次。
1.3 测定项目与方法
1.3.1 荧光定量PCR在不同浓度PEG处理后第0、1、3、5、7天取NIP幼苗叶片测定BCAT4表达量。提取叶片总RNA反转录成cDNA,按照MagicSYBR Mixture试剂盒说明书进行SYBR GreenⅠ荧光定量PCR反应。反应体系为:2 × MagicSYBR Mixture 10 μL、正反向引物各0.4 μL、cDNA模板2 μL、ddH2O补足至20 μL。反应程序:预变性95 ℃ 30 s、变性95 ℃ 5 s、退火/延伸60 ℃ 30 s,共40个循环。引物为BCAT4-F(5′-TCTTATTATTTCGCCCGGAGG-3′)和BCAT4-R(5′-AGGCACCCATCTCTTGTTTGC-3′);Actin-F(5′-TCGTGTAGCACCAGAAGA-3′)和Actin-R(5′-TCCTGCTCGTAGAAGA-3′)。RNA提取、反转录与荧光定量PCR试剂盒均购自康为世纪生物科技股份有限公司。每处理取3株苗,重复3次。
1.3.2 叶绿素的相对含量分别在20% PEG处理后第0、1、3、5、7天,用叶绿素测定仪(SPAD-502)测定叶片叶绿素的相对含量(SPAD值)。每处理测3张叶片,重复3次。
1.3.3 形态生理指标在20% PEG处理后第7天取样测定苗高、根长、地上部鲜重、地上部干重、根系鲜重、根系干重、叶片相对含水量和根系活力。叶片相对含水量(RWC)测定采用比重法,取叶片鲜样称重记为鲜重(FW),将其在蒸馏水中浸没70 min,擦干称重记为饱和鲜重(SPW),再烘干记为干重(DW),计算RWC=(FW-DW)/(SPW-FW)×100%。根系活力测定采用三苯基氯化四氮唑(TTC)还原法,根样与TTC溶液反应后,用乙酸乙酯提取反应产物测定485 nm处吸光度,计算根系活力[14]。每处理取3株苗进行以上指标的测定,重复3次。在20% PEG处理后第10天复水,于复水后第3天以每处理24株苗为基数计算存活率,存活率(%)= 存活苗数/总处理苗数×100%,重复3次。
1.3.4 渗透调节物质含量、氧化损伤指标和抗氧化酶活性在20% PEG处理后第0、1、3、5、7天分别测定地上部和根系的渗透调节物质含量和抗氧化酶活性。脯氨酸含量测定以80%乙醇提取,采用酸性茚三酮法[14]。丙二醛(MDA)含量测定以10%三氯乙酸提取,采用硫代巴比妥酸显色法[14]。相对电导率测定采用浸泡法[15],用数字电导率仪(DDS-12A)测定电导率。可溶性糖含量、H2O2含量、SOD酶活、POD酶活和CAT酶活测定试剂盒均购自苏州科铭生物技术有限公司,实验方法参照说明书。每批测定材料均另取一份样品烘干称重测定含水量,各指标测定结果以DW计,以消除不同样品经PEG胁迫后植株鲜重变化差异造成的误差。每处理取3株苗,重复3次。
1.4 数据分析
试验数据采用统计分析软件SPSS 25.0进行独立样品t检验分析和单因素方差分析,试验数据均为平均值±SD(n = 3),使用GraphPad Prism 9.0绘图。
2 结果与分析
2.1 PEG模拟干旱胁迫对水稻幼苗叶片BCAT4表达的影响
图1显示,随着胁迫天数增加,在15%PEG处理后野生型NIP叶片中BCAT4基因相对表达量逐渐上升,在20%和25%PEG处理后则先上升后下降。与对照(处理后第0天)相比,BCAT4基因相对表达量在15% PEG处理后第1天就显著增加,在处理后第7天达到最高,比对照增加了0.9倍;BCAT4基因相对表达量在20% PEG处理后第1天即比对照极显著增加,处理后第5天达到最高,比对照增加了1.9倍,处理后第7天开始下降但仍极显著高于对照;BCAT4基因相对表达量在25% PEG处理后第1天就比对照增加了1.0倍,并达到最大值,而在处理后第3天迅速下降,在处理后第5天就显著低于对照。可见,20% PEG处理后NIP叶片BCAT4基因相对表达量变化幅度较大且不会过早降低。所以,后续采用该浓度处理进一步观察表型并测定其他形态及生理指标。
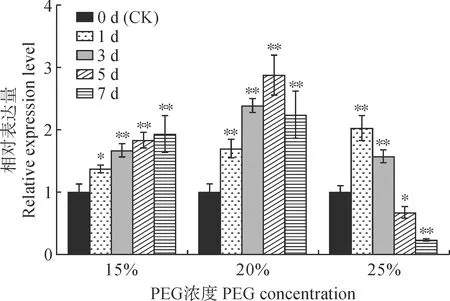
以处理后第0天为对照,相同PEG浓度下不同天数对比,*表示差异显著(P < 0.05),**表示差异极显著(P < 0.01)
2.2 PEG模拟干旱胁迫对水稻幼苗表型及生长的影响
2.2.1 幼苗表型20% PEG处理后,NIP和bcat4-1幼苗的生长均受到抑制,叶片随着胁迫时间延长而逐渐干枯卷曲;与NIP相比,突变体bcat4-1表现为不耐旱,bcat4-1的叶片卷曲程度在处理后第5天显著高于NIP(图2)。

图2 20% PEG处理后NIP和bcat4-1的表型
2.2.2 幼苗形态指标在不加PEG(对照)条件下,NIP与bcat4-1幼苗各项指标均无显著差异。在20% PEG处理后第7天,NIP和bcat4-1幼苗的苗高、地上部鲜重、地上部干重、叶片相对含水量均比对照降低,降幅分别为36.2%和51.1%、56.5%和73.6%、25.0%和31.6%、25.5%和64.0%;其中bcat4-1的苗高、鲜重和叶片相对含水量均显著低于NIP(表1)。同时,与对照相比,20% PEG处理后第7天,NIP与bcat4-1幼苗的主根长、根鲜重、根干重、根活力均显著下降,但上述各指标在两材料间均无显著差异。以上结果表明在PEG模拟干旱胁迫下,NIP和bcat4-1幼苗的形态指标均受到显著抑制;BCAT4突变显著降低水稻幼苗苗高、地上部鲜重和叶片相对含水量,降低了水稻幼苗抗旱性,但对地下部指标无显著影响。
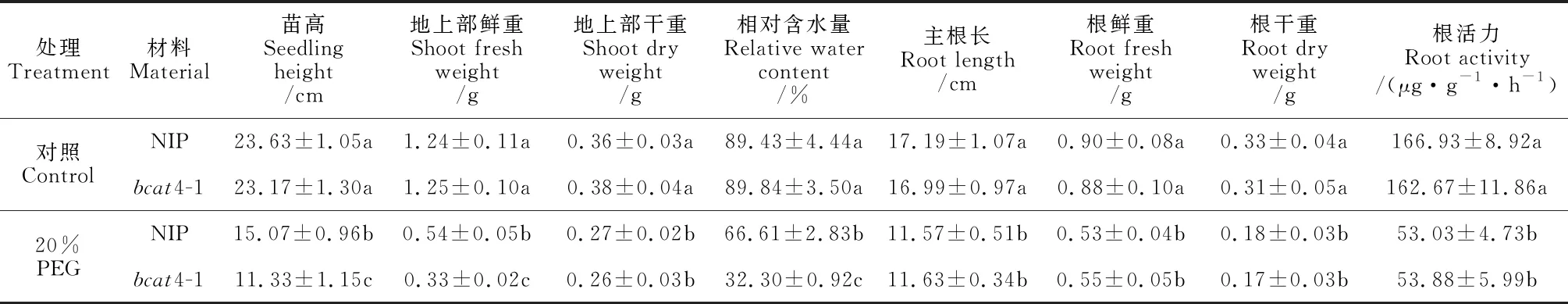
表1 20% PEG处理后第7天NIP和bcat4-1幼苗形态生理指标的变化(单株)
2.2.3 幼苗复水后存活率在20% PEG处理后第10天将水稻幼苗复水,以叶片转为鲜绿色为存活依据,于复水后第3天拍摄表型并统计NIP与bcat4-1的存活情况。bcat4-1和NIP水稻幼苗的复水后存活率分别为30.6%和61.8%,材料间差异极显著(P<0.01)(图3)。表明BCAT4突变后,水稻幼苗从干旱胁迫中恢复的能力显著下降,耐旱性明显减弱。
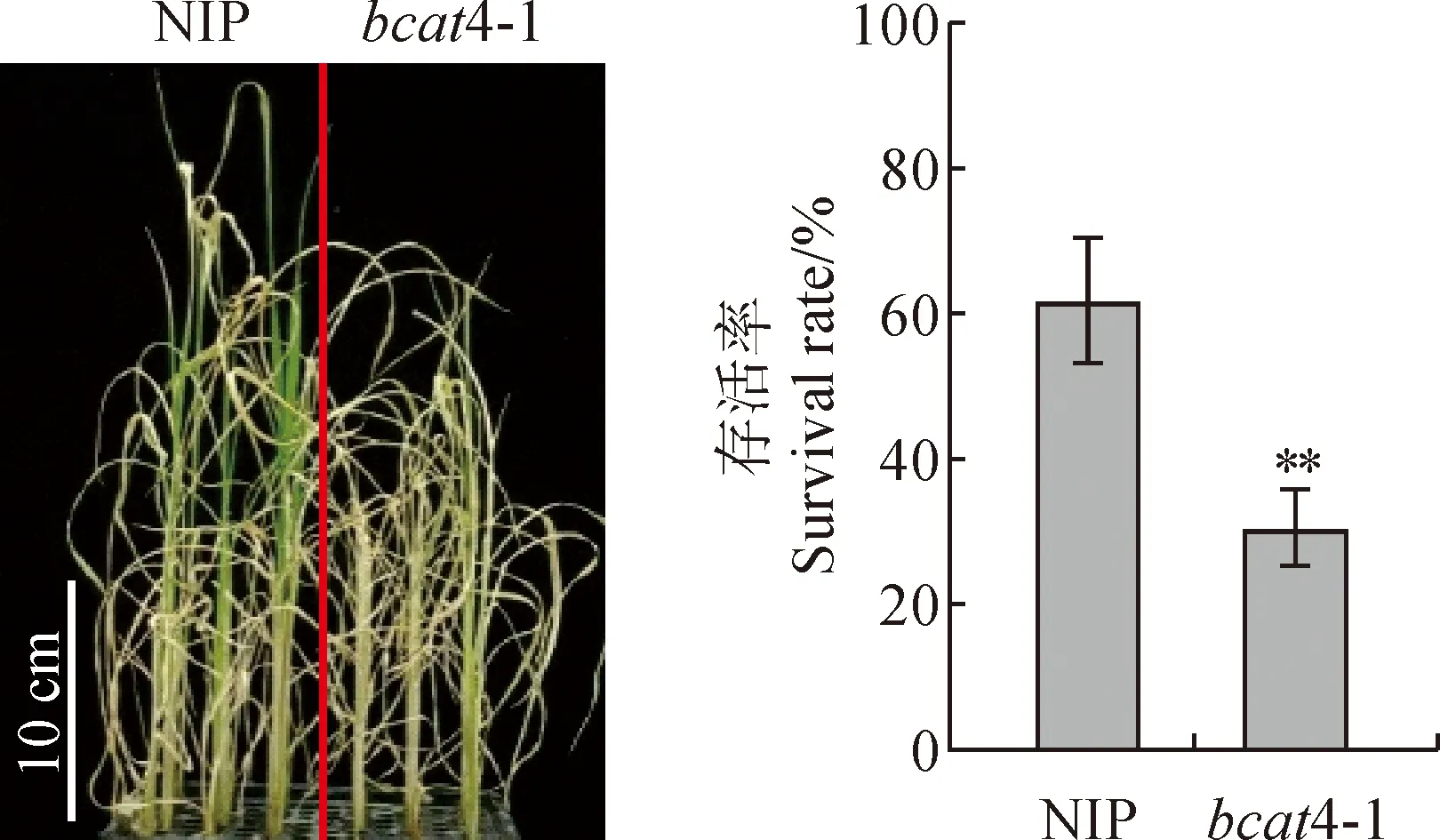
以NIP为对照,**表示差异极显著
2.3 PEG模拟干旱胁迫对水稻幼苗叶绿素含量的影响
叶绿素含量与植物的光合速率、生理营养状况密切相关。20% PEG胁迫处理后,两水稻材料幼苗叶片的SPAD值均持续降低,且bcat4-1幼苗的叶片SPAD值始终显著低于同期NIP幼苗。其中,在处理后第1天,两材料幼苗叶片的SPAD值差异就达到显著水平,在处理后第5天时差异达极显著水平,处理后第7天,bcat4-1的SPAD值比NIP极显著降低18.04%(图4)。
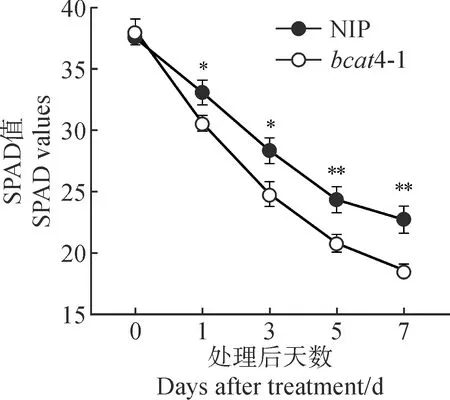
以NIP为对照,*表示差异显著,**表示差异极显著,图5~7同
2.4 PEG模拟干旱胁迫对水稻幼苗脯氨酸和可溶性糖含量的影响
脯氨酸和可溶性糖是植株响应干旱胁迫过程中重要的渗透调节物质,二者的积累量与植株抗旱性成正比。随着20% PEG胁迫处理天数增加,两水稻材料叶片和根系中的脯氨酸和可溶性糖含量均呈逐渐上升趋势,且bcat4-1在胁迫处理过程中始终低于同期NIP(图5)。其中,bcat4-1叶片中脯氨酸含量始终与NIP差异显著或极显著,在处理后第7天比NIP极显著降低35.55%(图5,A);两材料根中脯氨酸含量均低于叶片,且在PEG处理期间差异小于叶片,在处理后第3天差异才达到显著水平,bcat4-1在处理后第7天比NIP显著降低13.39%(图5,B)。在20% PEG处理后,两材料中可溶性糖含量的变化趋势与脯氨酸含量相似,bcat4-1叶中可溶性糖含量始终与NIP差异极显著,在处理后第7天比NIP极显著降低23.23%(图5,C);两材料间根中可溶性糖含量差异也明显小于叶片,仅在处理后第5天差异达到显著水平(图5,D)。由此可见,2个水稻材料幼苗叶片和根系的脯氨酸和可溶性糖含量均会随干旱胁迫时间延长而上升,BCAT4缺失后显著降低了叶片中脯氨酸和可溶性糖含量的上升幅度。
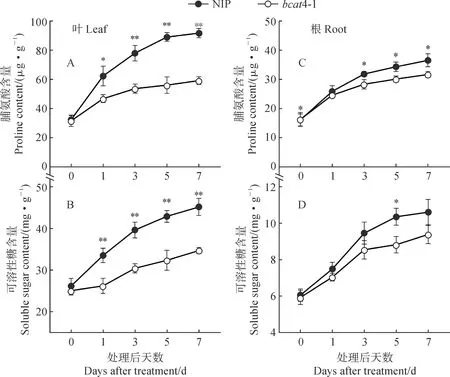
图5 20% PEG处理后NIP和bcat4-1叶片(A、B)和根系(C、D)中脯氨酸与可溶性糖含量
2.5 PEG模拟干旱胁迫对水稻幼苗MDA和H2O2含量及相对电导率的影响
MDA、H2O2的积累量和相对电导率可以评估质膜受损程度,间接体现植株抗旱性。随着PEG模拟干旱胁迫天数增加,两水稻材料叶片和根系中的MDA、H2O2含量及相对电导率均逐渐增加,且bcat4-1的各指标始终高于同期NIP(图6)。其中,两材料间叶片MDA、H2O2含量及相对电导率在PEG处理1~7 d差异均达到显著水平,bcat4-1叶片上述3个指标在处理后第7天分别比NIP极显著提高31.1%、17.4%和19.8%(P<0.01)(图6,A-C)。同时,20% PEG模拟干旱胁迫对根细胞的膜脂损伤在两材料间差异较小,除了处理后第5天和第7天根中H2O2含量在材料间差异达显著水平外,其余指标在处理后不同时间的差异均未达到显著水平(图6,D-F)。可见,BCAT4缺失显著加剧干旱胁迫期间水稻幼苗叶片的质膜受损程度。
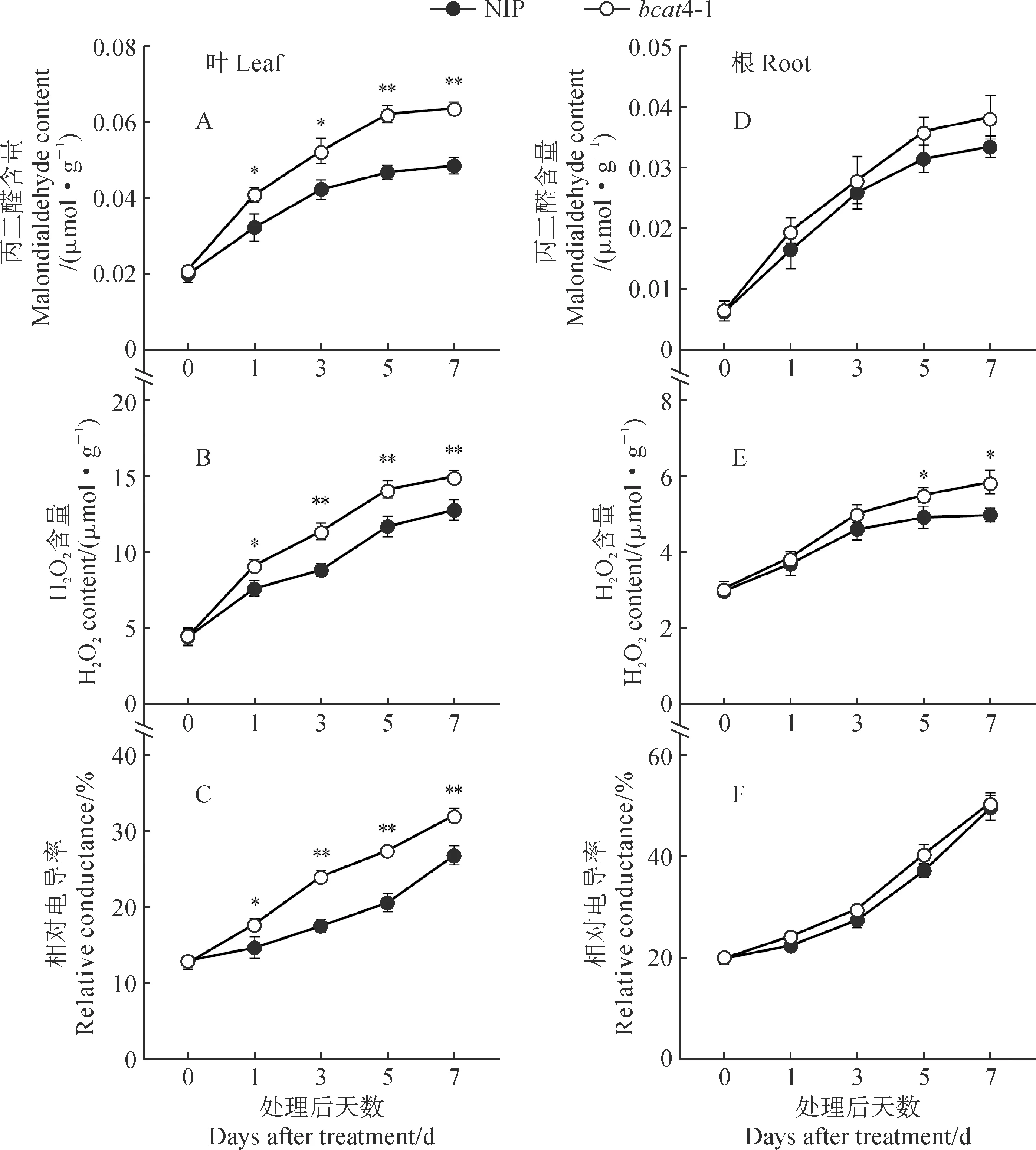
图6 20% PEG处理后NIP和bcat4-1叶片(A-C)和根系(D-F)中MDA和H2O2含量及相对电导率
2.6 PEG模拟干旱胁迫对水稻幼苗抗氧化酶活性的影响
超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)是植物体内抵抗氧化损伤最重要的酶类。随PEG模拟干旱胁迫天数增加,两水稻材料叶片中的SOD、POD、CAT活性均表现出先上升后下降的趋势;NIP叶片中POD活性在处理后第3天达最大值,SOD和CAT活性在处理后第5天达最大值,而bcat4-1叶片中上述3种酶活性均在处理后第3天即达到最大值,并且这3种酶的活性始终显著低于同期NIP,在处理后第3天分别比NIP极显著降低17.5%、36.9%和22.3%(图7,A-C)。同时,两材料根中3种抗氧化酶活性随处理时间延长一直保持上升趋势。其中,根系SOD和POD活性在品种间差异分别在处理后第7天和第5天达到显著水平,品种间CAT活性差异在各处理时间均不显著(图7,D-F)。因此,缺失BCAT4后显著降低了干旱胁迫后水稻幼苗叶片中抗氧化酶活性,使得抗氧化酶活性上升幅度降低,下降时期提前。
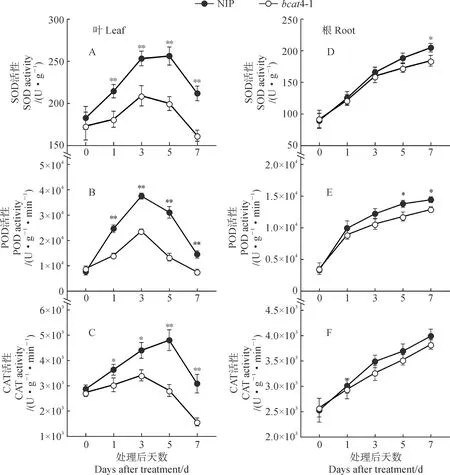
图7 20% PEG处理后NIP和bcat4-1叶片(A-C)和根系(D-F)中SOD、POD和CAT活性
3 讨 论
PEG-6000具备较大的分子量,无法通过植物细胞壁且化学性质不活泼,是较为理想的渗透调节剂[16]。本试验设置3种不同浓度的PEG模拟干旱胁迫处理,分析野生型NIP的BCAT4表达情况,确定了20% PEG为最佳处理条件,该PEG浓度下水稻幼苗BCAT4表达量上升幅度最大,又不会因过早脱水而抑制生理活动。在20% PEG-6000模拟干旱胁迫下,bcat4-1幼苗的复水存活率显著低于NIP,且处理后bcat4-1的叶绿素含量下降幅度显著大于NIP,耐旱性明显减弱。
抗氧化酶系统在植物抗逆过程中发挥着重要作用[17]。在20% PEG模拟干旱胁迫下,本研究中NIP与bcat4-1叶片中的SOD、POD和CAT活性均呈现先增加后下降的趋势,这与前人的研究结果相一致[18-20],说明在胁迫前期植株可以依靠保护酶系统抵御氧化损伤,在胁迫后期蛋白质大量分解使得抗氧化酶的活性下降[18]。同时,本研究的bcat4-1叶片中上述3种抗氧化酶的活性始终低于NIP,抗氧化能力减弱;在干旱胁迫后期(处理后第7天),水稻幼苗根中抗氧化酶的活性仍维持较高的水平,这是干旱胁迫下植物保护根系的重要抗旱策略[21]。另外,脯氨酸和可溶性糖具有渗透调节作用,可以缓解干旱胁迫对植株的伤害[20]。本研究中bcat4-1叶片的脯氨酸和可溶性糖含量在模拟干旱胁迫开始后上升幅度显著低于NIP,积累渗透调节物质的能力下降。H2O2是活性氧代谢的重要中间产物,MDA含量体现了膜脂过氧化程度,而相对电导率可以评估质膜的透性,本试验中bcat4-1叶片的上述3个指标的上升幅度均显著高于NIP,说明BCAT4突变后幼苗地上部更易受到活性氧的伤害。活性氧的过度积累可引发叶绿素的降解[22],导致bcat4-1的SPAD值下降幅度显著高于NIP。另外,本研究中两个水稻材料幼苗以上各项指标在根中的差异均小于在叶片中的差异。单因素方差分析结果表明BCAT4突变主要影响幼苗地上部的生长,而对根系的影响不显著。结合已有报道称BCAT4定位在叶绿体中[7],本研究认为BCAT4主要参与水稻地上部对干旱的响应过程。
BCAT4在拟南芥中的同源蛋白AtBCAT3合成的BCAAs可作为渗透调节物质或以供能物质的方式协助植物抵御干旱胁迫[10, 23-24],其T-DNA插入突变体在干旱胁迫下表现生长迟缓和种子产量显著降低[9]。Jin等[12]报道了水稻BCAT4参与合成异亮氨酸和缬氨酸,本研究观察到其缺失后表现的耐旱性下降可能与BCAAs合成减少有关。拟南芥和西兰花中BCAT参与合成蛋氨酸衍生物[25-26],孙阳阳认为水稻BCAT4也参与合成S-腺苷L-蛋氨酸[7],经脱羧反应为多胺的生物合成提供氨丙基供体[27]。植物体内多胺的积累可以激活抗氧化酶系统,也可以直接发挥渗透调节和活性氧清除作用,协助植物响应干旱胁迫[28-29]。因此,BCAT4还可能参与调节多胺类物质的生物合成来协助植物响应干旱胁迫。
综上所述,BCAT4突变抑制了水稻幼苗在PEG-6000模拟干旱胁迫下地上部渗透调节物质的积累和抗氧化酶活性,导致叶绿素含量降低,MDA和H2O2积累增加,细胞膜受损加剧,相对电导率上升,最终降低了水稻的耐旱性。本研究探讨了BCAT4参与水稻干旱响应的可能机制,为水稻抗旱育种提供了一定的理论参考,但只从突变体材料出发具有一定的片面性,未来应构建BCAT4过表达材料以进一步验证已有结论。
作者贡献说明:陶宝杰:进行实验,完成论文撰写与修改;李思崎:协助完成实验数据的分析;景凝浩:参与形态与生理指标测定;沈月:参与植物材料处理;吕冰:提出修改意见;刘立军:提出修改意见;陈云:提出研究思路,指导实验和论文写作并提出修改意见。
