西沙群岛海滨大戟化学成分研究
2022-11-26吴丝雨段瑞军戴好富梅文莉许凤清黄圣卓
赵 焕,吴丝雨,段瑞军,曾 军, 戴好富,梅文莉,许凤清*,黄圣卓*
1中国热带农业科学院热带生物技术研究所 海南省黎药资源天然产物研究与利用重点实验室,海口 571101; 2安徽中医药大学药学院,合肥 230012;3中国热带农业科学院热带生物技术研究所 海南热带农业资源研究院,海口 571101
农业农村部“南锋专项”考察团队调查发现大戟科(Euphorbiaceae)大戟属EuphorbiaLinn.多年生草本植物海滨大戟Euphorbiaatoto为西沙群岛岛礁特色植物,并且是永乐群岛和宣德群岛的主要海岸带优势植物[1,2]。西沙群岛药用植物资源较为丰富,其中大戟属的药用植物也相对较多,且多可作为清热类草药[3]。海南沿海当地居民将海滨大戟作为清热解毒药物,用于治疗痢疾和泄泻等症[4]。前期预实验中发现海滨大戟的粗提物具有较好的抗炎活性,体外能够抑制脂多糖(LPS)诱导小鼠单核巨噬细胞RAW 264.7产生NO(200 μg/mL浓度下,抑制率为83.97%)。为了了解海滨大戟的主要活性物质,本研究对海滨大戟地上部分进行化学成分及其体外抗炎活性和细胞毒活性研究。
1 材料与方法
1.1 实验样品
1.2 仪器设备与试剂
Bruker AV-500型超导核磁共振仪(德国Bruker公司);ESI-MS质谱仪(德国Bruker amazon SL公司);CA-1111冷却水循环装置(上海爱朗仪器有限公司);旋转蒸发仪(德国Heidolph Laborota公司);MCP 5100旋光仪(奥地利Anton Paar公司);FDS-2000冷冻干燥机(日本东京理化器械株式会社);METTLER TOLEDO ME204精密和分析天平[万分之一,梅特勒-托力多仪器(上海)公司];Varioskan LUX酶标仪(美国Thermo Scientific公司);GALAXYR CO2培养箱(英国RSBiotech公司);HHB11360-S普通培养箱(上海跃进医疗器械厂);SW-40超净工作台(河流科技有限公司);UNIQUE-R20纯水系统(厦门锐思捷科学仪器有限公司)。
色谱硅胶板G/H/G254、柱色谱硅胶(青岛海洋化工厂);Rp-18(20~45 μm,日本Fuji Silysia Chemical Ltd公司);Sephadex LH-20(美国GE Healthcare公司);常用有机试剂为国产AR级试剂(天津市康科德科技有限公司);氘代试剂(美国Merck公司);DMSO(西陇化工股份有限公司);浓硫酸(山东淄博滨岭化工有限公司);精碘(上海SUNHEAT化工公司);碘显色剂和5%~10%硫酸-乙醇显色剂。
小鼠单核巨噬细胞(RAW 264.7)(中国科学院干细胞库);人胃癌细胞株(SGC-7901)、人慢性髓原白血病细胞株(K562)、人宫颈癌细胞(Hela)、人肺癌细胞株(A549)和人肝癌细胞株(BEL-7402)(中国科学院上海生命科学研究院细胞库);脂多糖(上海碧云天生物技术有限公司,批号S-1732)、4-硝基苯基-D-吡喃葡糖苷(上海源叶生物科技有限公司,批号K22J9B64113)、槲皮素(美国默克公司,批号SLBZ4289)、Griess试剂(上海源叶生物科技有限公司,批号L01N10G101815)和四甲基偶氮唑蓝(广州赛国生物科技有限公司,批号EZ2811E134);DMEM培养基(赛默飞世尔科技公司,批号8120459)、胎牛血清(浙江天杭生物科技股份有限公司,批号11011-8611)、丙酮酸钠(美国赛默飞世尔科技公司,批号2323639)和谷氨酰胺(美国赛默飞世尔科技公司,批号2323475)。
1.3 提取与分离
取新鲜海滨大戟地上部分全草10 kg切碎、晾干、粉碎后,浸泡在95%乙醇(20 L)液中,每3小时回流提取(78 ℃)1次,共提取3次,合并减压浓缩后得乙醇浸膏(1.23 kg)。浸膏加水混悬,乙酸乙酯萃取3次,减压浓缩回收溶剂得乙酸乙酯萃取物347 g。乙酸乙酯萃取物340 g,经硅胶柱色谱(200~300目),石油醚-丙酮(V/V,30∶1→0∶1,每个梯度4 L)梯度洗脱,得12个流份Fr.1~Fr.12。
Fr.3(37.0 g)经Rp-18反相柱色谱梯度洗脱得4个流分Fr.3.1~Fr.3.4。Fr.3.1(2.3 g)经Sephadex LH-20(甲醇)洗脱得10个流分Fr.3.1.1~Fr.3.1.10。Fr.3.1.5(70.0 mg)经硅胶柱色谱石油醚-丙酮(9∶1)洗脱得化合物6(1.8 mg)。Fr.3.3(2.3 g)经Sephadex LH-20(甲醇)洗脱得4个流分Fr.3.3.1~Fr.3.3.4。Fr.3.3.1(383.4 mg)经反复硅胶柱色谱石油醚-丙酮(15∶1)洗脱,再经Sephadex LH-20(甲醇)分离纯化得化合物5(8.4 mg)。Fr.4(42.0 g)经Rp-18反相柱色谱梯度洗脱得7个流分Fr.4.1~Fr.4.7。Fr.4.3(670 mg)经反复硅胶柱色谱,石油醚-丙酮(40∶1)洗脱,再经Sephadex LH-20(甲醇)分离纯化得化合物1(3.1 mg)。Fr.5(29.0 g)经Rp-18反相柱色谱梯度洗脱得3个流分Fr.5.1~Fr.5.3。Fr.5.2(4.3 g)经反复硅胶柱色谱,石油醚-丙酮(10∶1)洗脱,再经Sephadex LH-20(甲醇)分离纯化得化合物16(4.9 mg)和15(5.7 mg)。Fr.5.3(11.7 g)经反复硅胶柱色谱,石油醚-丙酮(8∶1)洗脱,再经Sephadex LH-20(甲醇)分离纯化得化合物17(2.1 mg)。Fr.6(5.8 g)经Rp-18反相柱色谱梯度洗脱得5个流分Fr.6.1~Fr.6.5。Fr.6.3(1.1 g)经Sephadex LH-20(甲醇)洗脱得3个流分Fr.6.3.1~Fr.6.3.3。Fr.6.3.3(73.7mg)经硅胶柱色谱,石油醚-丙酮(3∶1)洗脱,再经Sephadex LH-20(甲醇),重结晶得到化合物2(7.8 mg)。Fr.8(3.1 g)经Rp-18反相柱色谱梯度洗脱得6个流分Fr.8.1~Fr.8.6。Fr.8.3(40.3 mg)经硅胶柱色谱,石油醚-丙酮(10∶1)洗脱得化合物4(1.8 mg)。Fr.8.5(96 mg)经Sephadex LH-20(甲醇)洗脱得4个流分Fr.8.5.1~Fr.8.5.4。Fr.8.5.1(130 mg)经硅胶柱色谱,石油醚-氯仿-丙酮(10∶10∶1)洗脱,再经Sephadex LH-20(甲醇)纯化分离得到化合物10(8.8 mg)。Fr.9(4.2 g)经Rp-18反相柱色谱梯度洗脱得3个流分Fr.9.1~Fr.9.3。Fr.9.2(142.3 mg)经硅胶柱色谱,氯仿-甲醇(50∶1)洗脱得化合物9(3.3 mg)和11(3.9 mg)。Fr.9.3(132.2 mg)经Sephadex LH-20(甲醇)洗脱得3个流分Fr.9.3.1~Fr.9.3.3。Fr.9.3.2(78 mg)经硅胶柱色谱,石油醚-氯仿-丙酮(3∶1∶1)洗脱,再经Sephadex LH-20(甲醇)纯化分离得到化合物18(7.6 mg)和3(2.6 mg)。Fr.9.3.3(16.3 mg)经硅胶柱色谱,石油醚-氯仿-丙酮(5∶1∶1)洗脱,再经Sephadex LH-20(甲醇)纯化分离得到化合物14(4.2 mg)、13(4.3 mg)和7(3.6 mg)。Fr.10(2.3 g)经Rp-18反相柱色谱梯度洗脱得5个流分Fr.10.1~Fr.10.5。Fr.10.2(341 mg)经硅胶柱色谱,氯仿-甲醇(50∶1)洗脱得化合物8(2.3 mg)。Fr.10.3(63.2 mg)经硅胶柱色谱,氯仿-甲醇(60∶1)洗脱得化合物12(3.3 mg)。
1.3 化合物的体外抗炎活性及细胞毒活性研究
体外抗炎活性实验以槲皮素为阳性对照,采用脂多糖(LPS)诱导小鼠单核巨噬细胞(RAW 264.7),分别设置LPS诱导组、空白对照组和实验组。将待测样品分为5个浓度梯度:100、75、50、25和12.5 μmol/L。选取生长良好的RAW 264.7细胞,取100 μL细胞液以5 × 104个/mL密度接种于96孔板上,于37 ℃、5% CO2、90%以上湿度条件下培养24 h,分别加入50 μL LPS(终浓度0.5 μg/mL)和50 μL待测化合物溶液(100~12.5 μmol/L)。继续培养24 h后每孔取100 μL上清液于新的96孔板中,之后向每孔加入100 μL的Griess试剂。在酶标仪540 nm波长下检测并记录每孔的OD值(吸光度),采用Griess法测定化合物对NO释放的抑制率,绘制化合物浓度-抑制率曲线图,计算半数抑制浓度(IC50值)[5-7]。
采用MTT法对化合物的细胞毒活性进行筛选:实验所用肿瘤细胞系为K562、BEL-7402、SGC-7901、A549及Hela,以盐酸阿霉素为阳性对照,DMSO为阴性对照。根据初筛抑制率设置待测化合物浓度(100、50、25、12.5和6.25 μmol/L)。分别在96孔板上接种100 μL浓度约5 × 104个/mL的待测细胞,培养24 h后(培养条件:37 ℃、5% CO2、90%以上湿度,含有10%小牛血清的四甲基偶氮唑蓝培养),加入100 μL待测化合物溶液培养72 h后观察细胞形态。再向每孔细胞中加入15 μL(5 mg/mL)的MTT溶液,37 ℃条件下反应4 h后吸弃上清液,继续向每孔加入100 μL的DMSO,使其充分溶解。在酶标仪490 nm波长下检测并记录每孔的OD值(吸光度),计算肿瘤细胞生长抑制率及半数抑制浓度(IC50值)[8]。
比较文学的理论和方法,新加坡学界其实并不陌生。早在1973年,本地学者王润华教授便已在南洋大学开设了“比较文学概论”和“西方汉学研究”的课程,向中文系学生介绍比较文学的学科理论和研究方法,进而引导学生将它们应用到中国文学的研究上。回顾这段教学经历,王润华教授有这样的描述:
2 实验结果
2.1 结构鉴定

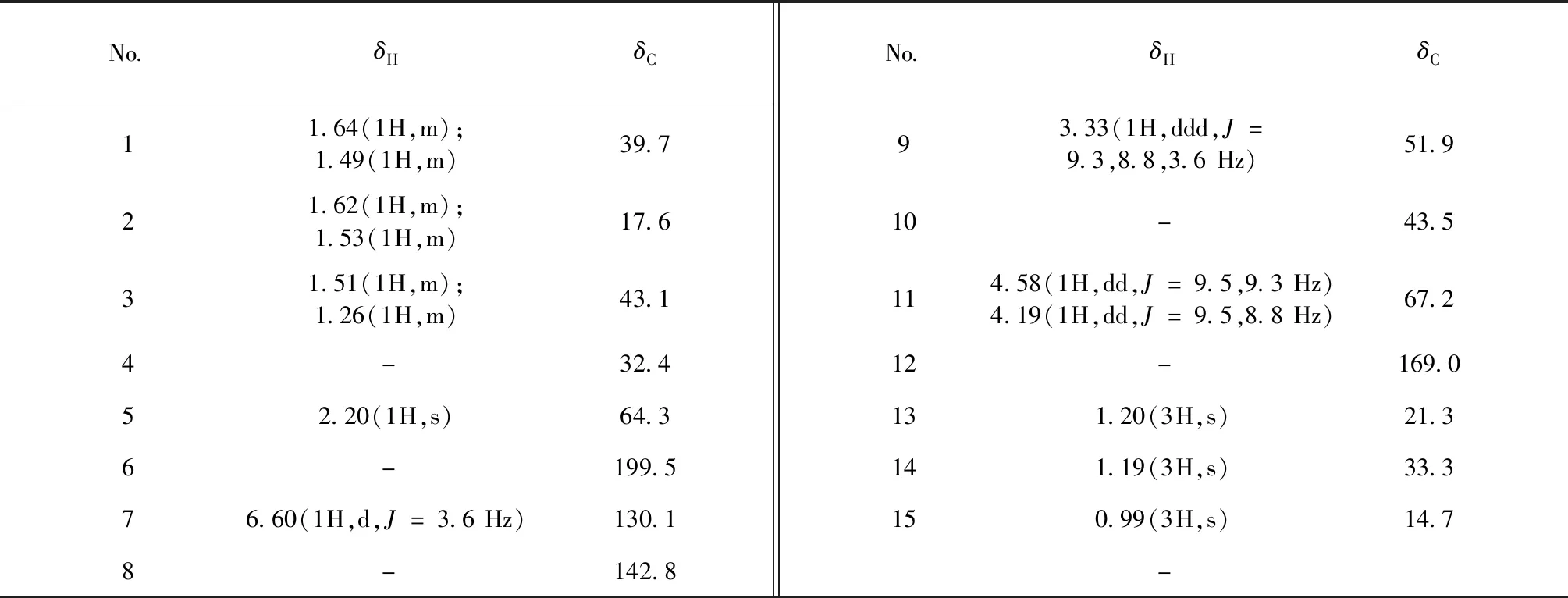
表1 化合物1的核磁1H和13C NMR数据(500和125 MHz,CDCl3)Table 1 The 1H and 13C NMR date of compound 1(500 and 125 MHz,CDCl3)

图1 化合物1的关键2D NMR相关信号Fig.1 Key 2D NMR correlations of compound 1

化合物3黄色粉末(MeOH);ESI-MS:m/z287.1 [M+H]+,分子式C15H10O6;1H NMR(500 MHz,CD3OD)δ:8.11(2H,d,J= 8.8 Hz,H-2′,-6′),7.93(2H,d,J= 8.8 Hz,H-3′,-5′),6.42(1H,s,H-8),6.21(1H,s,H-6);13C NMR(125 MHz,CD3OD)δ:146.9(C-2),136.5(C-3),176.1(C-4),160.8(C-5),98.3(C-6),165.4(C-7),94.0(C-8),158.8(C-9),103.5(C-10),121.9(C-1′),129.2(C-2′,-6′),115.8(C-3′,-5′),159.7(C-4′)。以上数据与文献[11]报道基本一致,故鉴定化合物3为山柰酚。
化合物4白色粉末(CHCl3);ESI-MS:m/z413.3 [M+H]+,分子式C28H44O2;1H NMR(500 MHz,CDCl3)δ:5.38(1H,d,J= 5.5 Hz,H-7),5.25(1H,dd,J= 15.1,7.4 Hz,H-23),5.18(1H,dd,J= 15.1,8.2 Hz,H-22),1.11(3H,s,H-19),1.05(3H,d,J= 6.6 Hz,H-28),0.94(3H,d,J= 6.9 Hz,H-27),0.88(3H,d,J= 6.2 Hz,H-26),0.87(3H,d,J= 7.5 Hz,H-21),0.62(3H,s,H-18);13C NMR(125 MHz,CDCl3)δ:31.7(C-1),31.0(C-2),67.9(C-3),39.6(C-4),37.3(C-5),73.8(C-6),117.7(C-7),144.2(C-8),76.1(C-9),43.9(C-10),23.1(C-11),39.4(C-12),43.6(C-13),54.9(C-14),22.8(C-15),28.1(C-16),56.1(C-17),12.5(C-18),19.0(C-19),40.6(C-20),22.2(C-21),132.3(C-22),135.5(C-23),43.0(C-24),33.2(C-25),19.8(C-26),20.1(C-27),17.7(C-28)。以上数据与文献[12]报道基本一致,故鉴定化合物4为6,9-环氧-麦角甾-7,22-二烯-3-醇。



化合物11白色粉末(CHCl3);ESI-MS:m/z566.4 [M+H]+,分子式C30H55N5O5;1H NMR(500 MHz,CDCl3)δ:7.34~8.01(5H,m,-NH-7,-14,-21,-28,-35),4.58(1H,m,H-30),4.47(1H,m,H-23),4.17(1H,m,H-2),4.13(1H,m,H-16),0.97(3H,s,H-34),0.96(3H,s,H-27),0.96(3H,s,H-20),0.95(3H,s,H-13),0.95(3H,s,H-6),0.94(3H,s,H-19),0.93(3H,s,H-33),0.91(3H,s,H-26),0.90(3H,s,H-5),0.89(3H,s,H-12);13C NMR(125 MHz,CDCl3)δ:172.4(C-1),57.1(C-2),38.9(C-3),25.0(C-4),10.9(C-5),15.8(C-6),173.7(C-8),59.4(C-9),36.4(C-10),25.5(C-11),10.8(C-12),15.7(C-13),172.3(C-15),54.0(C-16),39.9(C-17),25.4(C-18),22.4(C-19),22.8(C-20),172.5(C-22),52.4(C-23),41.7(C-24),25.3(C-25),23.0(C-26),22.1(C-27),173.6(C-29),51.9(C-30),39.7(C-31),25.2(C-32),22.9(C-33),22.0(C-34)。以上数据与文献[19]报道基本一致,故鉴定化合物11为viscumamide。
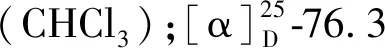
化合物13黄色粉末(MeOH);ESI-MS:m/z193.1 [M+H]+,分子式C10H8O4;1H NMR(500 MHz,CDCl3)δ:7.88(1H,d,J= 9.4 Hz,H-4),7.13(1H,s,H-8),6.79(1H,s,H-5),6.23(1H,d,J= 9.4 Hz,H-3),3.90(3H,s,6-OCH3);13C NMR(125 MHz,CDCl3)δ:164.1(C-2),112.6(C-3),146.1(C-4),108.1(C-5),146.5(C-6),147.1(C-7),104.0(C-8),151.4(C-9),110.0(C-10),56.8(6-OCH3)。以上数据与文献[21]报道基本一致,故鉴定化合物13为scopoletin。
化合物14白色粉末(MeOH);ESI-MS:m/z225.1 [M+H]+,分子式C13H20O3;1H NMR(500 MHz,CDCl3)δ:5.77~5.90(3H,m,H-4,-7,-8),4.34(1H,m,H-9),2.50(1H,d,J= 16.9 Hz,H-2b),2.18(1H,d,J= 16.9 Hz,H-2a),1.93(3H,d,J= 1.3 Hz,H-11),1.26(3H,d,J= 6.5 Hz,H-10),1.06(3H,s,H-13),1.04(3H,s,H-12);13C NMR(125 MHz,CDCl3)δ:42.4(C-1),50.7(C-2),201.2(C-3),127.1(C-4),167.5(C-5),80.0(C-6),136.9(C-7),130.0(C-8),68.7(C-9),23.8(C-10),19.6(C-11),23.5(C-12),24.5(C-13)。以上数据与文献[22]报道基本一致,故鉴定化合物14为corchoionol C。
化合物15淡黄色粉末(MeOH);ESI-MS:m/z176.1 [M+H]+,分子式C10H9O2N;1H NMR(500 MHz,CDCl3)δ:8.07(1H,d,J= 6.7 Hz,H-4),7.98(1H,s,H-2),7.43(1H,d,J= 6.9 Hz,H-7),7.23(1H,dd,J= 7.2,5.7 Hz,H-5),7.20(1H,dd,J= 7.0,5.8 Hz,H-6),3.90(3H,s,-OCH3);13C NMR(125 MHz,CDCl3)δ:133.2(C-2),108.2(C-3),121.9(C-4),122.5(C-5),123.7(C-6),112.9(C-7),168.8(C-8),127.3(C-3′),138.1(C-7′),51.4(9-OCH3)。以上数据与文献[23]报道基本一致,故鉴定化合物15为吲哚-3-甲酸甲酯。
化合物16褐色固体(CHCl3);ESI-MS:m/z195.1 [M+H]+,分子式C10H10O4;1H NMR(500 MHz,CDCl3)δ:11.01(1H,s,-OH),7.57(1H,dd,J= 8.4,7.4 Hz,H-5),7.05(1H,d,J= 7.4 Hz,H-4),7.01(1H,d,J= 8.4 Hz,H-6),4.65(1H,m,H-3),4.64(1H,m,H-1′),1.54(3H,d,J= 5.7 Hz,H-2′);13C NMR(125 MHz,CDCl3)δ:168.7(C-1),69.3(C-3),116.3(C-4),137.0(C-5),118.0(C-6),162.2(C-7),106.8(C-8),141.3(C-9),80.1(C-1′),18.1(C-2′)。以上数据与文献[24]报道基本一致,故鉴定化合物16为3ξ-(1ξ-羟基)-7-羟基-1-苯并异呋喃酮。
化合物17白色粉末(CHCl3);ESI-MS:m/z145.1 [M+Na]+,分子式C7H6O2;1H NMR(500 MHz,CDCl3)δ:9.91(1H,s,-CHO),7.83(2H,d,J= 8.5 Hz,H-2,-6),7.01(2H,d,J= 8.5 Hz,H-3,-5);13C NMR(125 MHz,CDCl3)δ:161.2(C-1),116.1(C-2,-6),132.5(C-4),130.4(C-3,-5),190.8(C-7)。以上数据与文献[25]报道基本一致,故鉴定化合物17为对羟基苯甲醛。
化合物18白色针晶(MeOH);ESI-MS:m/z317.3 [M+H]+,分子式C18H36O4;1H NMR(500 MHz,CDCl3)δ:3.39(2H,m,9,10-OH),2.29(2H,t,J= 7.4 Hz,H-2),0.97~1.56(28H,m),0.92(3H,t,J= 7.0 Hz,H-18);13C MR(125 MHz,CDCl3)δ:177.7(C-1),33.9(C-2),27.0(C-3),34.0(C-8),75.3(C-9/10),75.2(C-9/10),35.0(C-11),33.1(C-12),30.2~30.8(C-4,-7,-13,-14),27.1(C-15),26.2(C-16),23.7(C-17),14.4(C-18)。以上数据与文献[26]报道基本一致,故鉴定化合物18为9,10-二羟基十八烷酸。
化合物1~18的化学结构见图2。

图2 化合物1~18的化学结构Fig.2 Chemical structures of compounds 1-18
2.2 化合物的活性研究结果
实验初期对海滨大戟的粗提物进行抗炎活性测试,发现提取物具有较好的体外抑制脂多糖(LPS)诱导小鼠单核巨噬细胞RAW 264.7产生NO的活性(200 μg/mL浓度下,抑制率为83.97%),同时其对小鼠单核巨噬细胞RAW 264.7具有较强的细胞毒性(200 μg/mL浓度下,细胞毒性为96.55%),说明在海滨大戟中可能同时存在具有抗炎症活性成分和细胞毒活性成分。
化合物1~18进行体外抗炎活性测试,除化合物2具有较好的抑制LPS诱导小鼠单核巨噬细胞RAW 264.7产生NO的活性(IC5024.81 ± 1.58 μmol/L)外,其他化合物均没有此活性,阳性对照IC50为15.23 ± 0.65 μmol/L;MTT法测试了18个化合物对K562、BEL-7402、SGC-7901、A549和Hela五种肿瘤细胞系的体外生长抑制作用(以盐酸阿霉素为阳性对照:K562 IC500.07 ± 0.01 μmol/L、BEL-7402 IC500.47 ± 0.01 μmol/L、SGC-7901 IC500.22 ± 0.01 μmol/L、A549 IC500.47 ± 0.03 μmol/L和Hela IC500.28 ± 0.01 μmol/L),显示所筛选的化合物对以上五种肿瘤细胞均无活性。
3 讨论与结论
在前期研究基础上[27],我们对海滨大戟的化学成分及药理活性进行了研究,从乙醇提取物的乙酸乙酯部位中分离到包括倍半萜、黄酮、甾体、三萜、肽类以及其他结构类型化合物共计18个,并发现了一个抗炎症活性化合物6β-羟基肉桂内酯(2)。本研究得到的18个化合物均为首次从海滨大戟中分离得到,其中除化合物10、13、14和17外,其他化合物还是首次在大戟属分离得到,化合物1为一个新天然产物,本文中对该化合物的相关核磁数据进行了补充。通过本研究,基本了解了海滨大戟乙酸乙酯提取物的主要化学成分,为海滨大戟在民间药用提供了一定的科学依据。
致谢:化合物的波谱数据由中国热带农业科学院热带生物技术研究所海南省黎药资源天然产物研究与利用重点实验室测试中心测定。
