短周期叶用林模式下不同杜仲无性系枝皮化学成分分析
2022-11-26孟益德刘攀峰杜红岩杜庆鑫
孟益德,王 琦,刘攀峰,杜红岩,杜庆鑫*
1中国林业科学研究院经济林研究所;2经济林种质创新与利用国家林业和草原局重点实验室; 3国家林业草原杜仲工程技术研究中心,郑州 450003
杜仲(EucommiaulmoideOliv.),是第四纪冰川侵袭后留存于我国的单种属孑遗树种,也是我国重要的林源药用树种,自古以取皮入药而著称[1]。杜仲皮富含木脂素类、环烯醚萜类、苯丙素类、黄酮等化合物,例如,京尼平苷酸具有降血压和调节血压的功效,京尼平苷具有抗肿瘤活性和抗补体性,桃叶珊瑚苷具有较强的镇痛、抗菌消炎作用[2]。而木脂素类松脂醇二葡萄糖苷则是杜仲皮中已知的、具有降血压功效的活性成分,因此,杜仲皮作为中药在医疗保健等方面起着十分重要的作用[3,4]。
随着杜仲全树综合开发利用理念的提出,杜仲的栽培模式也由传统的药用栽培模式发展至果用杜仲栽培模式、雄花用栽培模式、材药兼用栽培模式以及叶用栽培模式等多种经营模式[5]。杜仲叶用林栽培模式利用杜仲萌芽能力强的特性,使经营周期缩短,极大提高了杜仲叶、皮的产量和质量,经济效益显著[6]。有研究对传统乔林和叶用林模式杜仲叶中化学成分进行了比较分析,发现次生代谢物可有效区分乔林与叶林[7]。此外,叶用林相较于乔林模式的杜仲叶及皮中绿原酸含量更高,确定了叶用林栽培为最佳栽培模式[8]。另有研究认为施用外源激素可显著提高短周期叶林杜仲叶及皮的胶含量[9]。但是对叶用林栽培模式下不同杜仲无性系间枝皮化学成分研究尚未开展,限制了叶用林栽培模式下枝皮资源开发利用。
顶空固相微萃取(HS-SPME)是一种集萃取、浓缩和解吸于一体的样品预处理技术,该方法操作简便、用样量少、无繁杂的前处理过程,同时可以避免样品中不稳定成分的氧化和分解[10]。近年来与气相质谱(GC-MS)相结合,已被广泛应用于植物挥发性成分的研究[11,12]。研究表明,很多挥发性物质成分不仅可直接抗虫、入药,或作为有机合成的先导成分,而且又是植物各代谢途径的重要中间体,对分析植物代谢网络和研究植物自身防御反应等具有一定的指导作用[13]。傅里叶变换红外光谱(FTTR)也是质量评价中常用的分析方法,可对样品进行整体上定性分析,具有快速、准确、无损的特点[14]。因此,本研究采用高效液相色谱法(HPLC)对短周期叶用林栽培模式下8个杜仲无性系枝皮7种主要活性成分的含量进行测定,结合顶空固相微萃取-气质联用(HS-SPME-GC-MS)技术分析其挥发性成分,找出不同无性系杜仲枝皮中差异性挥发物质,并利用红外光谱进行比较分析。初步判定各无性系的化学特征,以期为杜仲短周期叶用林模式下枝皮的质量控制、定向培育以及资源开发利用提供科学依据。
1 材料与方法
1.1 试验材料
以短周期叶用林栽培模式下2年生8个杜仲无性系为实验材料,2020年10月对萌发的枝条进行平茬处理,收集平茬后的枝条剥皮,低温冷藏带回实验室烘干至恒重,经中国林业科学研究院经济林研究所孙志强研究员鉴定为杜仲科植物杜仲EucommiaulmoideOliv.的干燥枝皮。所有枝皮均采自河南省新乡市原阳县中国林业科学研究院经济林研究所原阳试验基地(34°55′N,113°36′E),试验地所属气候类型为暖温带大陆性季风气候,四季分明,年均日照时数2 324.5 h,年平均气温14.4 ℃,年温差27.6 ℃,平均年降水量571.7 mm,栽培条件以及管理方式基本一致。8个杜仲无性系编号分别为EU1、EU2、EU3、EU4、EU5、EU6、EU7、EU8。
1.2 仪器与试剂
ACQUITY Arc型高效液相色谱仪,配置2998 PDA型二极管阵列检测器(美国Waters公司);Trace 1310型气相色谱联用ISQ QD型单四级杆质谱仪(美国Thermo Fisher Scientific公司);Nicolet iS50傅里叶变换红外光谱仪(美国Thermo Fisher Scientific公司);65 μm PDMS/DVBSPME固相微萃取针(美国Supelco公司);XS204万分之一电子天平(梅特勒?托利多上海仪器有限公司);HT-300 BQ超声波清洗机(济宁天华超声电子仪器有限公司);5430 R高速冷冻离心机(德国Eppendorf公司);Milli-Q Integral超纯水机(美国Merck Millipore公司)。
儿茶素(批号:CDZE-B21722)购自上海源叶生物科技有限公司(纯度≥98%);桃叶珊瑚苷(批号:CDAA-280431)、绿原酸(批号:CDAA-280804)、京尼平苷(批号:CDAA-280017)、正构烷烃混标C10~C25(CDAA-M-690035-HD)购自上海安谱实验科技股份有限公司(纯度≥98%);京尼平苷酸(批号:MUST-21062003)、松脂醇二葡萄糖苷(批号:MUST-21032510)、紫云英苷(批号:MUST-21022410)购自成都曼思特生物科技有限公司(纯度≥98%);乙腈和甲醇为色谱纯(湖北弗顿科学技术有限公司),甲酸为分析纯(上海麦克林生化科技有限公司),水为超纯水。
1.3 主要活性成分测定
1.3.1 样品制备
分别精密称取干燥粉碎后的杜仲枝皮样品粉500 mg,每份样品中加入60%甲醇水溶液,混匀超声提取30 min,样品和提取液比例为1∶20,于4 ℃冰箱静置过夜。12 000 r/min离心10 min,取上清液,过微孔滤膜(0.22 μm),置于液相进样瓶中待测,每个样品制备3个生物学重复。
1.3.2 HPLC色谱条件
色谱测定条件参考孙佳等[15]的方法并稍做修改。色谱柱:赛默飞Syncronis C18(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.2%甲酸溶液(B),梯度洗脱(0~10 min,5%→17% A;10~25 min,17%→20% A;25~30 min,20%→30% A;30~50 min,30%→50% A;50~55 min,50%→70% A;55~57 min,70%→5% A);检测波长:0~9 min于204 nm处测定桃叶珊瑚苷,9~11 min于239 nm处测定京尼平苷酸,11~15.4 min于325 nm处测定绿原酸,15.4~16 min于276 nm处测定儿茶素,16~17 min于239 nm处测定京尼平苷,17~18 min于276 nm处测定松脂醇二葡萄糖苷,18~50 min于364 nm处测定紫云英苷;流速:0.8 mL/min;柱温:30 ℃;进样量:5 μL。混合标准品溶液(A)及杜仲叶片样品溶液(B)的HPLC色谱图见图1。
精密称取桃叶珊瑚苷、京尼平苷酸、绿原酸、儿茶素、京尼平苷、松脂醇二葡萄糖苷、紫云英苷的标准品各适量,置于同一量瓶中,加甲醇溶解并配制成质量浓度分别为0.4、0.5、1、0.08、0.1、0.08、0.1 mg/mL的混合标准品溶液。分别精密吸取混合标准品溶液2、4、5、6、7、8 μL进样分析,测定其峰面积。以各待测成分进样量(x,μg)为横坐标、峰面积(y)为纵坐标进行线性回归,分别得到以下回归方程。桃叶珊瑚苷:y=3.0×106x+14 903(R2=0.999 1),京尼平苷酸:y=1.0×107x-55 546(R2=0.999 4),绿原酸:y=2.0×107x+2.0×106(R2=0.998 3),儿茶素:y=2.0×107x-7 632(R2=0.999 8),京尼平苷:y=1.0×107x+11 429(R2=0.998 4),松脂醇二葡萄糖苷:y=4.0×106x+8 766.7(R2=0.998 8),紫云英苷:y=1.0×107x-61 050(R2=0.999 1)[16]。

图1 混合标准品溶液(A)及样品溶液(B)的HPLC色谱图Fig.1 HPLC chromatograms of mixed standard solution (A) and sample solution (B)注:1.桃叶珊瑚苷;2.京尼平苷酸;3.绿原酸;4.儿茶素;5.京尼平苷;6.松脂醇二葡萄糖苷;7.紫云英苷。Note:1.Aucubin;2.Geniposidic acid;3.Chlorogenic acid;4.Catechin;5.Geniposide;6.Pinoresinol diglucoside;7.Astragaline.
1.4 挥发性成分的测定
1.4.1 样品处理
将粉碎后枝皮样品粉0.7 g、饱和氯化钠3.6 g以及12 mL水置于顶空瓶中,顶空萃取瓶置于70 ℃下平衡20 min后,插入在GC进样口250 ℃温度下老化1 h的萃取头,磁力搅拌吸附萃取40 min。然后将萃取头转移至220 ℃的气相色谱进样口中以无分流方式热解析3 min,进行GC-MS检测分析。
1.4.2 GC-MS条件
GC条件:色谱柱型号为TG-WAXMS毛细管柱(30 m×0.25 mm×0.25 μm)。色谱条件:升温程序:起始温度50 ℃保持3 min,以5 ℃/min升至70 ℃,然后以2 ℃/min升至160 ℃,最后以3 ℃/min升至220 ℃,保持10 min。载气为高纯氦气(99.999%),流速为1 mL/min,传输线温度为250 ℃,进样口温度为220 ℃,解吸温度为220 ℃。
MS条件:电子轰击(EI)离子源,电子能量70 eV,灯丝延迟180 s,离子源温度280 ℃。质量扫描范围:m/z40~500,扫描方式为全扫描。
1.4.3 定性定量分析
将GC-MS测定后未知化合物质谱图经AnalysisBaseFileConverter软件转换为分析基本文件abf格式,之后导入MS-DIAL软件对原始图谱进行峰检测、峰识别、解卷积、定性、峰对齐、滤波、保留时间校正等处理,代谢物注释基于气相色谱保留指数(retention index,RI)以及专用代谢MoNA volatile数据库,采用谱库结合线性保留指数对各组分进行定性,筛选出匹配度在80%以上的化合物[17]。根据正构烷烃的保留时间计算各物质的保留指数,正构烷烃的碳原子数为C10~C25,保留指数(RI)=100n+(RTX-RTn)/(RTn+1-RTn)×100,式中n为该化合物前一正构烷烃所含碳原子数;RTX表示该物质的保留时间;RTn表示该物质前一正构烷烃的保留时间;RTn+1表示该物质后一正构烷烃的保留时间。得到原始数据矩阵后导出于Excel表中,采用峰面积归一化法,以各挥发组分的峰面积占总峰面积之比值表示组分相对含量,结果取3次重复的平均值表示。
1.5 红外光谱测定
取8个杜仲无性系枝皮各约2 mg与KBr 200 mg混合研磨均匀,手动压片机压成均匀透明薄片后扫描获得红外光谱图,同一样品测定3次重复,扫描光谱范围4 000~400 cm-1,分辨率为4 cm-1,扫描次数为32次。
1.6 数据分析
采用Excel软件进行数据统计分析,利用SIMCA-P软件进行聚类分析(HCA)和主成分分析(PCA),偏最小二乘法-判别分析(PLS-DA)模型计算变量重要性投影VIP值[18]。
2 结果与分析
2.1 不同杜仲无性系枝皮主要活性成分含量比较
短周期叶用林模式下不同杜仲无性系枝皮的主要活性成分含量如表1所示。环烯醚萜类物质桃叶珊瑚苷、京尼平苷酸和京尼平苷在杜仲枝皮中含量较高,平均含量分别为24 807、11 524、6 252 μg/g,儿茶素含量较低为66 μg/g。桃叶珊瑚苷、京尼平苷酸在无性系EU5中含量最高,京尼平苷和松脂醇二葡萄糖苷在EU4中含量最高,而苯丙素类物质绿原酸和儿茶素在EU7中含量最高,无性系EU2中黄酮类物质紫云英苷含量较高。上述结果表明,不同无性系杜仲枝皮各活性成分之间存在显著差异。

表1 不同杜仲无性系枝皮的活性成分含量Table 1 Content of active components in the branch bark of different E.ulmoides clones(μg/g)
2.2 不同杜仲无性系枝皮挥发性成分分析
2.2.1 挥发性物质总离子流图
短周期叶用林模式下不同杜仲无性系枝皮挥发性成分的GC-MS总离子流图如图2所示,TIC图提供了在不同时间点质谱中所有离子强度之和的连续描述,宏观反映所有挥发性物质在气相色谱分离情况。从图2可以直观地看出,8个无性系之间挥发性物质峰高、峰面积存在较大的差异。

图2 不同杜仲无性系枝皮挥发性成分总离子流色谱图Fig.2 Total ion chromatogram of volatile components in branch bark of different E.ulmoides clones
2.2.2 挥发性物质种类及含量
不同杜仲无性系枝皮的主要挥发性成分见表2,共在8个无性系中分离鉴定出70种挥发性成分,包括酯类(24种),醇类(16种),醛类(12种),萜类(7种),酮类(5种),内酯(3种),烯类(3种)。无性系EU1相对含量在1%以上的化合物共检测出34种挥发成分,包括8种醇、11种醛、7种酯、3种萜、2种酮、2种内酯和1种烯,EU2检测出33种挥发成分,包括7种醇、9种醛、7种酯、4种萜、3种酮、2种内酯和1种烯,无性系EU3和EU4均检测出32种挥发成分,EU3包括9种醇、9种醛、6种酯、4种萜、1种酮、2种内酯和1种烯,EU4包括7种醇、10种醛、7种酯、3种萜、2种酮、2种内酯和1种烯,EU5检测出33种挥发成分,包括8种醇、10种醛、7种酯、4种萜、1种酮、2种内酯和1种烯,EU6检测出37种挥发成分,包括8种醇、10种醛、8种酯、5种萜、3种酮、2种内酯和1种烯,EU7检测出33种挥发成分,包括8种醇、9种醛、9种酯、4种萜、1种酮和2种内酯,EU8检测出34种挥发成分,EU8相对于其他无性系枝皮检测出的酯类最多,为10种酯。
在检测的相对含量在1%以上的化学成分中,8个无性系杜仲枝皮中共有18种挥发性成分。而无性系EU1特有的挥发性成分为庚醛,EU6特有乙基芳樟醇、反式-2-己烯醇2种挥发性成分,EU7特有的挥发性成分为十三硫醇,EU8特有2种挥发性成分,为10-十一烯酸己酯和甲酸薄荷酯。在检测的相对含量在5%以上的挥发成分中,无性系EU1含有棕榈酸异辛酯、山嵛醇和月桂酸异丁酯3种挥发成分,EU2中包括异植物醇、2-(二甲氧基甲基)环戊酮、(Z)-9-庚烯、2-乙硫基乙醇和庚醛二甲基缩醛5种挥发成分,EU3包括十六醇、(Z)-9-庚烯和17-甲基十八酸甲酯3种挥发成分,EU4包括2-乙硫基乙醇、2-(二甲氧基甲基)环戊酮和庚醛二甲基缩醛3种挥发成分。无性系EU5中相对含量在5%以上的挥发成分有17-甲基十八酸甲酯、异植物醇和己醛二己基缩醛,EU7有17-甲基十八酸甲酯,EU8有异植物醇和短指软珊瑚内酯,这些挥发成分是杜仲枝皮的主要挥发物质。EU6挥发性物质相对含量均在5%以下。上述表明,采用HS-SPME结合GC-MS能够很好的表征不同杜仲无性系枝皮挥发性成分的组成信息。
8个杜仲无性系挥发物质含量有明显差异,萜类物质异植物醇在EU2、EU5以及EU8无性系中相对含量均最高,分别占7.24%、9.40%、6.35%。2-(二甲氧基甲基)环戊酮和2-乙硫基乙醇在EU2和EU4中相对含量均较高,月桂酸异丁酯在EU1和EU7中相对含量较高,分别为4.94%、5.13%,十六醇在EU3中相对含量最高为9.51%,而在其他无性系中相对含量不足2%。
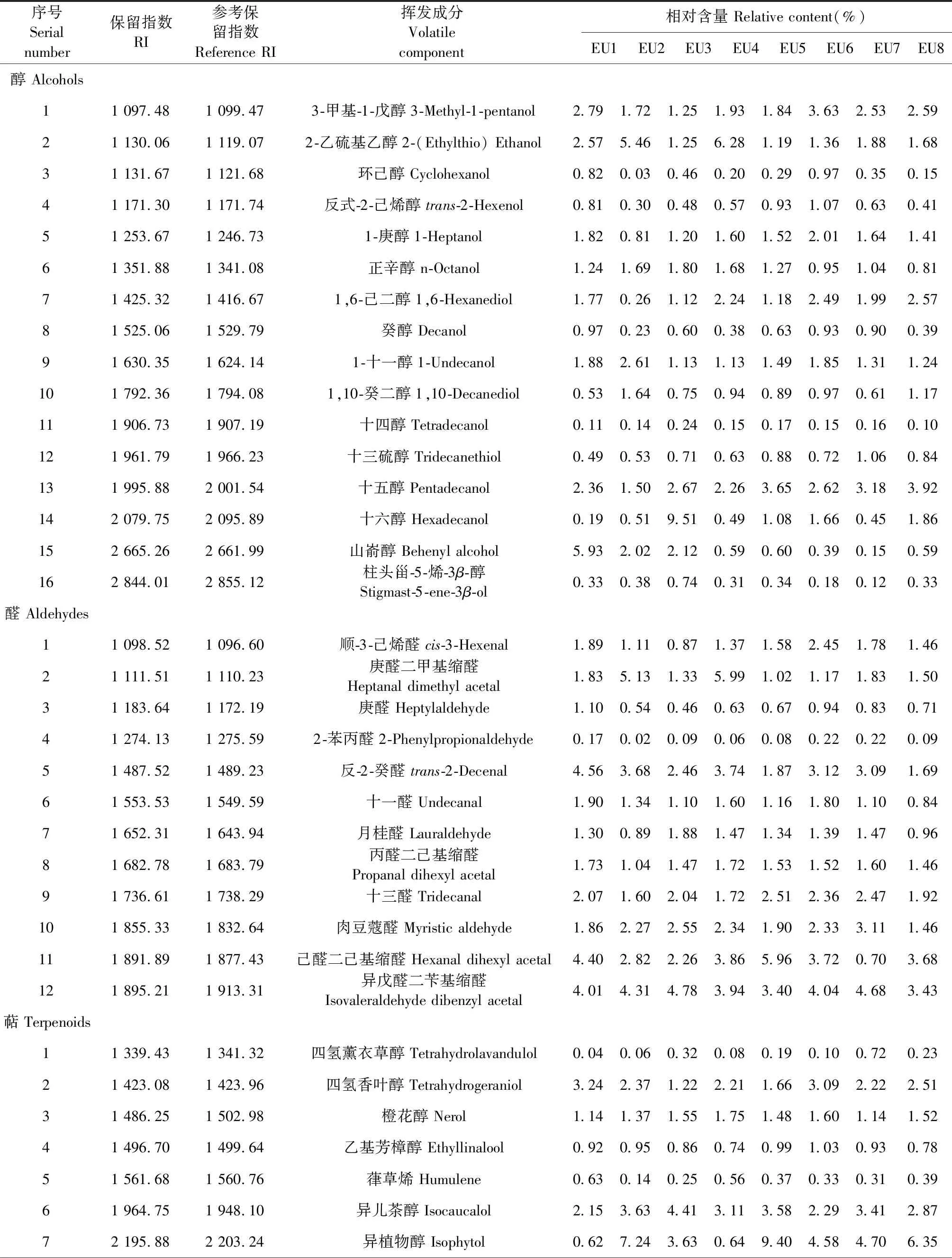
表2 不同杜仲无性系枝皮挥发性气体及相对含量Table 2 Relative content of volatile gases in branch bark of different E.ulmoides clones

续表2(Continued Tab.2)
2.2.3 挥发物质类别及含量
通过比较8个杜仲无性系枝皮中不同类别的挥发物质成分相对含量发现,如表3所示。醇类作为普遍性挥发性物质,在无性系EU3中相对含量最高,占总挥发物质成分的26.03%。EU1、EU2、EU4和EU6均以醛类物质相对含量最高,分别占总挥发物质成分的26.82%、24.75%、28.43%、25.06%,EU5、EU7、EU8均以酯类物质相对含量最高,分别占总挥发物质成分的26.31%、31.28%、29.25%,萜类物质在EU5中相对含量较高,这表明醇、醛、酯类是不同杜仲无性系枝皮的主要挥发物质成分。

表3 不同杜仲无性系枝皮中各类别挥发性成分相对质量分数Table 3 Relative mass fraction of various types of volatile components in the branch bark of different E.ulmoides clones
2.3 不同杜仲无性系枝皮的差异化物质成分
2.3.1 基于主要活性成分的不同杜仲无性系聚类和主成分分析
为进一步比较不同杜仲无性系枝皮活性成分的差异性,利用7种主要活性成分进行聚类和主成分分析,结果如图3、4所示。通过聚类分析可将杜仲8个无性系分为3组,分别为I组(EU1、EU4、EU5)、II组(EU3、EU4)、III组(EU2、EU6、EU8)。8个无性系主成分分析数据的总方差为97.5%,包含3种主成分,其中主成分1(PC1)的贡献率为79.90%,主成分2(PC2)的贡献率为9.55%,主成分3(PC3)的贡献率为7.99%。在第一维度(PC1)上,无性系EU1、EU4、EU5位于右侧,EU3、EU8位于左侧,EU2、EU6、EU7位于中间,这表明PC1可明显区分划分出的三个组别。且在PC1上对无性系EU1、EU4、EU5有贡献的活性成分主要是环烯醚萜类物质京尼平苷酸、京尼平苷、桃叶珊瑚苷。
2.3.2 不同无性系杜仲枝皮的差异挥发物质筛选
构建PLS-DA模型衡量不同组别之间的差异,明确不同杜仲无性系枝皮之间的差异挥发物质成分,结果如图5所示。在交互检验中,原始模型的R2Y和Q2分别为0.992和0.818,均超过0.8,表明PLS-DA模型没有过拟合,在置换检验中,置换后模型R2Y和Q2分别为0.964和0.225,均小于原始模型的R2Y和Q2,说明PLS-DA模型的数据可靠,可用于分析差异化挥发性物质。根据贡献值大于1从模型结果中筛选出22种挥发性物质,如表4所示,分别为溴化香叶酯、己醛二己基缩醛、葎草烯、丁酸香茅酯、环十二酮、乙酸油酯、四氢香叶甲酸酯、戊酸香茅酯、马来酸二丁酯、柱头甾-5-烯-3β-醇、十六醇、顺式橙花苷醋酸酯、棕榈酸异辛酯、乙酰丙酸己酯、(Z,Z)-9,12-十八碳二烯酸甲酯、十一醛、1-十一醇、顺-3-己烯醛、反式-2-己烯醇、1-庚醇、反-2-癸醛、丙酸薄荷酯,可将这些挥发物质成分作为8个杜仲无性系枝皮的特征物质,其主要为酯类挥发性成分。

图3 不同杜仲无性系的聚类分析Fig.3 Clustering analysis of different E.ulmoides clones

图4 不同杜仲无性系的主成分分析Fig.4 Principal component analysis of different E.ulmoides clones

图5 不同杜仲无性系PLS-DA分析Fig.5 PLS-DA analysis of different E.ulmoides clones
2.4 不同杜仲无性系枝皮的红外光谱分析
通过傅里叶红外光谱分析8个杜仲无性系的指纹图谱,如图6所示,发现红外信号峰部分波段的信号强度发生了改变。首先在3 400 cm-1处主要是材料中或者是空气中的-OH伸缩振动所引起的宽峰。2 900 cm-1绿色框标记区域是由杜仲枝皮中的氨基成分引起的多峰信号,主要是N-H键的伸缩振动和亚甲基饱和C-H键的伸缩振动,这是存在挥发性成分的特征表现[19]。所有样品在2 300 cm-1处都存在有个小的吸收波动,这是在红外测试过程中外界因素所诱发的。在1 737 cm-1处的振动主要是含有C=O键化合物的伸缩振动吸收峰。1 654 cm-1红外吸收峰是由杜仲枝皮中的烯烃物质造成的,归属于材料的C=C双键的伸缩振动,此处无性系EU3吸收较强可能与较高含量的(Z)-9-庚烯相关。1 600~1 170 cm-1绿色框标记主要是C-H键的对称变形振动和不对称变形振动所导致的振动峰群,此处官能团活性差异不明显。最后在1 053 cm-1处的红外信号是由C-O键的伸缩振动所引起的,此处无性系EU1、EU4和EU5具有较强的吸收峰,这可能与含有较多的环烯醚萜苷类成分有关。

表4 不同杜仲无性系枝皮筛选的差异挥发成分Table 4 Differential volatile components screened from branch bark of different E.ulmoides clones
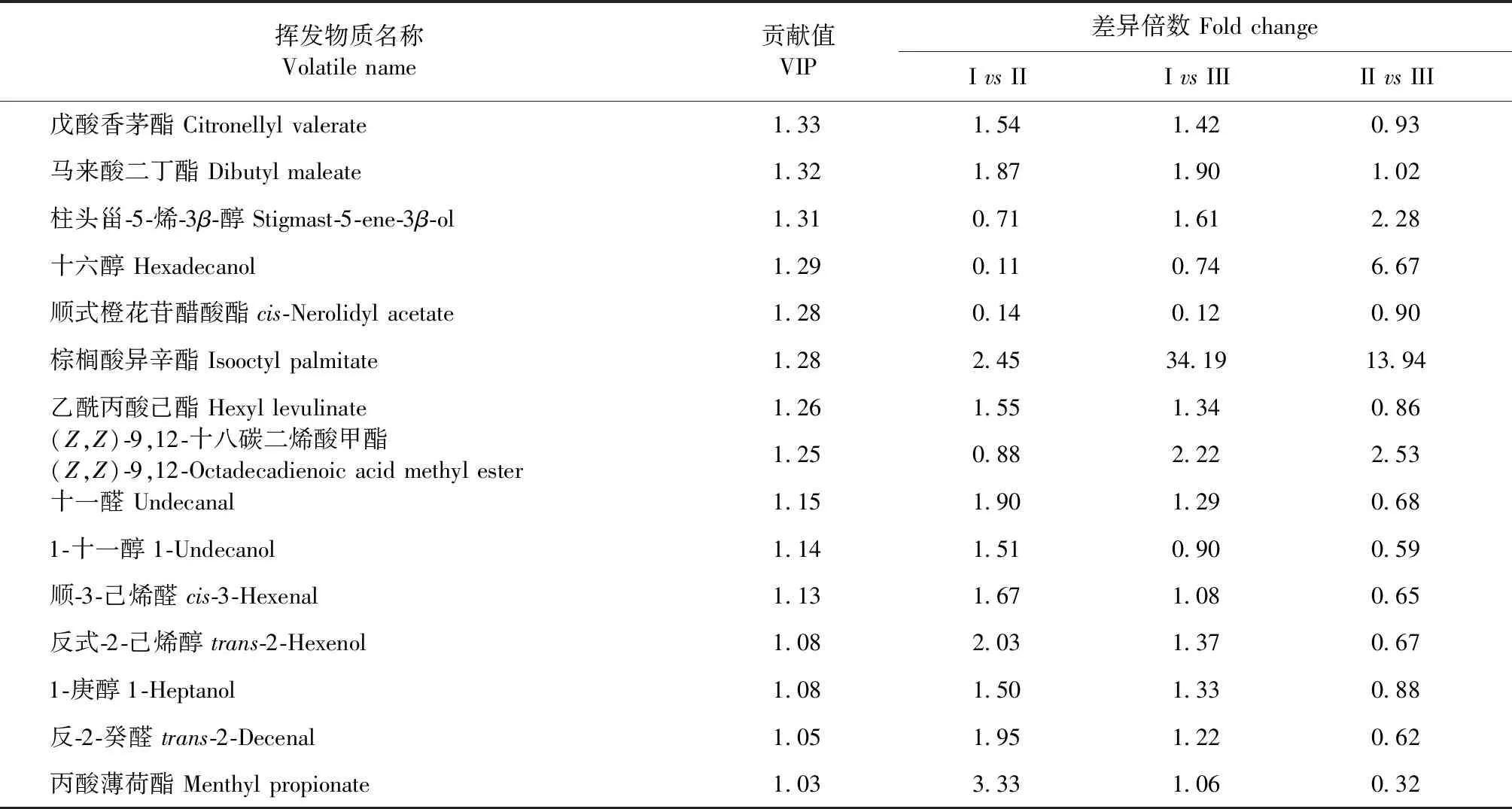
续表4(Continued Tab.4)

图6 不同杜仲无性系枝皮的傅里叶变换红外光谱Fig.6 Fourier transform infrared spectra of branch bark of different E.ulmoides clones
3 讨论与结论
本研究采用HPLC和HP-SPME-GC-MS对短周期叶用林模式下不同杜仲无性系枝皮的化学成分进行了定量检测分析,同时利用红外光谱进行了比较,提取出了8个无性系枝皮的指纹图谱,初步分析了化学成分和红外图谱的关系。发现8个杜仲无性系枝皮中各化学成分之间存在差异,7种主要活性成分中环烯醚萜类物质桃叶珊瑚苷、京尼平苷酸和京尼平苷在不同杜仲无性系枝皮中含量均较高,环烯醚萜类具有多种生物活性[20],因此,可对叶林模式下不同杜仲无性系枝皮中环烯醚萜类成分加以利用。Zhang等[21]发现杜仲枝皮中松脂醇二葡萄糖苷含量随树龄的增加呈而增加,故松脂醇二葡萄糖苷在老皮中含量高,新皮中含量较低。叶用林杜仲皮中标志性化合物松脂醇二葡萄糖苷平均含量相对较低,仅无性系EU1、EU4、EU7中含量大于0.1%,符合2 020版中药药典的要求,所以将松脂醇二葡萄糖苷作为药用质量指标时应选择这3个无性系杜仲枝皮加以利用。
植物特异性挥发性物质在植物信息的传递过程中起着重要的信号作用[22]。本研究利用植物代谢组学的策略,研究杜仲枝皮释放挥发性物质的种类和数量,植物代谢组所得数据需对所得数据进行峰对齐、切割、滤噪等预处理,因此选择了MS-DIAL软件对多个样本质谱峰进行特征峰匹配、对齐以及提取[23,24],结合数据库共检测出酯类、醇类、醛类、萜类、酮类、内酯、烯类7大类70种挥发物质成分。吴婷婷等[25]发现在茶树单作和花生+茶树间作模式中,醛类和脂类化合物是茶树总挥发物的主要组成部分,主要起着趋避害虫和引诱天敌的作用。醇、醛、酯类是不同杜仲无性系枝皮的主要挥发化合物,可能在趋避植食性昆虫防御中发挥着主要作用,有待进一步研究。异植物醇是由四个异戊二烯分子首尾相接而构成的双萜类的二十碳不饱和烯叔醇,是生产维生素E的主要原料,萜类物质异植物醇在无性系EU2、EU5以及EU8中相对含量均最高,且存在四氢香叶醇、乙基芳樟醇、橙花醇和葎草烯等萜烯类挥发物,具有抗炎、抑菌和抗肿瘤等药理[26],这对于杜仲枝皮进一步药用价值开发有一定的指导意义。
监督方法是用来探索完全未知数据特征的方法,根据样本特性对原始数据信息进行分类,将具有相似特征的目标数据归在同源的类中,并使用相应的可视化技术直观地表达出来,目前常见的无监督方法有聚类分析和主成分分析等[27]。本文利用UPLC测定数据进行聚类,将杜仲8个无性系分为3个组别,主成分分析提取出3个主成分,其中在第一维度上环烯醚萜类物质京尼平苷酸、京尼平苷、桃叶珊瑚苷贡献最大。并通过PLS-DA模型对杜仲枝皮挥发物质成分在不同无性系之间的差异作进一步分析,筛选出22种挥发性物质可将其作为差异挥发成分,主要为酯类挥发性成分。桃叶珊瑚苷、京尼平苷酸等环烯醚萜类物质是叶用林杜仲枝皮中主要次生代谢物质,且其合成前体是香叶醇等单萜类物质,因此,下一步可以考虑利用GC-MS技术进行杜仲枝皮萜烯类挥发物的靶向代谢组分析。此外,杜仲在幼年期均表现为相同的树皮特征,颜色呈青灰色,不开裂,皮孔显著,没有可以识别的形态特征[7],后期可将傅里叶变换红外光谱技术应用于叶用林模式下不同无性系杜仲皮的快速区分。
