一种含硫化合物对锂硫电池低温性能的影响
2022-11-26常世晔曾芳磊袁宁一
常世晔,曾芳磊,李 宁,袁宁一
(常州大学材料科学与工程学院,江苏常州 213164)
锂硫电池由于具有理论比能量高(2 600 Wh/kg)、价格低廉、环境友好等优势,被认为是下一代最具发展潜力的高比能量电池体系之一,近年来受到研究者们广泛关注[1-3]。但是由于锂硫电池的充放电中间产物-多硫化锂极易在电解液中溶解和扩散,使得锂硫电池存在非常严重的“穿梭效应”[4-6],使得其循环寿命短,阻碍了它的规模化应用。
随着电动交通工具的推广,人们也开始注意到温度对锂二次电池性能的影响。就锂硫电池而言,尽管醚类电解液凝固点较低,在-30~0 ℃内依然具有流动性,但是在低温环境下电解液粘度会变大使得溶液本体阻抗增大,电导率下降,锂离子迁移受到阻碍[7-9]。更重要的是硫正极的放电过程是一个多相反应过程,它的第一个放电平台对应着从可溶性的长链Li2S8转化为可溶性短链Li2S4,是在同一个液相中进行,相对来说化学反应比较充分;但是它的第二个放电平台对应可溶性Li2S4转化为固相Li2S2/Li2S的过程,这是一个液固过程,反应动力学较为缓慢;而且从Li2S2转变为Li2S 的固固过程动力学更加困难[10-13],因而在低温下锂硫电池的第二平台往往会缩短甚至消失,这是限制锂硫电池低温性能的最主要原因。
目前有关低温锂硫电池的研究还比较少,常见的改善措施有以下三种:(1)选择合适的锂盐,优化电解液组分的比例[14-15];(2)在电解液中添加合适的电荷转移中间体,改变多硫化锂的反应路径,加速化学反应[16-17];(3)制备具有催化效果的正极主体材料,加快多硫化物转化动力学[18-19]。Wang 等[20]通过在常规醚类电解液中添加烯丙基甲基二硫化物,保证了锂硫电池放电过程中的所有中间体均处于液态,改善了传统电解质中Li2S4与Li2S 之间缓慢的固体-固体转化过程,显著提高了锂硫电池在低温下的化学动力学。目前很多工作已证明了多硫键具有修复正极和改善硫化锂/硫沉积效果[21-23]。Zeng 等[23]将一种梳状离子导电有机聚硫化合物(PSPEG)用作锂硫电池粘结剂,发现PSPEG 粘结剂中的多硫键可以改善Li2S、Li2S2的沉积状态,提高锂硫电池电化学可逆性。
为了进一步探究含硫化合物是否具有改善锂硫电池低温性能的作用,本工作选择了分子结构中存在-S-S-键的硫辛酸(ALA)作为电解液添加剂,探究了其对锂硫电池低温性能的影响。
1 实验材料和方法
1.1 试剂和仪器
本实验所用化学试剂均为分析纯试剂。硫辛酸、1,3-二氧戊环(DOL)、乙二醇二甲醚(DME)、双三氟甲基磺酸酰亚胺锂(LiTFSI)和硝酸锂(LiNO3)从多多试剂网购得。粘结剂LA133 购于成都茵地乐电源科技有限公司。
电池组装在单面双工位手套箱[FLEX(2440/750),天津艾明坷机电设备有限公司]中完成;利用纽扣电池封口机(MSK-110,深圳市科晶智达科技有限公司)完成电池密封步骤;组装好的扣式电池通过新威电池测试仪(CT4008,深圳新威电子有限公司)进行循环性能等测试;通过电导率仪(DDB-303A,上海仪电科学仪器股份有限公司)完成电导率测试。
1.2 扩散实验
Li2S6的配制:将Li2S 和S 以化学计量比为1∶5 溶解在乙二醇二甲醚(DME)和1,3 二氧戊环(DOL)混合溶液(体积比为1∶1),在60 ℃下搅拌24 h,制得Li2S6溶液。Li2S6的浓度为0.05 mol/L。
配制空白的DOL/DME(体积比为1∶1)溶液。
H 型电解池中间放置Celgard 2325 隔膜,并用夹子夹紧,然后同时加入适量的0.05 mol/L Li2S6DOL/DME(体积比为1∶1)溶液(左侧)和DOL/DME(体积比为1∶1)溶液(右侧),在不同温度下静置24 h,观察Li2S6扩散情况。
1.3 电导率测试
配制以下8 种电解液(表1),并将配制好的电解液置于低温箱中静置,用数字电导率仪测量不同温度下电解液的离子电导率。
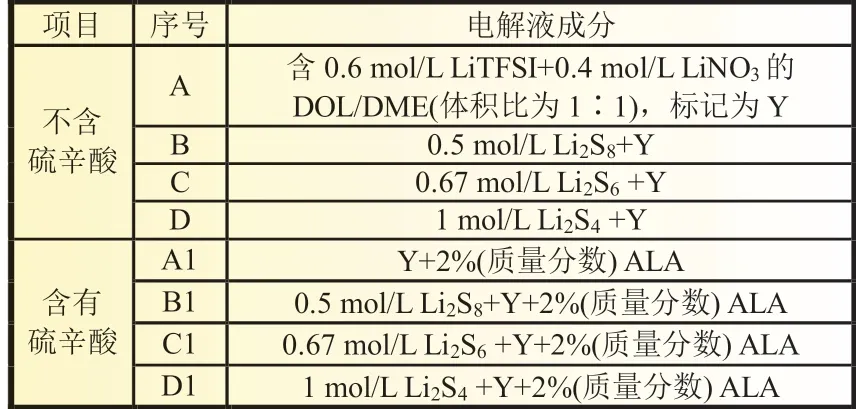
表1 不同电解液的成分
离子电导率与温度之间的关系近似符合Arrhenius 方程:
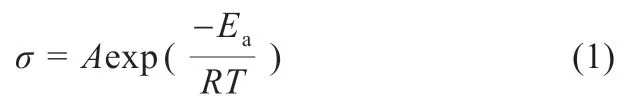
式中:σ为离子电导率;Ea为离子迁移活化能;A为指前因子;R为理想气体常数。
1.4 极片的制备
首先按照质量比(7∶2∶1)称取活性物质(单质硫)、导电剂(乙炔黑)和粘结剂(LA133),然后将其分别置于适量的分散剂(正丙醇/高纯水,体积比为1∶3)中,磁力搅拌混合12 h 得到电极浆料。随后,将制得的电极浆料均匀地涂覆在铝箔集流体上。自然晾干后再在60 ℃真空干燥24 h,最后用切片机将极片裁成直径14 mm 的圆形极片,即为正极极片,极片的硫载量为1.2 mg/cm2。
1.5 扣式电池组装与测试
采用金属锂片做负极;制备的极片为正极,Celgard 2325膜为隔膜,在充满氩气的手套箱中组装2025 型扣式电池,使用电解液为不含硫辛酸且溶有0.6 mol/L LiTFSI 和0.4 mol/L LiNO3的DOL/DME(体积比为1∶1)溶液以及含有2%(质量分数)硫辛酸(ALA)并溶有0.6 mol/L LiTFSI以及0.4 mol/L LiNO3的DOL/DME(体积比为1∶1)溶液。手套箱内的水值与氧值都小于0.1×10-6。电解液用量(μL)/活性硫质量(mg)比为10。电池在测试前经过12 h 的静置。采用新威电池测试仪CT4008对电池进行恒流充放电测试,充放电截至电压范围为1.7~2.8 V,电池的比容量按硫计算。使用上海辰华生产的CHI660E电化学工作站进行循环伏安测试,扫描速率为0.1 mV/s。
2 结果与讨论
2.1 电化学性能表征
首先,使用未添加和添加了2%(质量分数)硫辛酸(ALA)的电解液对电池在不同温度下的循环性能进行测试(图1 中RT 表示室温),电池先在0.1C下充放电2 次,随后在0.2C下进一步充放电循环测试。
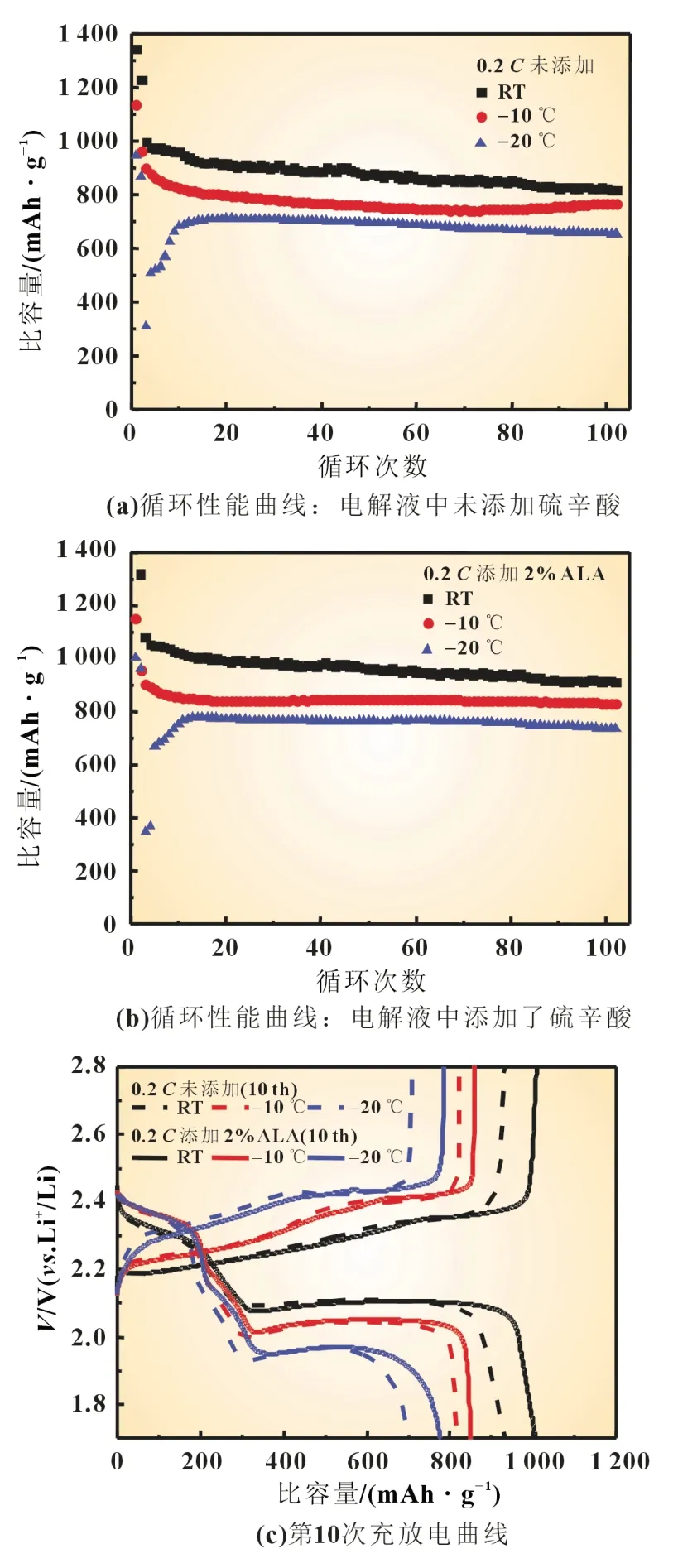
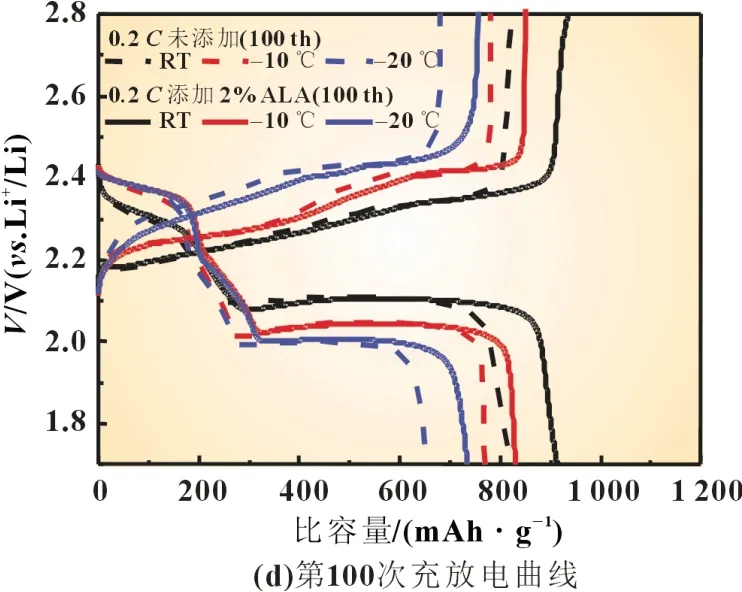
图1 不同温度下硫电极在不同电解液中的循环性能曲线和充放电曲线
在图1 中可以看到,在相同条件下测试温度较高的锂硫电池性能都优于测试温度低的锂硫电池。如图1(a)所示,在0.2C电流密度下,使用未添加硫辛酸电解液的硫电极,在室温、-10 和-20 ℃的首次放电比容量分别为998、902 和311 mAh/g,但是在-10 ℃以上时经过2 次活化锂硫电池就能正常充放电,而在-20 ℃下,在未添加硫辛酸电解液中,硫电极首次放电比容量极低,需要更长的活化时间(10 次)才能正常工作。100 次循环后,硫电极在室温、-10 和-20 ℃的放电比容量分别保持在818、769 和655 mAh/g。从以上结果发现温度的降低会严重影响锂硫电池的电化学性能。
图1(b)是使用添加了2%(质量分数)硫辛酸(ALA)电解液的锂硫电池在不同温度下循环性能测试图。它的整体趋势与图1(a)相似,但值得注意的是,在使用添加硫辛酸电解液时,硫电极在室温、-10 和-20 ℃下循环100 次后的放电比容量分别为914、831 和735 mAh/g,比使用未添加硫辛酸电解液的硫电极高80~120 mAh/g。
另外,从图1(c)和(d)所示的硫电极在未添加和添加硫辛酸电解液不同温度下的第10 次和第100 次的充放电曲线图可发现,硫辛酸的加入可减小充放电电位差,降低电池极化,延长电压平台。这些结果说明,在电解液中添加硫辛酸可有效改善硫电极在不同温度下的电化学反应动力学,从而提高硫电极的循环性能。
为了进一步探究硫辛酸对锂硫电池低温性能的影响,分别对使用未添加和添加硫辛酸电解液的锂硫电池进行了倍率性能测试。图2 是锂硫电池在-20 ℃时的倍率性能测试图和充放电曲线。在图2(b)中,实线为使用添加了硫辛酸电解液时的充放电曲线;虚线为使用未添加硫辛酸电解液时的充放电曲线。从图2 中可发现,在使用未添加硫辛酸电解液时,硫电极在0.1C、0.2C、0.5C和1C时的放电比容量分别为880、730、270 和205 mAh/g,当倍率重新回到0.1C和0.2C时,硫电极放电比容量恢复到875 和785 mAh/g。使用添加了硫辛酸电解液的硫电极,在相同测试条件下,0.1C和0.2C时的放电比容量分别达到了930 和815 mAh/g,在1C充放电测试结束后,将电流密度重新调回0.1C时,硫电极的放电比容量也迅速回升到930 mAh/g,电池的可逆容量保持得很好,添加硫辛酸电解液的锂硫电池表现出非常优秀的倍率性能。
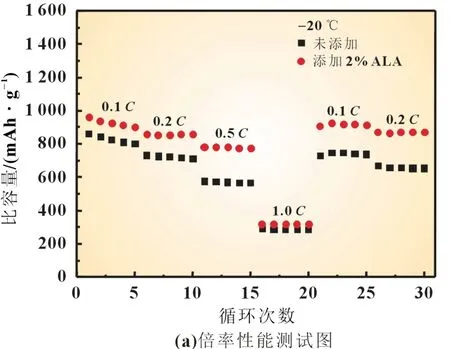
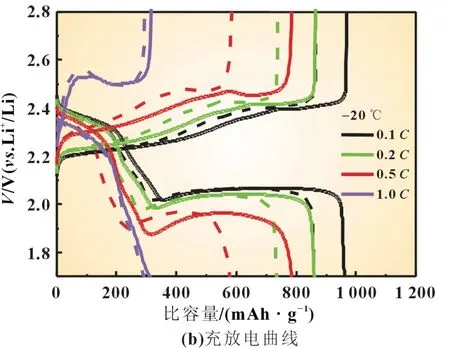
图2 -20 ℃硫电极的倍率性能测试图和充放电曲线
图3 为硫电极在不同温度下0.2C时的放电比容量和充放电曲线。图3(b)中实线为使用添加硫辛酸电解液时硫电极的充放电曲线;虚线为使用未添加硫辛酸电解液时硫电极的充放电曲线。从图中可发现,使用添加硫辛酸电解液的硫电极的比容量在任何温度下都高于使用未添加硫辛酸电解液的硫电极。值得注意的是,在-30 ℃时,使用未添加硫辛酸电解液的硫电极呈现出较大的极化,而使用添加了硫辛酸电解液的硫电极呈现出较小的极化,其放电比容量仍能保持在700 mAh/g,远远高于使用未添加硫辛酸电解液的硫电极(280 mAh/g),因此,在电解液中添加硫辛酸可有效改善锂硫电池在低温下的倍率性能。
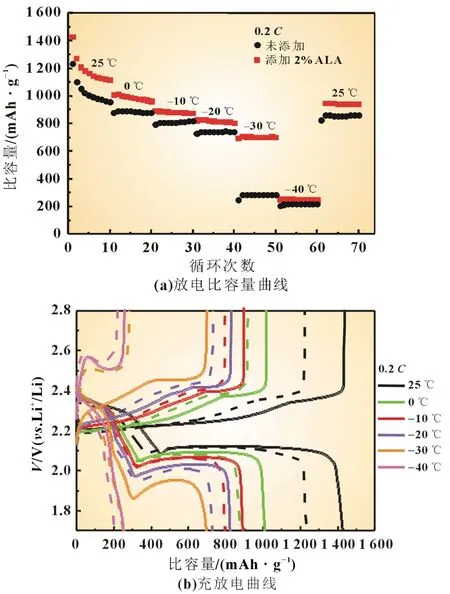
图3 0.2 C下,硫电极在不同温度下的放电比容量和充放电曲线
为了进一步探究硫辛酸如何影响低温下锂硫电池电化学反应历程,在室温和-20 ℃下,分别对使用未添加硫辛酸和添加硫辛酸电解液的硫电极进行循环伏安测试。从图4 可以看到,-20 ℃时硫电极在不同电解液中的CV 曲线和室温状态下的CV 曲线有明显不同。
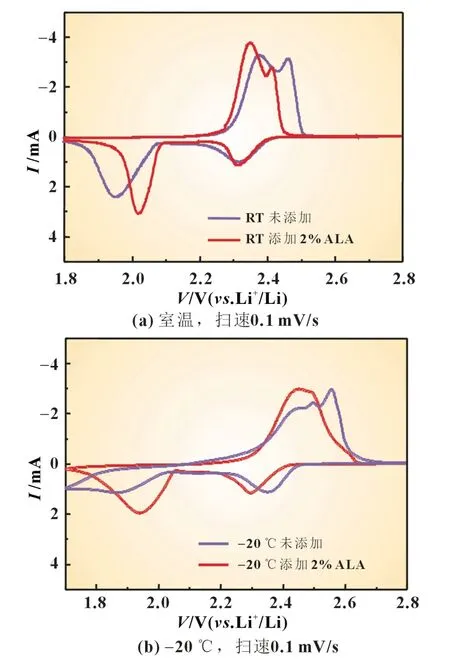
图4 不同温度下硫电极在未添加和添加硫辛酸电解液中的CV 曲线
在室温下,使用未添加和添加硫辛酸电解液的硫电极的循环伏安曲线都出现了典型的锂硫电池氧化还原峰,2.30 V处的还原峰对应单质硫被氧化为长链多硫离子的反应过程,2.03 V 处的还原峰对应长链的多硫离子继续被氧化成短链多硫离子,并进一步被氧化成Li2S 的反应过程。但是使用添加硫辛酸电解液的硫电极的还原峰与氧化峰之间的峰电位差要小于使用未添加硫辛酸电解液的硫电极的峰电位差,说明使用添加硫辛酸电解液的锂硫电池的极化程度要小于使用未添加硫辛酸电解液的锂硫电池。
在-20 ℃下,对于使用未添加硫辛酸电解液的硫电极的循环伏安曲线,除了2.3 V 的还原峰变化不大外,1.85 V 的还原峰较宽,说明Li2S 还原比较困难。对于使用添加硫辛酸电解液的硫电极,其在2.3和1.95 V处出现还原峰,相较于使用未添加硫辛酸电解液的硫电极,其氧化峰和还原峰明显变窄,且氧化峰和还原峰之间的电位差更小。这说明添加硫辛酸电解液的锂硫电池能够改善硫的氧化还原,提高反应过程中可溶性多硫化物(Li2Sx)和难溶硫化锂(Li2S)之间的相互转化。
2.2 扩散实验
为了进一步探讨温度对锂硫电池性能的影响,用H 型电解池测试了不同温度下Li2S6电解液的扩散过程,如图5 所示,从(a)到(c)依次是25、-10 和-20 ℃下多硫化锂在电解液中的扩散图。从图中可以看到,经过24 h 的静置,Li2S6电解液逐渐从左室向右室扩散,右室的空白电解质明显变黄,-20 ℃下H 型电解池右侧的多硫化物溶液颜色较常温和-10 ℃下多硫化物的颜色要浅一些,这说明了在低温环境下多硫化物的扩散受到了抑制。这应该是低温环境下电解液的粘度比较大,多硫离子在电解液中的迁移速度要慢于在常温时的迁移速度,因此,低温下锂硫电池的放电比容量会有所下降。

图5 不同温度下多硫化锂在电解液中的扩散实验
2.3 电导率测试和活化能计算
为了进一步探讨硫辛酸如何影响锂硫电池动力学过程,我们模拟实际过程中的电解液,配制了8 种电解液(表1),并将配制好的电解液置于低温箱中静置,用数字电导率仪测量各个电解液在25、0、-10 和-20 ℃下的离子电导率,通过式(1)Arrhenius 方程计算不同电解液所对应离子迁移活化能。各个电解液的离子电导率和活化能如图6 所示。
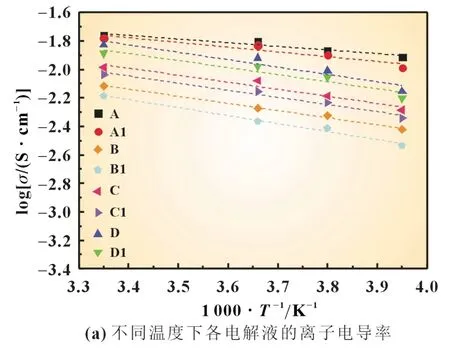
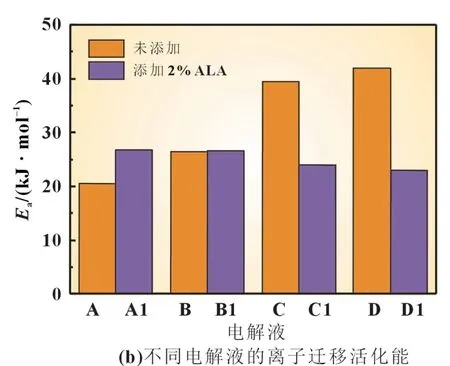
图6 各个电解液的离子电导率和活化能
从图中可以看到在-20~25 ℃,各电解液的离子电导率处于同一数量级。在各个温度下,不含多硫化物电解液的离子电导率要高于含多硫化物的电解液,当已经添加了硫辛酸的电解液中继续加入多硫化物时,电解液离子电导率下降更明显。
通过将不同温度下测量的各电解液的离子电导率拟合到Arrhenius 方程中,可以得到不同电解液的离子迁移活化能Ea,如图6(b)所示。未添加硫辛酸的电解液,在电解液中添加0.5 mol/L Li2S8、0.67 mol/L Li2S6(对应于长链多硫化物形成步骤)中的Ea显著增加。在电解液中添加1 mol/L Li2S4,Ea增加明显(对应于短链多硫化物形成步骤),最大值达到41.9 kJ/mol。相比之下,添加硫辛酸电解液的Ea在放电过程中呈下降趋势,且总体值低于未添加硫辛酸的电解液,表明常规电解质中硫的还原是困难的,特别是在短链聚硫化物还原过程中,电化学转化动力学较差。但是,硫辛酸改性电解质显著提高了反应过程中的硫还原动力学,因此硫辛酸的加入有利于锂硫电池在低温下的容量释放。
3 结论
本文探讨了硫辛酸对锂硫电池低温电化学性能的影响,研究发现使用添加了硫辛酸电解液的锂硫电池的循环性能和倍率性能都得到改善。通过循环伏安法测试,证明了硫辛酸能够改变低温下锂硫电池的电化学反应历程。最后通过Li2S6电解液的扩散实验和不同温度下8 种电解液的电导率测试以及活化能计算等,说明了锂硫电池中多硫化锂的转化是提高低温性能的关键。随着硫辛酸的加入,可以调控活性硫物种的电化学行为,加快可溶性多硫化物(Li2Sx)和难溶硫化锂(Li2S)之间的相互转化,进而提升锂硫电池在低温下的电化学性能。这些特性使所开发的基于硫辛酸(ALA)的电解质成为低温下高性能锂硫电池的潜在成分。
