饵料、盐度和温度对刺巨藤壶幼虫生长发育的影响
2022-11-26饶小珍
林 岗,饶小珍,*
1 福建师范大学生命科学学院,福州 350117
2 福建师范大学福建省特色海洋生物资源可持续利用重点实验室,福州 350117
无柄蔓足类 (藤壶) 是沿海生态系统的重要组成部分,也是主要的污损生物之一[1—3],常成群固着于海岸岩石、堤坝码头、舰船浮标、海水管道、平台设施及养殖设备上,对人类涉海经济活动产生极大危害和巨大经济损失。国外对纹藤壶属 (Amphibalanus) 的纹藤壶 (A.amphitrite)、网纹纹藤壶 (A.reticulatus) 和象牙纹藤壶 (A.eburneus)和藤壶属 (Balanus) 的三角藤壶 (B.trigonus)等种类的幼虫形态、各种生态因子对幼虫发育的影响、特别是以纹藤壶为模式动物对金星幼虫附着和变态的条件和机制等进行了大量研究,这些工作为蔓足类的生物学、生态学和防除研究奠定了坚实基础[2—10]。国内中国科学院南海海洋研究所曹文浩等主要以网纹纹藤壶为对象也进行了一些相关报道[11—14]。
刺巨藤壶 (Megabalanusvolcano) 属于节肢动物门 (Arthropoda)、甲壳亚门 (Crustacea)、蔓足下纲 (Cirripedia)、围胸总目 (Thoracica)[15],栖息于热带和亚热带海域低潮带或潮下带,我国的东海和浙江舟山以南至西沙群岛海域是其主要分布地。刺巨藤壶虽然是沿海污损生物的优势种,但它的肌肉非常发达,也是沿岸居民常食用的海鲜之一[1,14]。巨藤壶属的红巨藤壶(M.rosa)在藤壶胶的研究中起重要作用[16—17];而另一种巨藤壶M.azoricus个体很大,闭壳肌和卵巢发达,在葡萄牙亚速尔群岛作为一个经济种类受到过度采集,资源量不断下降[18—19],目前也尝试开展人工增养殖的研究[18—20]。蔓足类的生活史通常由卵、6期无节幼虫、1期不摄食的金星幼虫和固着的成体组成[1—3]。幼虫培养的成功与否是研究藤壶幼虫发育、揭示其附着机理的基础,也是开展防污材料筛选的前提条件[1—2]。本课题组对刺巨藤壶的精子结构进行了观察[21],但有关刺巨藤壶幼虫室内培养条件的研究未见报道。培养刺巨藤壶幼虫适宜的饵料是什么?幼虫生长发育适宜的温度和盐度范围是多少?了解这些基本生态因子对幼虫的影响可以明确刺巨藤壶幼虫培养的适宜条件。本文以刺巨藤壶Ⅵ期无节幼虫存活率、Ⅵ期无节幼虫出现时间、金星幼虫存活率、金星幼虫出现时间和金星幼虫体长等为观察指标,研究了3种饵料及密度(中肋骨条藻Skeletonemacostatum、牟氏角毛藻Chaetocerosmuelleri和亚心型扁藻Platymonassubcordiformis)、盐度和温度等因子对刺巨藤壶幼虫生长发育的影响,以便能在实验室培养刺巨藤壶金星幼虫,为藤壶生物学、海洋生态学及附着机理等方面的研究提供资料,也可为其人工增养殖的开展提供指导。
1 材料与方法
1.1 实验材料
1.1.1 刺巨藤壶成体室内培养与幼虫的采集
刺巨藤壶成体于2017年 5月下旬采自福建省平潭综合实验区芦洋乡马腿村 (26.0173°N,119.6653°E),海区水温24.1℃、盐度28.8,成体峰吻径20—27 mm、高43—62 mm。亲体在实验室放置于200 L的养殖桶中培养育肥,每日投喂藻类和卤虫,并定时清污。养殖条件为海水盐度29—30、pH为7.9—8.0、水温25—27℃,所用海水经过滤、紫外线消毒处理。每日检查,观察到刺巨藤壶成体释放出Ⅰ期无节幼体,以筛网立即收集Ⅰ期无节幼体,将收集到的Ⅰ期无节幼虫置于容量为 3000 mL 的玻璃烧杯中。Ⅰ期无节幼体在12 h内将发育为Ⅱ期无节幼体,利用幼虫的趋光性用吸管吸取健康活泼的Ⅱ期无节幼虫作为实验材料。
1.1.2 藻类的培养
实验所需中肋骨条藻、牟氏角毛藻和亚心型扁藻由福建师范大学藻种培养室提供。用f/2培养基进行藻类单种扩大培养。以对数生长期的藻类进行投喂。藻类培养温度在(24±1)℃,光照周期为D:L=18h:6h。
1.2 实验设置
实验在500 mL的烧杯中进行,400 mL海水引入100只刺巨藤壶无节幼虫,幼虫密度为0.25只/mL,实验过程中不充气。投饵时,先用血球计数板确定藻类原液浓度,再经换算,在每个实验组中投入相应的饵料量。
每天全换水1次,投饵1次。在换水之前随机用吸管吸取约10只幼虫在显微镜下观察和记录其生长状况。换水时利用幼虫的趋光性吸取培养液中存活的幼虫到新的烧杯。一旦观察到出现Ⅵ期无节幼虫和金星幼虫时,统计烧杯中存活的无节幼虫和金星幼虫数量。直到每个烧杯中的无节幼虫发育为金星幼虫或者全部无节幼虫死亡时实验结束。
1.2.1 饵料实验
中肋骨条藻设置5×104个/mL、10×104个/mL、20×104个/mL、40×104个/mL和80×104个/mL 5个密度梯度,牟氏角毛藻设置5×104个/mL、10×104个/mL、20×104个/mL、40×104个/mL和80×104个/mL 5个密度梯度,亚心型扁藻设置2.5×104个/mL、5×104个/mL、10×104个/mL、15×104个/mL和20×104个/mL 5个密度梯度。每个实验组三个平行。海水盐度为29—30、水温25—26℃。
1.2.2 盐度实验
设置7个盐度梯度分别为18、22、26、30、34、38和42。高盐组用海水晶、低盐组用反渗水进行配制。所用饵料为牟氏角毛藻,藻类密度控制在50×104个/mL,水温25—26℃。每个实验组三个平行。
1.2.3 温度实验
设置6个温度梯度分别为14℃、18℃、22℃、26℃、30℃和34℃。各温度组用控温系统进行调控。所用饵料为牟氏角毛藻,藻类密度控制在50×104个/mL,海水盐度为29—30。换水前各温度组使用的海水提前进行预温处理。每个实验组三个平行。
1.3 实验观察和统计的指标
1.3.1 Ⅵ期无节幼虫的发育时间和存活率
Ⅵ期无节幼虫的发育时间为每实验组最早出现Ⅵ期无节幼虫时发育所用的时间(d)。
Ⅵ期无节幼虫存活率=出现Ⅵ期无节幼虫时统计存活的无节幼虫数量/起始的无节幼虫数量×100%。
1.3.2 金星幼虫的发育时间和存活率
金星幼虫的发育时间为每实验组最早出现金星幼虫时发育所用的时间(d)。
金星幼虫存活率=实验结束时,每实验组中累计获得的金星幼虫总数/起始的无节幼虫数量×100%。
1.3.3 金星幼虫体长的测量
用目镜测微尺测量金星幼虫的体长。将同一实验条件培养的金星幼虫收集到同一烧杯中,若金星幼虫超过20只,随机抽取20只测量;若不足20只金星幼虫,对所有虫体进行测量。
1.4 数据分析
2 结果
2.1 饵料对刺巨藤壶幼虫发育的影响
2.1.1 中肋骨条藻对刺巨藤壶幼虫发育的影响
中肋骨条藻能够培养刺巨藤壶无节幼虫至金星幼虫阶段(图1)。5×104个/mL密度组中的幼虫只能发育到Ⅵ期无节幼虫阶段,无法发育到金星幼虫,其Ⅵ期无节幼虫的存活率仅6.00%;其它各组均高达60.00%以上。金星幼虫的存活率在10×104个/mL组仅2.33%,而80×104个/mL组的高达41.33%。经过单因素方差分析表明,骨条藻密度对刺巨藤壶Ⅵ期无节幼虫存活率(F=33.835,P=0.000)和金星幼虫存活率(F=14.833,P=0.001)有极显著影响。经过多重比较,Ⅵ期无节幼虫的存活率除5×104个/mL组外其它各组间未表现出明显差异(P≥ 0.420)。金星幼虫存活率在10×104个/mL组和20×104个/mL组(P=0.165)、20×104个/mL组和40×104个/mL组(P=0.154)、40×104个/mL和80×104个/mL组(P=0.513)之间的存活率无显著差异。
随着骨条藻密度的增加,Ⅵ期无节幼虫和金星幼虫发育时间渐缩短(图2)。5×104个/mL组的Ⅵ期无节幼虫发育最慢长达11 d,40×104个/mL和 80×104个/mL密度组的幼虫发育最快只需4 d。到达金星幼虫阶段的时间,10×104个/mL组和20×104个/mL密度组发育较慢分别需12 d和11 d;40×104个/mL组和80×104个/mL密度组发育较快,分别需7 d和6 d。
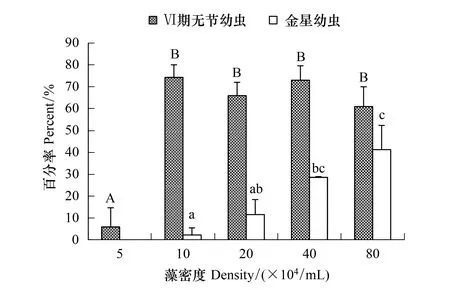
图1 中肋骨条藻密度对刺巨藤壶Ⅵ期无节幼虫和金星幼虫存活率的影响
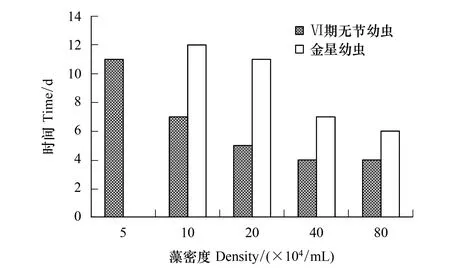
图2 中肋骨条藻密度对刺巨藤壶Ⅵ期无节幼虫和金星幼虫发育时间的影响
在不同骨条藻密度培养的金星幼虫体长见表1。低密度10×104个/mL组的金星幼虫体长最短,高密度80×104个/mL组的最长。总的来看,随着骨条藻密度的增大,金星幼虫的体长增加。经单因素方差分析表明藻密度对金星幼虫体长有极显著影响(F=39.387,P=0.000)。经过多重比较,各密度组间金星幼虫体长均有极显著差异 (P<0.01)。
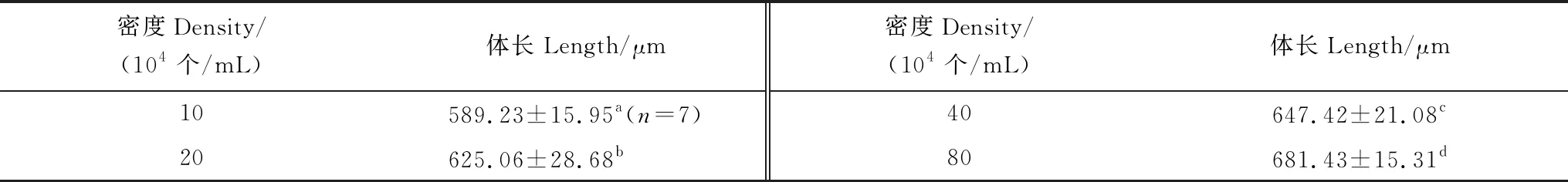
表1 中肋骨条藻密度对刺巨藤壶金星幼虫体长的影响
总之,综合几个观察指标,中肋骨条藻培养刺巨藤壶幼虫的适宜密度是40×104个/mL和 80×104个/mL。
绿色矿山评价指标众多,包括定性和定量指标。本文采用层次分析法(AHP)与模糊综合评价法相结合方式,将定量指标与定性指标一起进行多级模糊综合评价。
2.1.2 牟氏角毛藻对刺巨藤壶幼虫发育的影响
牟氏角毛藻能够培养刺巨藤壶无节幼虫至金星幼虫阶段(图3)。5×104个/mL 密度组中的幼虫只能发育到Ⅵ期无节幼虫阶段,无法发育到金星幼虫阶段。Ⅵ期无节幼虫的存活率5×104个/mL组仅15.00%,而80×104个/mL组高达74.67%。金星幼虫的存活率10×104个/mL组仅5.33%,而80×104个/mL组高达43.67%。经过单因素方差分析表明,角毛藻密度对刺巨藤壶Ⅵ期无节幼虫存活率(F=95.439,P=0.000)和金星幼虫存活率(F=49.634,P=0.000)有极显著影响。经过多重比较,Ⅵ期无节幼虫存活率 5×104个/mL组和10×104个/mL组与各组间均有极显著差异(P<0.01),20×104个/mL组和40×104个/mL组(P=0.188)、40×104个/mL组和80×104个/mL组之间的存活率无显著差别(P=0.852)。金星幼虫的存活率在10×104个/mL组和20×104个/mL组与其它组间均有极显著差异(P< 0.01),而40×104个/mL和80×104个/mL密度组之间的存活率无显著差异(P=0.419)。
随着角毛藻密度的增加,Ⅵ期无节幼虫和金星幼虫发育时间渐缩短(图 4)。5×104个/mL组的Ⅵ期无节幼虫发育时间长达10 d,而40×104个/mL组和80×104个/mL组发育最快只需5 d。金星幼虫发育时间10×104个/mL组的长达12 d,而80×104个/mL组的发育最快只需7 d。
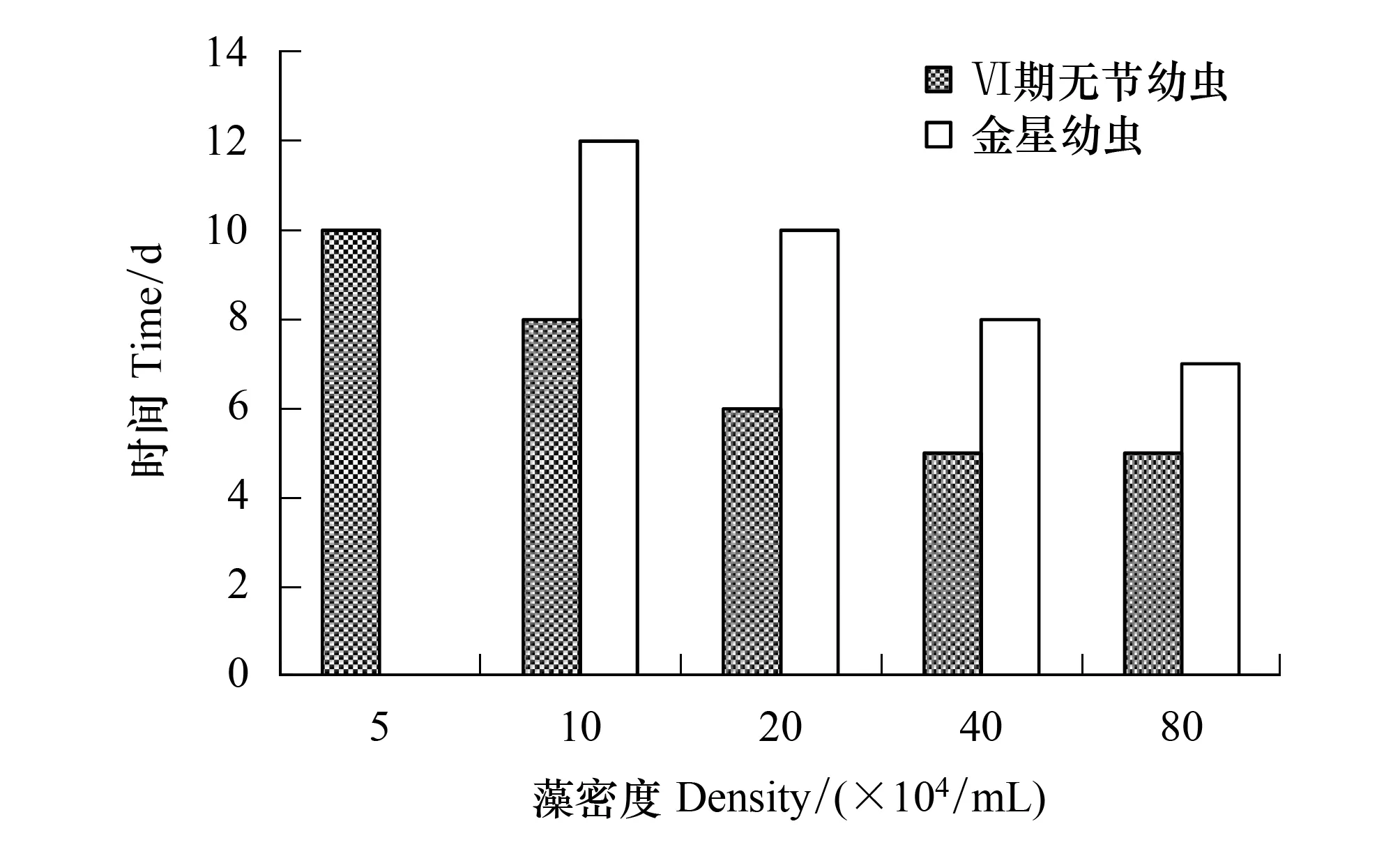
图4 牟氏角毛藻密度对刺巨藤壶Ⅵ期无节幼虫和金星幼虫发育时间的影响
牟氏角毛藻密度对刺巨藤壶金星幼虫体长的影响见表2。低密度10×104个/mL组的金星幼虫体长最短,高密度80×104个/mL组的最长。总之,随着角毛藻密度的增大,金星幼虫的体长增加。经单因素方差分析表明角毛藻密度对金星幼虫体长有极显著影响(F=26.613,P=0.000)。经过多重比较表明,10×104个/mL组和20×104个/mL组的金星幼虫体长与其它各组间均有极显著差异 (P< 0.01),而40×104个/mL组和80×104个/mL组间的金星幼虫体长没有显著差异。
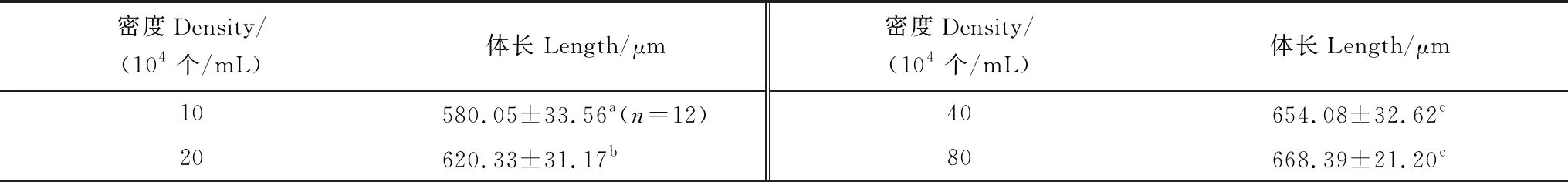
表2 牟氏角毛藻密度对刺巨藤壶金星幼虫体长的影响
总之,综合几个观察指标,牟氏角毛藻培养刺巨藤壶幼虫的适宜密度是40×104个/mL和80×104个/mL。
2.1.3 亚心形扁藻对刺巨藤壶幼虫发育的影响
亚心形扁藻能够培养刺巨藤壶无节幼虫至金星幼虫阶段(图5)。2.5×104个/mL和5×104个/mL低密度组的幼虫只能发育到Ⅵ期无节幼虫阶段;其它3个高密度组的幼虫可以发育至金星幼虫阶段。Ⅵ期无节幼虫的存活率在15×104个/mL组高达84.33%。但各密度组Ⅵ期无节幼虫变态至金星幼虫的存活率显著下降;金星幼虫存活率最高为20×104个/mL组仅14.33%。经单因素方差分析表明,扁藻密度对刺巨藤壶Ⅵ期无节幼虫(F=32.035,P=0.000)和金星幼虫的存活率(F=14.347,P=0.005)有极显著影响。经过多重比较,2.5×104个/mL组和5×104个/mL组间的Ⅵ期无节幼虫存活率未表现出明显差异(P=0.147),10×104个/mL组、15×104个/mL组和20×104个/mL组(P≥ 0.329)三组间也没有显著差异。10×104个/mL组的金星幼虫存活率与其它两个密度组间有显著差异,15×104个/mL组与20×104个/mL组间的存活率无显著差异(P=0.173)。
随着扁藻密度的增加,Ⅵ期无节幼虫和金星幼虫的发育时间渐缩短(图6)。2.5×104个/mL组的Ⅵ期无节幼虫发育时间长达9 d,15×104个/mL组和 20×104个/mL组发育最快只需6 d。金星幼虫发育时间10×104个/mL组的较长需10 d,20×104个/mL组的最短仅8 d。
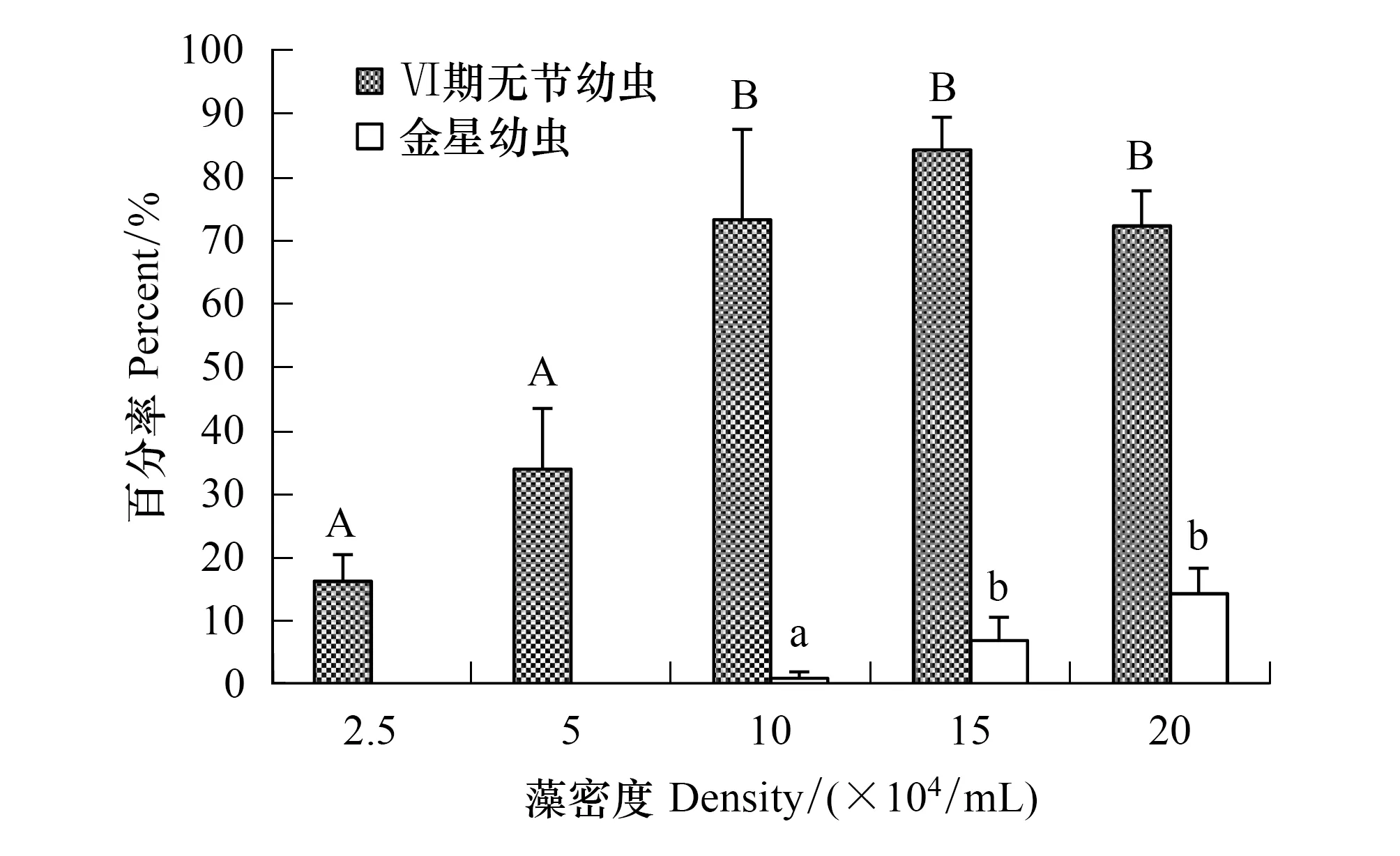
图5 亚心形扁藻密度对刺巨藤壶Ⅵ期无节幼虫和金星幼虫存活率的影响
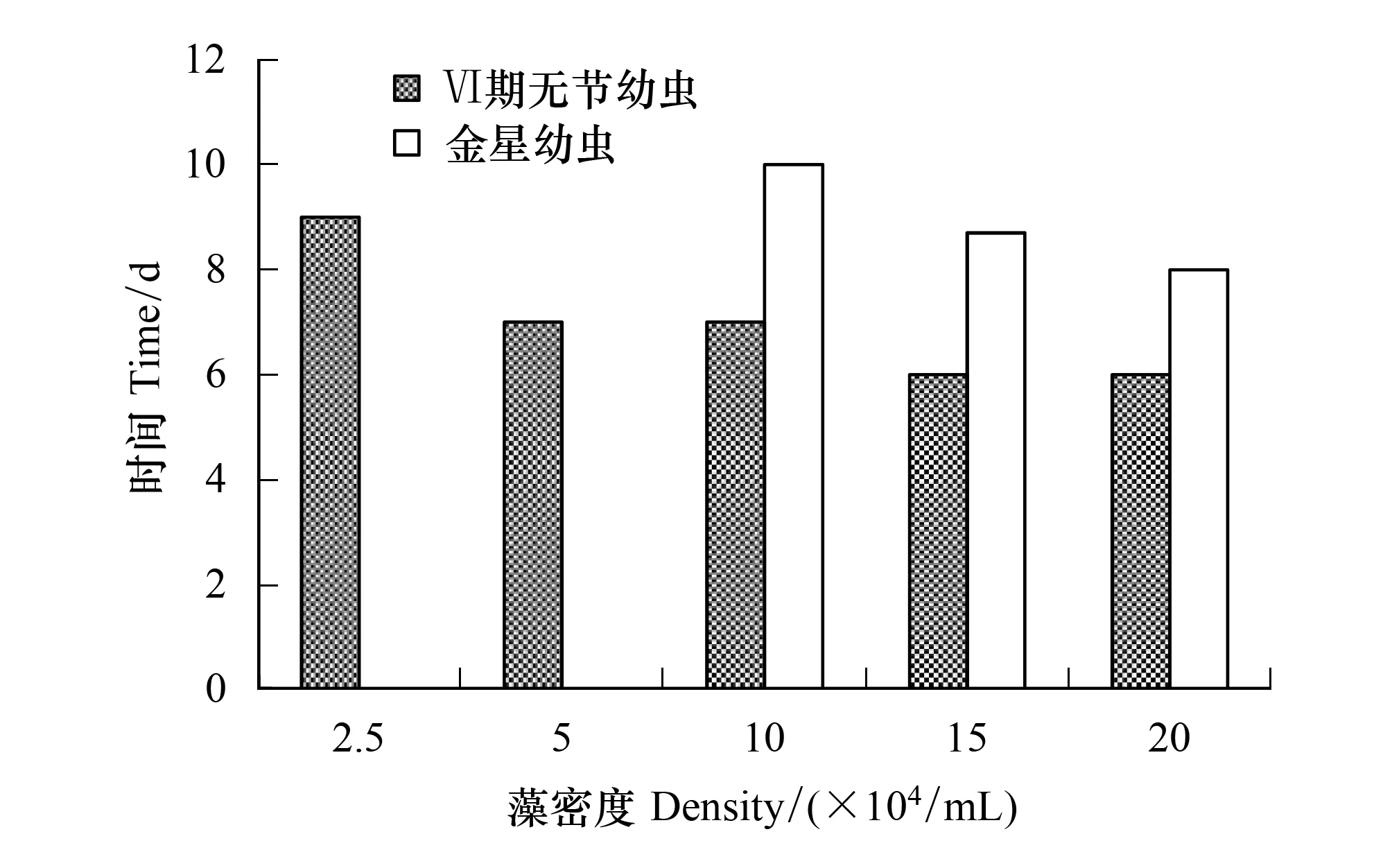
图6 亚心形扁藻密度对刺巨藤壶Ⅵ期无节幼虫和金星幼虫发育时间的影响
扁藻密度对刺巨藤壶金星幼虫体长的影响见表3。经单因素方差分析表明扁藻密度对金星幼虫体长没有影响(P>0.05),各组间的体长没有明显差异。总体而言,用扁藻培养的刺巨藤壶金星幼虫个体较小、存活率低,亚心形扁藻不是培养刺巨藤壶幼虫的适宜饵料。

表3 亚心形扁藻密度对刺巨藤壶金星幼虫体长的影响
2.2 盐度对刺巨藤壶幼虫发育的影响
刺巨藤壶幼虫除了18盐度组只能发育到Ⅳ期无节幼虫外,从22至42各盐度组均能发育到金星幼虫阶段(图7)。Ⅵ期无节幼虫存活率以34盐度组最高为70.33%,22盐度组最低为30.67%。金星幼虫存活率以30盐度组最高为35.67%,42盐度组最低为9.67%。经过单因素方差分析表明,盐度对Ⅵ期无节幼虫存活率(F=76.143,P=0.000)和金星幼虫存活率(F=7.022,P=0.003)均有极显著影响。经过多重比较,22和42盐度组的Ⅵ期无节幼虫存活率与其它各组间均有显著差异(P< 0.05)。22、38和42盐度组间的金星幼虫存活率没有显著差异(P≥ 0.268),22、26、30、34和38盐度组之间的也无显著差异(P≥ 0.129),但42盐度组与26、30、34盐度组间有极显著差异(P≤ 0.01)。
盐度对Ⅵ期无节幼虫和金星幼虫发育时间的影响不明显(图8)。各盐度组Ⅵ期无节幼虫发育时间均为6 d,金星幼虫的发育时间在8 d和8.7 d之间。
盐度对刺巨藤壶金星幼虫体长的影响见表4。22盐度组的金星幼虫体长最长,38盐度组的最短。经方差分析表明盐度对金星幼虫体长有显著影响(F=17.994,P=0.000)。经过多重比较,22和26盐度组的金星幼虫体长没有显著差异 (P=0.392),30、34、38、42盐度组间的体长也没有显著差异(P≥ 0.199)。低盐培养下,金星幼虫的体长相对较长。
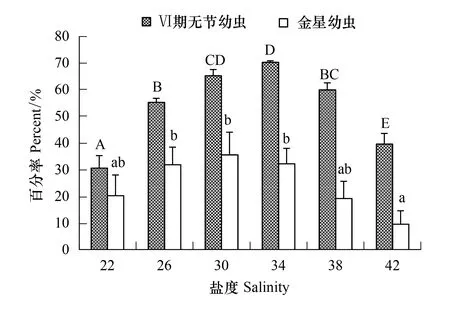
图7 盐度对刺巨藤壶Ⅵ期无节幼虫和金星幼虫存活率的影响
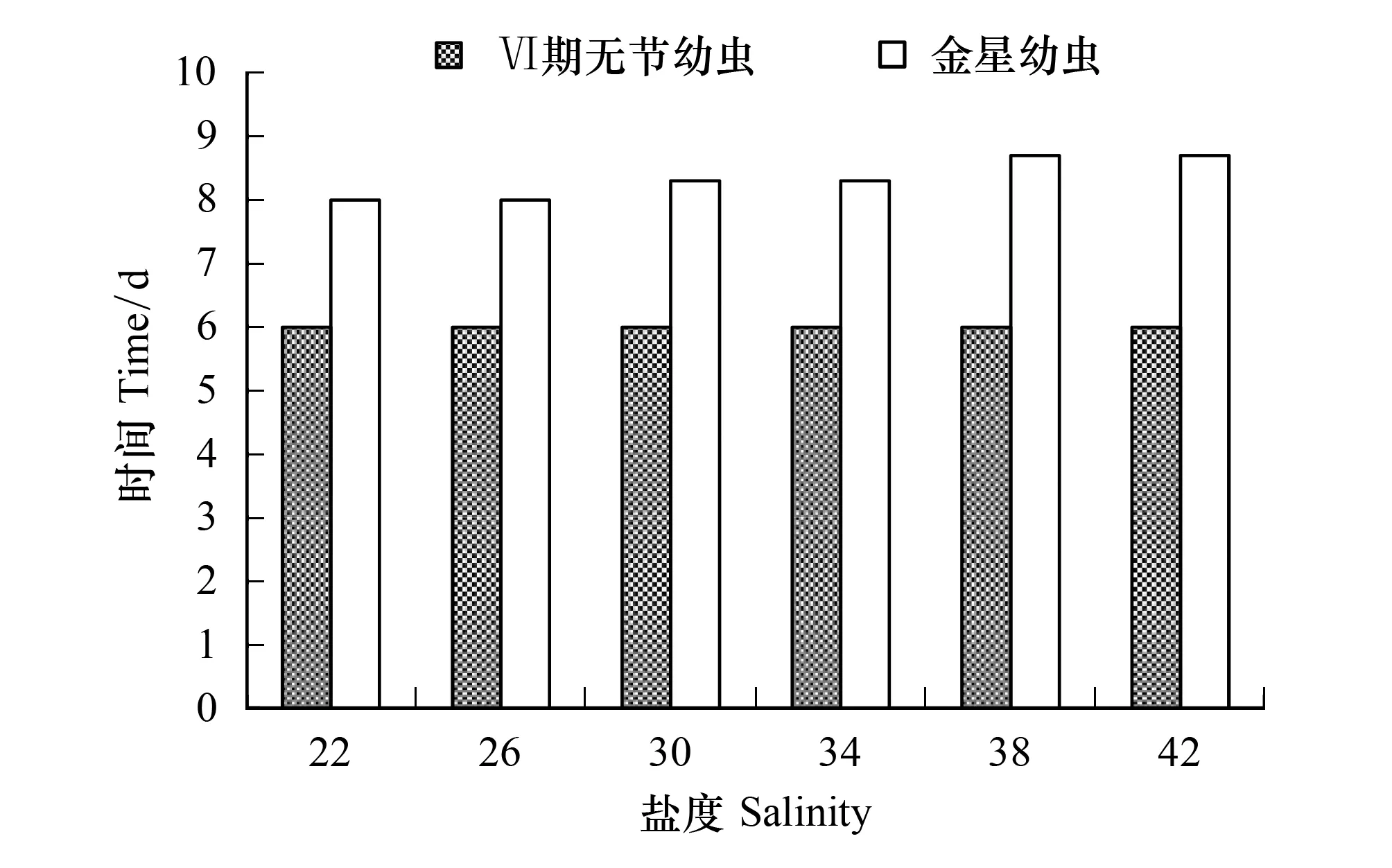
图8 盐度对刺巨藤壶Ⅵ期无节幼虫和金星幼虫发育时间的影响

表4 盐度对刺巨藤壶金星幼虫体长的影响
2.3 温度对刺巨藤壶幼虫发育的影响
14℃组中的刺巨藤壶幼虫只能发育到Ⅲ期无节幼虫阶段,34℃组仅发育到Ⅴ期无节幼虫阶段,18—30℃各温度组无节幼虫均能发育至金星幼虫阶段(图9)。各温度组Ⅵ期无节幼虫的存活率均达到70.00%以上,以22℃的存活率最高为86.67%。金星幼虫的存活率22℃时最高为50.67%,30℃时的最低仅9.67%。经过方差分析表明,温度对Ⅵ期无节幼虫(F=4.401,P=0.042)和金星幼虫存活率(F=13.945,P=0.002)均有显著影响。经过多重比较,18℃和22℃组间的Ⅵ期无节幼虫存活率有显著差异,18℃、26℃、30℃各组间的没有明显差异(P≥0.473),22℃、26℃、30℃各组间的也没有明显差异(P≥0.090)。30℃组金星幼虫存活率与其它各组间的均有显著差异,其它3个温度组间的存活率无显著差异(P≥0.134)。
随着温度的提高,Ⅵ期无节幼虫和金星幼虫发育时间均缩短(图10)。以18℃组的幼虫发育最慢,Ⅵ期无节幼虫和金星幼虫发育时间分别需要9 d和14 d;以30℃组的幼虫发育最快,Ⅵ期无节幼虫和金星幼虫发育时间分别需要5 d和7.3 d。
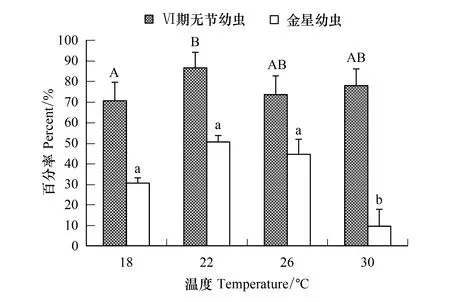
图9 温度对刺巨藤壶Ⅵ期无节幼虫和金星幼虫存活率的影响
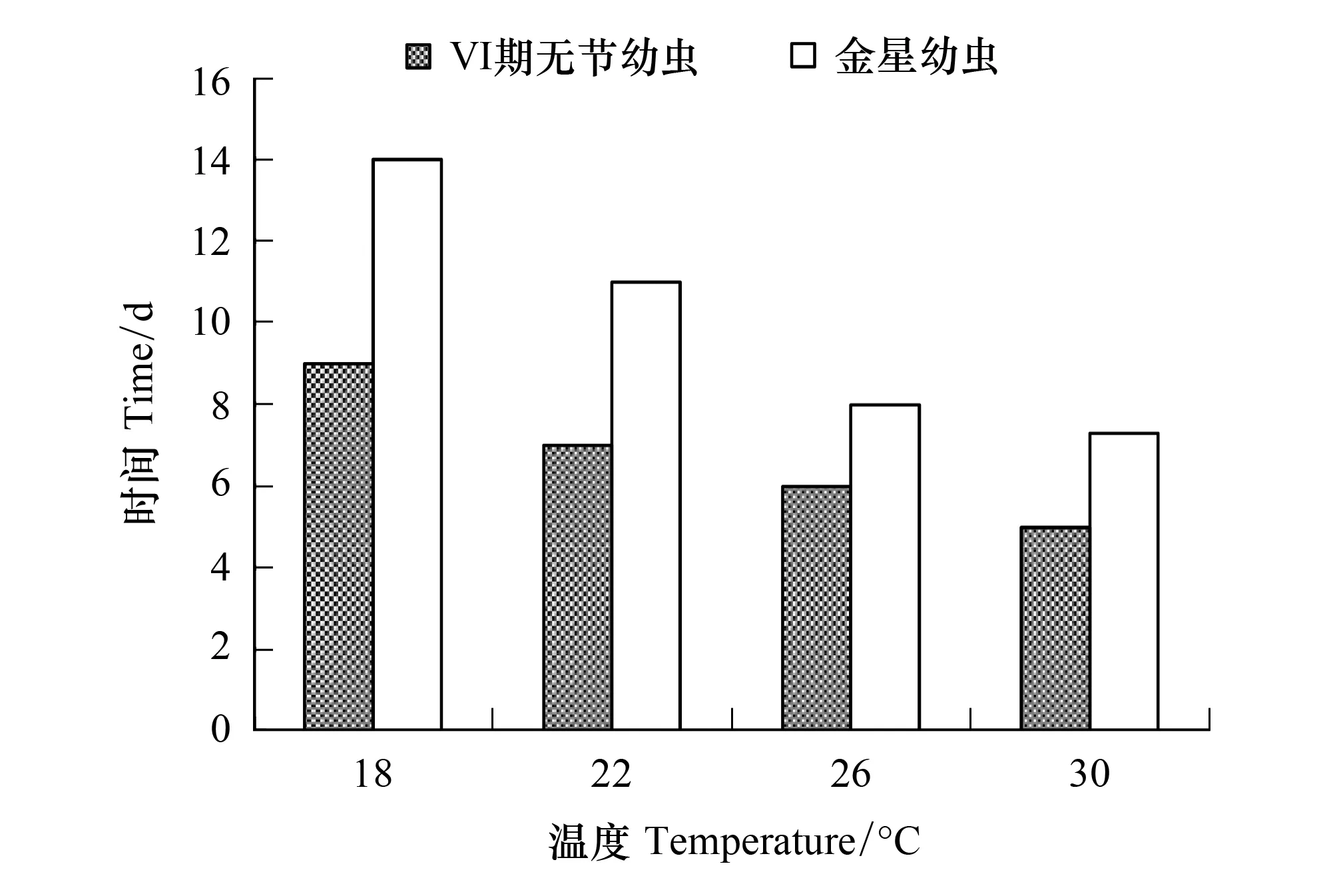
图10 温度对刺巨藤壶Ⅵ期无节幼虫和金星幼虫发育时间的影响
温度对刺巨藤壶金星幼虫体长的影响见表5。18℃组的金星幼虫体长最长,30℃组的最短。经单因素方差分析表明盐度对金星幼虫体长有极显著影响(F=18.751,P=0.000)。经过多重比较,18℃组和其它各温度组间的金星幼虫体长有极显著差异 (P< 0.01),其它3个温度组间的没有显著差异(P≥0.178)。低温培养下,金星幼虫的体长相对较长。

表5 温度对刺巨藤壶金星幼虫体长的影响
3 讨论
3.1 饵料种类和密度对刺巨藤壶幼虫发育的影响
饵料、盐度和温度等多种生态因子影响海洋无脊椎动物幼虫的生长发育和变态,其中最重要的因子是饵料。合适的饵料是动物培养的关键,只有找到合适的饵料才有可能在室内进行动物的人工培养[4,7—8]。蔓足类的生活史包括无节幼虫和金星幼虫2个幼虫阶段,金星幼虫阶段是不摄食的,因而无节幼虫的摄食经历决定了金星幼虫的能量储备以及随后的募集成败[2,9]。在实践中,培养各种蔓足类幼虫适宜的微藻不同。曹文浩等认为旺盛期的亚心形扁藻是培养网纹藤壶幼虫的适宜饵料[11]。冯丹青等用牟氏角毛藻可将白脊藤壶 (B.albicostatus)幼虫培养至金星幼虫阶段[22]。Desai等用角毛藻(C.calcitrans)培养纹藤壶幼虫的效果比中肋骨条藻的好[7]。Nasrolahi等用角毛藻(C.calcitrans)和小球藻可以培养致密纹藤壶(A.improvisus)幼虫到金星幼虫阶段;而四尾栅藻 (Scenedesmusquadricauda) 不合适培养致密纹藤壶幼虫,可能是因为它表面有刺的形态妨碍了幼虫的摄食[8]。Nunes等用5种微藻培养M.azoricus的无节幼虫,结果表明等鞭金藻(T-Isochrysissp.)和一种骨条藻的效果较好、杜氏盐藻(Dunaliellasp.)效果一般、而角毛藻(C.calcitrans)和拟衣藻(Chloromonassp.)效果最差[20]。Franco等的结果表明玛氏骨条藻 (S.marinoi) 培养有柄类指茗荷 (Pollicipespollicipes) 无节幼虫的效果较肩突四鞭藻 (Tetraselmissuecica) 好,而用球等鞭金藻 (I.galbana)培养的幼虫不能发育到金星幼虫阶段[23]。Thiyagarajan等进一步指出不同饵料(纤细角毛藻C.gracilis、硅限制的纤细角毛藻、假微型海链藻Thalassiosirapseudonana和中肋骨条藻)培养的纹藤壶金星幼虫的营养指标如三酰甘油(TAG)/DNA的比值不同,而金星幼虫TAG/DNA的比值越高,其附着变态能力越强[9]。
绿藻、金藻和硅藻3个门的薇藻在海洋动物的培养中被广泛使用。微藻饵料的营养价值取决于很多因素,藻类营养成分的含量和比例(脂肪酸成分、氨基酸成份、碳水化合物水平、必要维生素等)决定了微藻的食用价值[4,7,20]。而微藻的大小、形状和藻链的长度均会影响它的沉降率,进而影响蔓足类幼虫的摄食和消化效率[24-25]。随着蔓足类幼虫的发育,游泳附肢刚毛间的距离渐增大,晚期幼虫比早期幼虫可以摄食更大的饵料颗粒[25],如致密纹藤壶早期无节幼虫用小球藻的效果比角毛藻的好,而晚期幼虫则相反[8]。因此,不同微藻的饵料效果不同,不同的蔓足类及同一种蔓足类不同的发育阶段适宜的微藻也不同。
本实验中所用的3种微藻均能成功培养刺巨藤壶无节幼虫发育到金星幼虫阶段,但用中肋骨条藻和牟氏角毛藻培养的刺巨藤壶金星幼虫存活率和金星幼虫体长都比用亚心型扁藻培养的高得多。因此,中肋骨条藻和牟氏角毛藻是培养刺巨藤壶无节幼虫适宜的饵料,而亚心型扁藻并不是合适的饵料。3种微藻细胞大小、形态、营养价值等的不同,导致了刺巨藤壶无节幼虫产生了选择性的差异。牟氏角毛藻细胞小、壁薄、多数营单个生活,大小为3.5×4.6—4.6×9.2 μm,也有 2—3个细胞相连组成群体生活;中肋骨条藻其细胞大小为 4—15 μm,呈圆柱形,褐色,藻体由几个到几十个细胞靠壳面相连成链状;扁藻为绿藻门、具鞭毛,长为11—14μm,宽7—9μm[26]。如上所述,虽然有多种微藻可作为蔓足类幼虫的饵料,除少量报道扁藻可用于蔓足类幼虫的培养外[11—13,27],用于蔓足类幼虫培养的微藻普遍为硅藻类的角毛藻和骨条藻[4—6,10,28—30]。角毛藻和骨条藻同属硅藻门,富含二十二碳六烯酸 (DHA)、二十碳五烯酸 (EPA) 等高不饱和脂肪酸,是蔓足类适宜的饵料[7,24,31]。本实验用高密度扁藻培养的刺巨藤壶Ⅵ期无节幼虫的存活率均高达70%以上,但金星幼虫阶段的存活率急剧下降。扁藻比2 种硅藻大,虽然藻类大小是影响幼虫摄食效率的一个因素,但蔓足类晚期幼虫比早期幼虫可以摄食更大的饵料颗粒[25],藻类大小显然不是影响刺巨藤壶幼虫摄食扁藻的一个原因。对蔓足类来说,从Ⅵ期无节幼虫变态为金星幼虫是一个敏感时期[23],只有最终能培养到金星幼虫阶段的饵料才是合适的饵料。本文认为扁藻可能含有某种对幼虫发育不利且具有累积效应的成分,或是缺少某些营养要素,最后导致Ⅵ期无节幼虫变态为金星幼虫的比例很低。因此,扁藻不是培养刺巨藤壶幼虫合适的饵料。混合藻类往往具有更好的饵料效果[20,23],今后,可以在单种藻类结果的基础上进一步进行两种及以上混合藻类的实验,以寻找到更加有效的饵料配比。
目前,文献报道了另2种巨藤壶幼虫的培养。在一种巨藤壶 (M.coccopoma) 幼虫培养中成功使用纤细角毛藻作为饵料[32],本实验结果与此一致。但本文结果和Nunes等的结果相比有很大不同[20],他认为等鞭金藻和骨条藻是M.azoricus幼虫合适的饵料而角毛藻不是合适的饵料。本实验中也曾采用湛江叉鞭金藻培养刺巨藤壶无节幼虫(结果没有显示),但效果很差,幼虫不能发育到金星幼虫阶段。Nunes分析角毛藻的大小(4×8 μm)与等鞭金藻的大小(5—6 μm)相近,但在没有充气的条件下角毛藻沉降速率快,不利于幼虫的摄食;骨条藻虽与角毛藻同为硅藻,也有下沉的不利因素,但为链状且较大(7×16 μm),从而不影响幼虫的摄取[20]。本实验因为在烧杯中进行,水体小,幼虫的密度低,同时为避免充气后幼虫可能会粘附在壁上影响计数,本结果是在没有充气的条件下取得的。后续实验可在充气的条件下进行,藻类不会下沉且分布会更加均匀,更有利于幼虫的摄食,可能会得到不同的结果。本实验与Nunes的实验都是在没有充气的条件下进行,金藻和角毛藻在两种巨藤壶表现出不同饵料效果的原因仍需作进一步的分析。
饵料的密度也会影响幼虫的存活率、发育速度和幼虫的大小;一般随着藻密度的增加,存活率上升,发育速率加快,培养的幼虫更大,营养物质积累更多。如角毛藻和小球藻的密度对纹藤壶幼虫的发育速度、无节幼虫的大小和营养状况(以RNA含量为指标)均有影响[4,8]。West等认为食物密度对象牙纹藤壶无节幼虫的大小没有影响但对金星幼虫的大小仍有影响[10]。Thiyagarajan等的结果表明4种微藻除了骨条藻外纹藤壶金星幼虫的TAG/DNA比值也与藻密度相关[9]。金星幼虫是蔓足类由浮游生活向固着生活的转变阶段,金星幼虫的作用是寻找、探究合适的基质并最终附着完成变态。有许多物理、化学和生物的因子影响金星幼虫的附着和变态,其中金星幼虫的营养状态和能量储备是决定其变态能否成功的关键因子[1—3,33]。合适的藻类和密度培养得到的金星幼虫个体比较大,显微镜下可见大量油滴,运动活泼,具有很高的RNA含量或TAG/DNA含量,最终附着变态的比例显著提高[4,9,23]。
同样,在本实验中,3种微藻的密度均影响刺巨藤壶幼虫的发育速度和存活率;高密度组幼虫的发育时间短、存活率高,低密度组幼虫发育速率降低甚至不能完成发育。中肋骨条藻低密度10×104个/mL组金星幼虫的发育时间需要12 d,存活率仅2.33%;高密度80×104个/mL组金星幼虫的发育时间仅需要6 d,存活率高达41.33%。牟氏角毛藻低密度10×104个/mL组金星幼虫的发育时间需要12 d,存活率仅5.33%;高密度80×104个/mL组金星幼虫的发育时间仅需7 d,存活率高达43.67%。除亚心形扁藻培养的金星幼虫大小不受藻密度影响外(比其它2种藻培养的小得多),用中肋骨条藻和牟氏角毛藻培养的金星幼虫大小均受藻密度的影响,高密度藻培养的金星幼虫体长比低密度的长。综合几个观察指标,中肋骨条藻和牟氏角毛藻培养刺巨藤壶幼虫的适宜密度是40×104个/mL和80×104个/mL。本实验用适宜密度的中肋骨条藻和牟氏角毛藻培养的刺巨藤壶金星幼虫个体大,油滴多,质量更高;用亚心形扁藻培养的金星幼虫个体明显小,油滴也少,质量较差。
3.2 盐度对刺巨藤壶幼虫发育的影响
海水盐度是影响蔓足类分布的关键因素[5—6,29—30,34—36]。一些低盐种类如泥藤壶 (B.uliginosus) 和白脊藤壶 (B.albicostatus) 广泛分布于我国沿海河口等咸淡水交汇水域;而三角藤壶、红巨藤壶、钟巨藤壶 (M.tintinnabulumtintinnabulum)、日本笠藤壶 (Tetraclitajaponica) 等高盐种类则只分布于海水盐度较高的区域[14]。很多研究表明在室内培养蔓足类幼虫合适的盐度往往与成体分布海域的盐度相吻合。如网纹纹藤壶和鳞笠藤壶 (T.squamosasquamous) 当水体中的盐度≤18,会严重阻滞发育甚至导致其死亡;当盐度≥24时,这 2 种藤壶幼虫的成活率虽不会随盐度改变发生显著变化,但盐度为 30的水体更有利于网纹藤壶幼虫的发育[12]。这一特性与它们分布位置不同相一致,网纹藤壶主要分布在潮间带至潮下带,鳞笠藤壶主要分布在无遮蔽海岸或湾口附近的潮间带。在7—36盐度范围内致密纹藤壶无节幼虫均能发育至金星幼虫,以7—24盐度金星幼虫存活率更高,说明致密纹藤壶更适应低盐的水体;这与致密纹藤壶是广盐性种,多适应在咸淡水域中有关[34]。
本研究在22—42盐度范围内刺巨藤壶无节幼虫均能发育至金星幼虫,各盐度梯度幼虫发育时间相差不大,金星幼虫的存活率以26—34盐度的最高。这与本种分布在低潮区或潮下带有关,对盐度适应的范围相对窄些也高些。这个结论进一步说明培养蔓足类幼虫合适的盐度往往与成体分布海域的盐度相吻合。在低盐条件下(22、26)培养的刺巨藤壶金星幼虫体长较其它高盐度的长,而致密纹藤壶无节幼体在高盐条件下更长[34]。两者的结果说明在过高或过低的盐度环境中个体的大小会增加。面对调节渗透压的压力,海洋动物会通过形态、行为或生理等方面作出相应的适应调整[34],致密纹藤壶是在高盐下个体更长,而刺巨藤壶是低盐下个体更长。
3.3 温度对刺巨藤壶幼虫发育的影响
除盐度外,温度也是影响蔓足类生长发育、繁殖及其分布状况的关键因素。温度降低会延缓幼虫发育,降低变态率,类似现象在三角藤壶[6]、篱藤壶(Elminiusmodestus)[29]、纹藤壶[6,30]、象牙纹藤壶[37]和巨藤壶 (M.coccopoma)[32]等均有报道。
网纹纹藤壶幼虫发育及附着的适宜温度为18—30℃,12℃低温对其发育影响不大但不能附着[13]。网纹纹藤壶为热带亚热带暖水种,调查表明在网纹纹藤壶终年均可繁殖附着的湛江港海域其全年水温约为17—30℃[38],这与上述结果显示的网纹纹藤壶金星幼虫附着所需的温度状况基本一致。随着温度的上升,龟足(Capitulummitella)幼虫发育时间从24℃的11 d缩短为30℃的7 d;幼虫可在 21—33℃发育,而适宜的温度是24—30℃[39—40]。这与龟足分布海区繁殖期的水温是19.5—27.2℃、3次繁殖高峰期水温均高于25℃相吻合[41]。温度也显著影响指茗荷幼虫的发育速度,随着温度提高,发育时间缩短;高温和低温条件下金星幼虫存活率较低,存活率以15℃和20℃的较高,这与分布海域其繁殖季节的温度相一致[23]。因此,室内培养蔓足类幼虫合适的温度往往与成体分布海域繁殖季节的温度相一致。
在本实验中温度对刺巨藤壶幼虫发育时间和存活率有显著影响。在一定的温度范围内,随温度的上升发育时间缩短,18℃时金星幼虫发育时间长达14 d,而30℃时仅需7.3 d。在过低(14℃)或过高(34℃)的温度幼虫均不能完成发育,在18—30℃无节幼虫均能培养至金星幼虫,但以22℃和26℃的金星幼虫存活率最高。温度同样会影响个体的大小。在20℃培养的纹藤壶金星幼虫比30℃的金星幼虫小[4],来自Helgoland岛篱藤壶的Ⅵ期无节幼虫个体在低温培养下更大[29],而本结果同样在低温(18℃)培养的刺巨藤壶金星幼虫体长更长。综合而言,刺巨藤壶幼虫培养的适宜温度是22—26℃。这也与其分布在热带和亚热带海域低潮区或潮下带相关。
