白簕中性多糖对2型糖尿病小鼠糖脂代谢的作用
2022-11-25李玉明廖程娟朱沅如潘育方杨慧文
李玉明 廖程娟 朱沅如 刘 悦 潘育方 杨慧文
广东药科大学药学院,广东 广州 510006
2型糖尿病(type 2 diabetes mellitus, T2DM)是遗传因素与环境因素共同作用的一种以高血糖为特征的代谢性疾病,主要由胰岛素抵抗引起的糖、脂肪和蛋白质代谢紊乱[1],是一种最常见的糖尿病类型,在糖尿病人群中占90%以上[2]。最新调查显示,2型糖尿病发病率呈逐年上升趋势,表明我国糖尿病防治工作仍面临巨大挑战。2型糖尿病患者往往存在脂代谢紊乱,如高甘油三酯血症、高密度脂蛋白降低、低密度脂蛋白增加[3]。慢性高血糖和高脂血症可导致糖尿病并发症,长期的高血糖状态会导致脂质过氧化反应的终产物MDA含量升高[4]。有研究[5-6]表明糖尿病及其并发症的发生与活性氧自由基的产生和氧化应激增加有密切关联。抗氧剂超氧化歧化酶(SOD)和终产物丙二醛(MDA)是衡量过氧化反应的两个重要指标。
研究[7-9]表明,天然植物多糖大多具有降血糖、降血脂、抗氧化等作用,其可通过提高SOD等抗氧化物酶活性,减少MDA生成,降低2型糖尿病的TG、TC和LDL-C水平,升高HDL-C水平,从而达到降脂降糖的目的[10]。白簕[Acanthopanaxtrifoliatus(L.)Merr.]为五加科(Araliaceae)五加属(Acanthopananx)攀援状灌木,广泛分布在华南和华中地区,如岭南地区,本品味苦、辛,性凉[11]。白簕的有效活性成分主要有挥发油、多糖、黄酮类、皂苷、萜类等,有舒筋活络、理气、解热镇痛、解毒、祛风除湿和止咳之效[12]。我们前期研究发现,白簕中性多糖(ATP1-1)对1型糖尿病模型小鼠具有降糖效果,但其对2型糖尿病小鼠是否具有类似的作用尚未有研究。本研究旨在运用高脂高糖饮食联合链脲佐菌素(STZ)建立2型糖尿病小鼠模型,探索ATP1-1对T2DM小鼠降血糖效果以及其对体内脂代谢紊乱的调节作用,为ATP1-1的开发与利用提供理论依据。
1 材料与方法
1.1 材料 链脲佐菌素(STZ,美国sigma公司);盐酸二甲双胍片(石家庄市普利制药有限公司);小鼠胰岛素ELISA试剂盒(泉州市睿信生物科技有限公司);总蛋白定量测定试剂盒(考马斯亮蓝法)、超氧化物歧化酶测定试剂盒(WST-1)、丙二醛试剂盒(TBA法)、TC试剂盒、TG试剂盒、LDL-C试剂盒、HDL-C试剂盒等均由南京建成科技有限公司提供。白簕摘自广东恩平市,经广东药科大学中药学院副教授刘基柱鉴定为五加属植物白簕[Acanthopananxtrifoliatus(L.)Merr.]的茎。
1.2 仪器 XW-80A微型旋涡混匀器(上海沪西分析仪器厂),数显恒温水浴锅HH-2(常州市澳华仪器有限公司),分析天平(赛多利斯科学仪器北京有限公司),LD4-2A离心机(北京新时代北利医疗器械有限公司),血糖试纸和安稳型血糖仪(三诺生物传感技术股份有限公司),SpectraMax190连续波长多功能酶标仪(美国Molecular Devices公司)。
1.3 白簕多糖(ATP1-1)的提取分离 取干燥的白簕茎适量经95%乙醇浸泡数小时,过滤、加水煎煮、浓缩水提液,加入80%乙醇浸泡数小时,经离心取沉淀物冷冻干燥即得白簕粗多糖ATP。经DEAE-52纤维素柱分离ATP,蒸馏水洗脱,苯酚-硫酸法跟踪检测洗脱液中多糖含量,收集洗脱液浓缩即得中性多糖ATP1。经SephadexG-75凝胶柱分离中性多糖ATP1-1,蒸馏水洗脱,收集洗脱液浓缩,冷冻干燥,即得中性多糖ATP1-1。
1.4 动物 C57BL/6小鼠36只,18~22 g,动物许可证号:SCXK(粤)2018-0002,购于广东省医学实验动物中心,饲养于广东药科大学实验动物中心SPF级环境,实验过程严格遵循现行的广东药科大学实验动物伦理委员会批准的相关法律,符合实验动物伦理。
1.5 方法
1.5.1 动物造模、分组与给药 普通饲料适应性喂养小鼠7 d,将小鼠随机分为正常组(n=6)和模型组(n=30),正常组喂普通饲料,模型组给予高脂高糖饲料喂养一个月后,小鼠禁食不禁水12 h,腹腔注射STZ 130 mg/kg。注射STZ结束一周后,禁食不禁水6 h,尾部取血测小鼠空腹血糖值,血糖值>11.1 mmol/L视为造模成功。待模型稳定后,将造模成功的24只小鼠按血糖值随机分为4组(n=6),分别为模型组、阳性组、ATP1-1低剂量组、ATP1-1高剂量组。阳性组灌胃185 mg/kg二甲双胍溶液,低、高剂量组分别灌胃40 mg/kg、80 mg/kg ATP1-1溶液,模型组和正常组分别灌胃等体积的双蒸水,每天给药1次,连续8周。期间正常组持续给予基础饲料,其余给予高脂高糖饲料,给药期间自由摄食和饮水,每周称量并记录体重。
1.5.2 样品采集 给药后第8周,禁食不禁水12 h,称量各组小鼠体重,眼眶取血,4000 r离心15 min,收集血清于-20 ℃保存。随后迅速取出肝脏,用生理盐水洗净,拭干,称重,锡纸包裹,液氮保存,用于后续指标测定。
1.6 指标测定
1.6.1 空腹血糖值 于给药后的第7、14、21、28、35、42、49、56天,禁食不禁水6 h,尾部取血,测定空腹血糖值。
1.6.2 小鼠糖耐量值 连续灌胃给药8周后,禁食不禁水12 h,按2 g/(kg·bw)剂量灌胃葡萄糖,尾部取血测定灌胃葡萄糖后0 min、15 min、30 min、60 min、120 min、150 min的血糖值,观察各组小鼠不同时间点的血糖变化。血糖曲线下面积(AUC)按照以下公式计算:
AUC(min·mmol/L)=7.5A+15B+22.5C+45D+45E+15F
(1)
式(1)中:A、B、C、D、E和F分别表示灌胃后0 min、15 min、30 min、60 min、120 min、150 min的血糖值。
1.6.3 血清和肝脏理化指标 血清中TG、TC、LDL-C、HDL-C、胰岛素水平和肝组织中的MDA含量、SOD酶活力均根据试剂盒说明书来测定。
1.7 肝脏组织切片分析 解剖摘取各组小鼠肝脏,经4%多聚甲醛固定,固定状态良好后,进行修剪、脱水、包埋、切片、染色、封片制作切片,苏木精-伊红(HE)染色,光学显微镜下观察肝组织结构,进行分析。
2 结果
2.1 ATP1-1对糖尿病小鼠体重、饮食量以及饮水量的影响 由表1可知,给药前糖尿病小鼠的体重明显低于正常组(P<0.01),饮食量、饮水量高于正常组(P<0.05);同时各组糖尿病小鼠之间的体重、饮食饮水量均无明显差异。给药第8周时,阳性组及ATP1-1高、低剂量组的小鼠体重明显高于模型组(P<0.05);与0周时相比,ATP1-1高剂量组及阳性组显著增加(P<0.05),说明给药可有效提高糖尿病小鼠的体重。由图1a可知,给药前糖尿病小鼠的饮食量显著高于正常组(P<0.05),到第8周时阳性组、ATP1-1高、低剂量组的饮食量明显低于模型组(P<0.05),ATP1-1高剂量具有极显著差异(P<0.01);ATP1-1高、低剂量组的饮食量接近正常组(P>0.05)。由图1 b可见,经过8周的给药治疗,阳性组及ATP1-1高剂量组的饮水量显著降低(P<0.05)。结果表明,ATP1-1能够促使2型糖尿病模型小鼠的体重及饮食饮水量趋于正常。

表1 各组小鼠的体重变化

a.饮食量变化柱状图;b.饮水量变化柱状图;与模型组相比,*P<0.05,**P<0.01;与正常组相比,#P<0.05,##P<0.01;与第0周相比,△P<0.05,△△P<0.01图1 各组小鼠饮食量与饮水量的变化图
2.2 ATP1-1对糖尿病小鼠空腹血糖的作用 空腹血糖值是临床上判断糖尿病的基础指标,反映自身胰岛β细胞的能力[13]。给药前,糖尿病小鼠的空腹血糖值均大于16.7 mmol/L,明显高于正常组。给药期间,正常组小鼠空腹血糖值稳定在正常范围,模型组小鼠血糖值持续处于高血糖状态,阳性组,ATP1-1高、低剂量组各小鼠血糖水平在给药后第2周开始有所降低,第4周时显著低于同期模型组的空腹血糖(P<0.05),第8周时各给药组血糖均极显著性低于模型组(P<0.01)。
2.3 ATP1-1对糖尿病小鼠糖耐量的作用 由图3a可知,灌胃葡萄糖后各组小鼠血糖均急剧升高,15 min时达到最高值;30 min开始各给药组血糖值明显下降,速度快于模型组小鼠,150 min时各给药组的血糖值降回初始值。由式(1)计算血糖含量曲线下面积(AUC)可知,如图3b正常组及各给药组的AUC均显著低于模型组(P<0.05),其中高剂量组的效果优于低剂量组。AUC反映血糖含量的变化趋势,且AUC越小代表对葡萄糖耐受能力越好,结果表明ATP1-1能够改善2型糖尿病小鼠的葡萄糖耐受能力,增强对血糖的调控。
2.4 ATP1-1对糖尿病小鼠血清TG、TC、HDL-C、LDL-C及胰岛素水平的影响 如表2和图4所示,与正常组相比,模型组小鼠的血清TG、TC、LDL-C明显升高(P<0.01),HDL-C、血清胰岛素明显降低(P<0.01)。治疗8周后,与模型组相比,各给药组的TC、TG、LDL-C的水平显著降低,HDL-C、胰岛素的水平显著升高(P<0.05),且ATP1-1高剂量的效果与二甲双胍相当,表明ATP1-1可明显改善2型糖尿病小鼠的脂代谢紊乱症状,并增加胰岛素分泌。

与模型组比较,*P<0.05,**P<0.01

a.灌胃葡萄糖后的血糖变化曲线;b.血糖响应曲线下面积(AUC);与模型组比较,*P<0.05;**P<0.01图3 各组小鼠糖耐量及曲线下面积的变化图

表2 各组小鼠血脂四项的检测结果

与模型组比,**P<0.01
2.5 ATP1-1对糖尿病小鼠肝脏SOD酶活性及MDA含量的影响 由图5a可知,模型组小鼠肝脏SOD酶活性明显低于正常组(P<0.01),由图5b可知,MDA含量高于正常组(P<0.05),这表明2型糖尿病小鼠的肝脏抗氧化能力下降。经ATP1-1不同剂量治疗8周后,糖尿病小鼠的SOD酶活性均显著升高(P<0.01),MDA的含量明显下降(P<0.05),其中高剂量效果更优。
2.6 ATP1-1对糖尿病小鼠肝脏组织结构的影响 由图6可知,正常组小鼠肝细胞结构清晰,排列整齐紧密,无瘀血等病变现象,而模型组小鼠肝细胞排列紊乱,较多细胞水肿,胞体肿胀,较多细胞空泡变性(如图中箭头所示)。与模型组相比,阳性组小鼠肝细胞排列较整齐,形态有所改善,轻微空泡变性;ATP1-1各剂量组小鼠肝细胞排列较整齐,细胞形态得到改善,空泡变性减少。以上说明,ATP1-1对2型糖尿病造成的小鼠肝脏损伤有改善修复作用,且高剂量效果更好。

a.SOD酶活力变化柱状图;b. MDA含量变化柱状图;与模型组比较,*P<0.05,**P<0.01图5 各组小鼠肝脏的氧化指标图
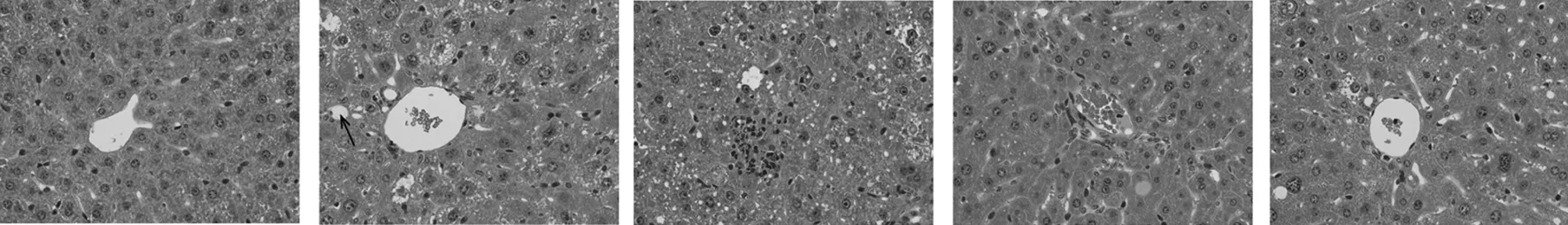
正常组 模型组 阳性组 ATP1-1高剂量组 ATP1-1低剂量组图6 小鼠肝脏组织HE染色结果图(×400)
3 讨论
研究[14-16]表明,人参、西洋参、刺五加等五加科天然植物多糖在降血糖的同时还具有降血脂的功效。白簕为五加科五加属植物,在前期研究中发现其精制多糖ATP1-1具有降低1型糖尿病小鼠血糖的作用,本文采用高脂饲料加注射STZ建立2型糖尿病小鼠模型,进一步发现ATP1-1在具有降糖功效的同时也可有效降低血脂。
空腹血糖、糖耐量及胰岛素水平是判断糖尿病的重要指标,糖耐量用于衡量机体对葡萄糖的耐受能力;胰岛素作为体内唯一能降血糖的激素,可通过促进靶细胞对葡萄糖的摄取、贮存和利用及对脂肪的合成,抑制糖原及脂肪的分解来降低血糖。当摄入大量的葡萄糖后,机体会迅速促进分泌胰岛素,使血糖降低至正常范围。本研究中糖尿病模型组小鼠一直维持高血糖及多饮多食的特征,胰岛素水平很低,可见造模后小鼠自身血糖调节能力下降,与文献[17]一致,说明造模成功;给药后ATP1-1可有效改善糖尿病小鼠的相关症状,提高小鼠对葡萄糖的耐受能力,提高机体胰岛素水平,结合课题组前期结果[18],说明ATP1-1对1、2型糖尿病小鼠均有治疗作用。
2型糖尿病患者在出现血糖水平异常的同时往往伴有血脂水平代谢的异常[19],姚欣卉等[20]研究表明2型糖尿病小鼠也会出现与患者相似的临床症状。实验中发现,糖尿病小鼠的TG、TC、LDL-C显著上升,HDL-C显著下降,呈现血脂代谢异常的典型特征;经ATP1-1治疗8周的糖尿病小鼠血脂四项结果明显得到了改善,说明ATP1-1对脂代谢紊乱有调节作用,具有降血脂作用。
糖尿病的糖脂代谢异常与氧化应激水平相关[21-23],糖尿病患者体内活性氧簇(ROS)过量的产生,可加重胰岛素抵抗、引起血糖升高以及胰岛细胞抗氧化能力的降低,导致机体氧化还原稳态失衡[24-25]。SOD、过氧化氢酶、谷胱甘肽酶等抗氧化酶均能降低机体的氧化应激水平,从而改善脂代谢异常,其中SOD是关键酶之一;SOD是一种能有效清理超氧自由基减少肝脏损伤的抗过氧化酶,其表达增加能降低机体氧化应激,保护胰岛β细胞,改善高脂饮食诱导的葡萄糖耐量受损、胰岛素抵抗和脂质氧化[26]。体内过多的自由基常与蛋白质、磷脂发生过氧化反应造成不可逆转的修饰与损伤,其作用产生MDA、4羟基壬烯醛等醛类活性产物;MDA作为脂质过氧化终产物,能间接反映体内脂质过氧化反应发生的水平,对体内脂代谢情况有一定的指示意义。本实验发现ATP1-1治疗后,糖尿病小鼠肝脏内的SOD酶活性升高,MDA含量减少,表明该多糖可提高抗氧化酶SOD活性,抑制体内过氧化反应,从而达到改善脂代谢的目的。
综上,ATP1-1可降低2型糖尿病模型小鼠的血糖及血脂,改善脂代谢紊乱,该作用与提高体内抗氧化酶活性,减少脂质过氧化有关。
