不同饵料对大口黑鲈生长性能和肠道微生物的影响
2022-11-25钟立强王海骁王明华张世勇姜虎成陈校辉
钟立强 王海骁 王明华* 张世勇 姜虎成 陈校辉*
(1. 江苏省淡水水产研究所, 南京 210017; 2. 南通市农业农村局, 南通 226000)
大口黑鲈(Micropterus salmoides), 又名加州鲈,原产于北美洲, 是美国重要的养殖和休闲垂钓品种[1]。1983年引入我国广东后, 因其肉质鲜美、生长迅速、抗病力强, 迅速成为我国重要的特色淡水经济鱼类, 养殖规模和产量不断扩大, “十一五”末全国产量18.59×107kg, 十三五末增加至61.95×107kg[2,3]。大口黑鲈生性凶猛, 在自然生态系统中是顶级肉食性鱼类。因此, 我国大口黑鲈的养殖长期以海水冰鲜杂鱼作为主要饵料。然而, 冰鲜鱼饵料转化率低,需求量大, 其野蛮捕捞对近海渔业资源和生态系统造成了难以估量的损失。同时, 在养殖过程中长期大量的冰鲜鱼投喂也给养殖水体带来了巨量的有机质和营养盐, 导致养殖池塘水体富营养化。此外, 冰鲜鱼投喂存在将海水致病微生物和病毒带入养殖池塘的风险, 给大口黑鲈养殖产业带来巨大损失的虹彩病毒(Ranavirus)就可能来自海水冰鲜鱼[4]。随着国家推进渔业供给侧结构性改革, 实现水产绿色健康养殖的迫切要求, 加快转变水产养殖方式、持续改善养殖生态环境、提升产业发展质量、全力推进水产养殖业绿色发展的目标已经势在必行。2020年, 农业农村部决定实施的水产绿色健康养殖“五大行动”中, 配合饲料替代幼杂鱼行动方案就包含在内[5]。大口黑鲈养殖配合饲料取代冰鲜鱼已经在各主养省份强力开展, 初步统计, 全国配合饲料替代率平均已超70%。生产一线调研发现, 冰鲜鱼和配合饲料投喂池塘的产量相当, 配合饲料投喂的鱼相对规格整齐, 但冰鲜鱼投喂池塘会有一部分鱼摄食能力强, 生长快, 可以提前上市, 获得更高的养殖边际收益。因此, 配合饲料完全替代幼杂鱼的行动存在一定的经济效益阻力, 依然需要加大推进力度。
大口黑鲈配合饲料的前期研究主要关注于营养需求和饲料配方[6—10], 目的是更好地改进饲料,提高转化效率。配合饲料投喂对大口黑鲈生长[11—15]、肌肉营养组成[12,13,16]、免疫和消化功能[11,13—15]的研究已经广泛开展。研究表明饵料能改变鱼类的肠道菌群[17,18], 并通过微生物-肠-脑影响鱼类的免疫和生长[19,20]。大口黑鲈的投喂研究表明, 与冰鲜杂鱼相比, 人工配合饲料降低了大口黑鲈肠道菌群多样性, 也抑制了拟杆菌等有益菌在大口黑鲈肠道内的分布[21]。但是该研究采用的变性梯度凝胶电泳(PCR-DGGE)技术, 对于肠道菌群只能定性研究,且菌群识别度也存在一定的缺陷。因此, 本研究通过对肠道菌群的16S rRNA的V3−V4区进行Illumina测序, 探讨冰鲜鱼和配合饲料对大口黑鲈生长性能和肠道菌群的影响, 以期为大口黑鲈配合饲料改进和冰鲜鱼替代提供参考。
1 材料与方法
1.1 试验设置
试验在江苏省淡水水产研究所浦口基地开展,选择标准化养殖池塘6个(面积0.3公顷左右, 水深1.5 m)。5月初, 按22500 条/公顷的密度投放5 cm左右的大口黑鲈苗。试验设冰鲜鱼组(B)、配合饲料组(S)和冰鲜鱼配合饲料混合组(H), 每组2个重复。每日早晚两次投喂, 首月配合饲料投喂量为鱼体重4%, 之后逐步下降, 9—10月投喂量为2%, 冰鲜鱼投喂量为配合饲料的4倍, 混合组上午投喂配合饲料,下午投喂冰鲜鱼。配合饲料为加州鲈膨化配合饲料(浙江欣欣天恩水产饲料股份有限公司), 饲料成分和营养组成为: 粗蛋白≥45.0%, 粗脂肪≥10.0%,粗纤维≤5.0%, 粗灰分≤16.0%, 水分≤10.0%, 总磷=1.0%—3.0%, 赖氨酸≥2.5%。
1.2 样品采集
试验养殖周期5个月, 期间所有池塘开展正常养殖管理。10月中旬养殖试验结束, 饥饿24h后, 每口池塘旋网随机捕捞15尾个体(每组30尾), 测量体长、体重, 用解剖剪沿肛门向上朝前呈弧形剪开腹腔, 完整取出内脏, 测量内脏、肝脏和鱼体空壳重。
每个试验组取5尾鱼, 用消毒后的解剖剪将肠道剪下, 置于酒精消毒过的解剖盘, 酒精棉擦拭肠管外壁后, 收集肠道内容物, 液氮速冻后, –80℃超低温冰箱保存备用。采水器采集每口池塘3处表层的50 cm水样, 放入灭菌塑料瓶。水样放入4℃保温箱带回实验室, 分析时样品为每组6个点水样的混合样。取300 mL混合水样经0.22 μm的聚碳酸酯膜(Millipore, Cork, Ireland)负压过滤, 得到3组滤膜样品(ST), 置于2 mL的无菌离心管, −80℃超低温冰箱冷冻保存。
1.3 DNA提取和PCR扩增
水样滤膜剪碎后, 微生物DNA利用E.Z.N.ATMWater DNA Kit(Omega, USA)试剂盒提取; 肠道微生物DNA使用E.Z.N.ATMSoil DNA Kit(Omega,USA)试剂盒提取, 具体方法参照试剂盒说明书。使用NanoDrop2000对DNA浓度和纯度进行检测。以通用引物338F和806R扩增16S rRNA基因V3—V4区[22], 扩增区域长度约450 bp, 建库及Illumina Miseq测序在上海美吉生物医药科技有限公司完成。
1.4 数据处理
生物信息学分析前, 先用Trimmomatic软件对原始数据进行质控, 再用FLASH软件完成序列拼接。生信分析利用上海美吉生物医药科技有限公司生信云平台完成(http://www.i-sanger.com/)。使用UPARSE软件(7.1)将序列以97%的相似性进行OTU聚类。利用RDP classifier(V2.2)对序列进行物种分类注释, 比对参考数据库为Silva_13816S rRNA database[23], 统计微生物分类水平的组成。后续分析前, 根据最少序列数进行抽平。利用Mothur软件(V 1.30.2)评估微生物群落的α多样性; 非度量多维尺度分析(NMDS)评估微生物群落的β多样性。通过多物种线性差异判别分析(LEfSe), 找出不同投喂组显著性差异的菌群[24]。利用PICRUSt菌群代谢功能预测工具与基因功能谱数据库进行比对, 推测微生物群落的功能类别丰度信息[25]。
1.5 计算公式
增重率(Weight growth rate,WGR, %)=100×(末体重–初体重)/初体重;
特定生长率(Specific growth rate,SGR, %/d)=100×(ln末体重–ln初体重)/试验天数;
饲料系数(Feed Conversion Rate,FCR)=饲料投喂量/(末体重–初体重);
肥满度(Condition factor,CF, g/cm3)=100×鱼体重/鱼体长3;
肝体比(Hepatosomatic index,HSI)=100×肝脏重/鱼体重;
脏体比(Viscerasomatic index,VSI)=100×内脏重/鱼体重;
空壳体质比(Deinternal organ rate,DOR)=100×空壳重/鱼体重。
1.6 数据分析
相关数据采用平均值±标准误表示, 采用SPSS 20.0 统计软件以饲料为单因素作方差分析(Oneway ANOVA), 统计显著水平设定为P<0.05。
2 结果
2.1 不同饵料对大口黑鲈生长的影响
表1显示, 配合饲料组试验鱼的末均重、体长、增重率和特定生长率均显著低于冰鲜鱼组和混合投喂组(P<0.05), 混合投喂组最后养成规格最大, 生长速度也最快, 但与冰鲜鱼组差异不显著(P>0.05)。饵料系数配合饲料组则显著低于冰鲜鱼和混合投喂组(P<0.05)。在3组鱼中, 冰鲜鱼组的个体肥满度最高, 显著高于配合饲料组(P<0.05); 混合投喂组居中, 与其他两组无显著差异(P>0.05)。而脏体比刚好相反, 配合饲料组最高, 混合投喂组居中, 两组都显著高于冰鲜鱼组(P<0.05)。肝体比则是配合饲料组最高, 冰鲜鱼组其次, 混合投喂组最低, 3组间存在显著性的差异(P<0.05)。
2.2 测序数据和多样性
Illumina测序共获得909538条序列, 平均每个样品有50529条序列, 序列平均长度为440 bp。按97%相似度聚类后得到2418个OTUs, 分属于38门、108纲、248目、428科、 892属、1467种。
稀释曲线分析中所有样本的都接近平缓, 表明测序深度能够反映每个样本细菌群落的生物信息。选取Ace指数、Chao1指数、Shannon指数和Simpson指数反映试验大口黑鲈肠道菌群的α多样性, 结果显示, 配合饲料投喂组Ace指数和Chao1指数最高, 即其肠道菌群物种的丰富度最高, 冰鲜鱼组最低, 混合投喂组居中; 但冰鲜鱼组Shannon指数最高、Simpson指数最低, 肠道菌群多样性最高, 配合饲料投喂组次之, 混合投喂组最低(表2)。
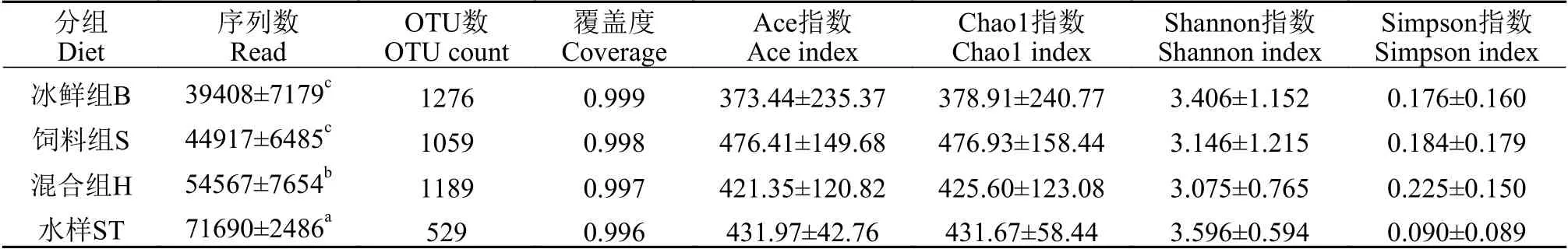
表2 样品序列数统计及菌群多样性分析Tab. 2 Numbers of reads and diversity indexs of different samples
非度量多维尺度分析(NMDS)展示不同投喂组大口黑鲈肠道菌群的β多样性。从NMDS分布图可见(图1), 所有分组的样本呈现出较好聚类趋势, 所有组别可以明显区分, 同一组别内的样品间距离更近, 其微生物群落也更相似(R2=0.4366,P=0.001)。NMDS分析的stress值为0.131表明排序结果相对可靠。
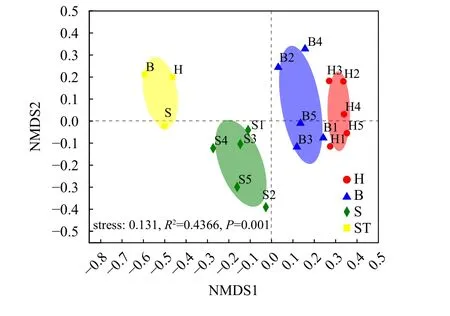
图1 大口黑鲈肠道菌群NMDS排序图Fig. 1 NMDS plot of the compositional dissimilarities of the bacterial communitiesB. 冰鲜鱼组; S. 配合饲料组; H. 混合投喂组; ST. 养殖池塘水体B. Frozen fish group samples; S. Formulated feed group samples;H. Group samples; ST. Water samples of three ponds
2.3 肠道微生物群落组成
韦恩图表明, 不同投喂组大口黑鲈肠道菌群样本中OTU数量从高到低为冰鲜鱼组>混合投喂组>配合饲料组, 且3组鱼类肠道菌群的OTU数量远高于养殖池塘水体菌群(图2)。4组样本共享的OTU150个, 占全部OTU的6.20%, 而3个投喂组大口黑鲈肠道菌群间共享OTU为206个, 占比8.52%。3个投喂组之间, 冰鲜鱼组和混合投喂组共享OTU最多, 为159个, 而冰鲜鱼组和配合饲料组之间共享OTU最少, 仅83个。冰鲜鱼组独有OTU也最多, 有579个,混合投喂组次之, 为459个, 配合饲料组最少, 仅263个。不同饵料对肠道菌群造成了明显的影响。
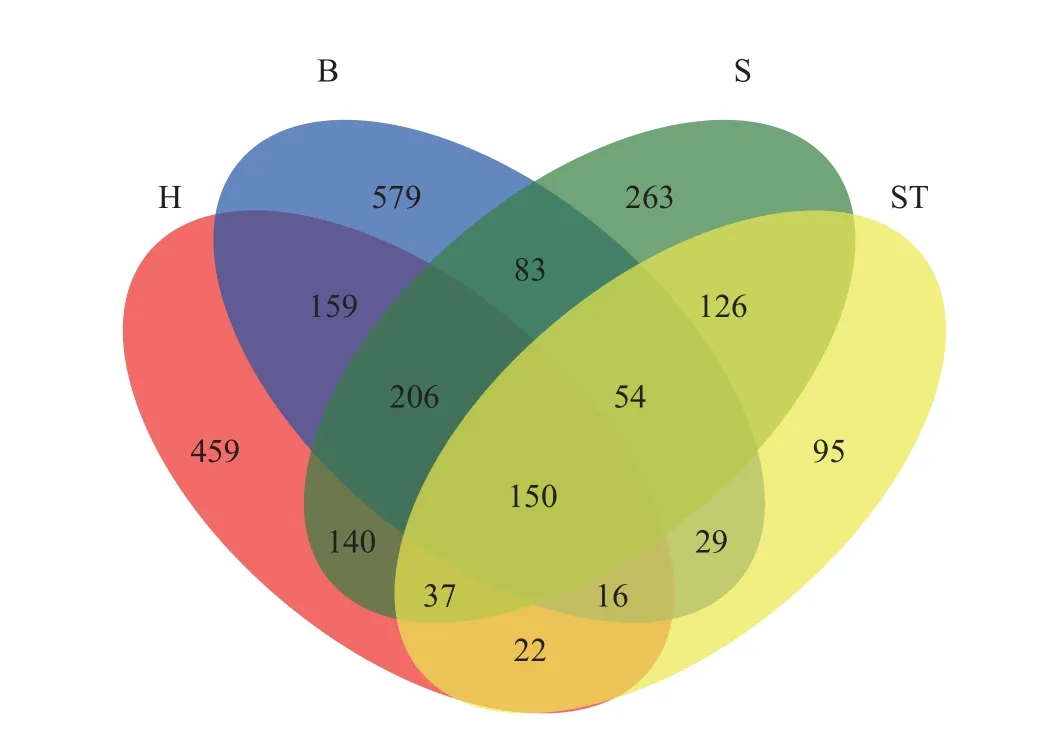
图2 不同组别OTUs的韦恩图Fig. 2 The venn diagram of each groups’s OTUs
ANOSIM检验表明4个组别样品间细菌群落组成在门水平上存在显著性差异(P=0.029)。鉴定出的38个门中, 厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、蓝藻门(Cyanobacteria)、拟杆菌门(Bacteroidota)、浮霉菌门(Planctomycetota)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteriota)是主要菌门, 其余30个门相对丰度都低于1%。厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)是4个组的优势菌群, 相对丰度都超过了50%(图3a)。3个投喂组间比较, 冰鲜鱼组蓝藻门(Cyanobacteria)和拟杆菌门(Bacteroidota)相对丰度最高, 配合饲料组则是变形菌门(Proteobacteria)和放线菌门(Actinobacteriota)相对丰度最高, 混合投喂组则是厚壁菌门(Firmicutes)、浮霉菌门(Planctomycetota)和酸杆菌门(Acidobacteriota)相对丰度最高。养殖水体的群落结构与肠道菌群存在着明显的差异。单因素方差分析(One-way ANOVA)显示, 厚壁菌门(Firmicutes)在4个试验组间存在显著性差异(P=0.02)。
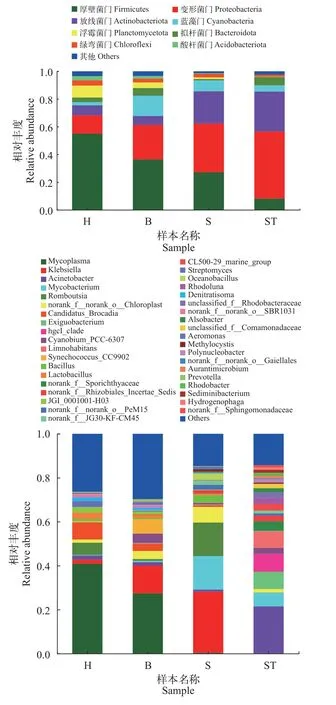
图3 不同试验组在门和属水平物种相对丰度Fig. 3 Relative abundance of species in phylum and genus levela. 门水平; b. 属水平a. Phylum level; b. Genus level
属水平上(图3b), 冰鲜鱼组的优势菌属主要为支原体属(Mycoplasma, 27.45%)、克雷伯氏菌属(Klebsiella, 12.63%)及聚球菌属(Synechococcus_CC9902, 6.53%); 配合饲料组优势菌属分别为克雷伯氏菌属(Klebsiella, 27.78%)、罗姆布茨菌(Romboutsia, 15.26%)及分枝杆菌属(Mycobacterium,15.25%); 混合投喂组优势菌属则是支原体属(Mycoplasma, 40.91%)、厌氧氨氧化菌(Candidatus_Brocadia, 7.70%)及罗姆布茨菌(Romboutsia, 5.58%);而养殖水体中菌属与大口黑鲈肠道菌群存在明显的差异, 优势菌群主要是不动杆菌属(Acinetobacter,21.40%)、(hgcI_clade, 8.07%)、微小杆菌属(Exiguobacterium, 7.87%)及栖湖菌属(Limnohabitans,7.52%)。单因素方差分析(One-way ANOVA)显示,在主要菌属中, 支原体属 (Mycoplasma)在4个试验组间存在显著性差异(P=0.01)。
2.4 菌群差异性分析
为了进一步分析不同饵料对大口黑鲈肠道菌群的影响, 采用LefSe软件对3组肠道菌群样本进行线性判别分析(LDA), 以找到对不同投喂方法显著性响应的类群。对LDA判别值大于4的细菌类群进行分析, 共有不同分类水平的25个细菌类群在3个投喂组间具有显著差异(P<0.05, 图 4)。3个投喂组的显著优势菌群都相对集中, 冰鲜鱼组集中于拟杆菌门(Bacteroidota), 拟杆菌目(Bacteroidia), 拟杆菌纲(Bacteroidales), 以及海水蓝藻蓝菌属(Cyanobium)和聚球菌属(Synechococcus); 配合饲料组显著性优势菌群包括放线菌纲下的分枝杆菌和PeM15等6个类群, 以及厚壁菌门下的芽孢杆菌科(Bacillaceae);混合投喂组显著性优势菌群则包括芽孢杆菌纲(Bacilli)下支原体目(Mycoplasmatales)的4个类群,以及小月菌属(Microlunatus)和罗氏菌属(Roseburia)。
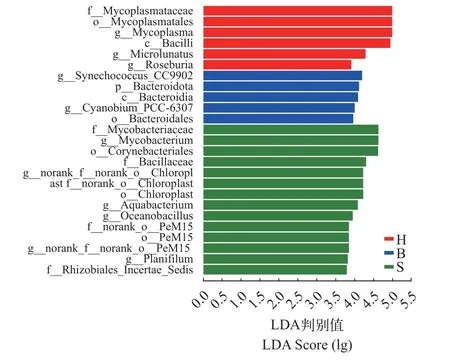
图4 不同饵料组间差异性菌群多物种线性差异判别分析Fig. 4 LEfSe identified the most differentially abundant taxa in different diet groups
2.5 细菌群落功能预测
利用PICRUSt 对不同投喂组大口黑鲈肠道菌群细菌群落的16S rRNA基因比对到KEGG数据库和EggNOG数据库进行功能预测。基于各样品KEGG比对获得的功能信息组成, 共获得322个代谢功能途径。KEGG代谢通路分析表明: 不同投喂组大口黑鲈肠道微生物主要参与新陈代谢, 其次参与遗传信息处理和环境信息处理(表3)。COG功能分类统计结果表明: 配合饲料投喂组大口黑鲈肠道菌群在“能量生产与转化”“碳水化合物运输和代谢”“氨基酸转运与代谢”和“脂质转运与代谢”等功能类群的相对丰度高于冰鲜鱼组和混合投喂组, 冰鲜鱼组大口黑鲈肠道菌群在“核苷酸的转运和代谢”“辅酶运输和代谢和翻译”“核糖体结构和生物发生”等功能类群的相对丰度高于配合饲料投喂组和混合投喂组(图5)。
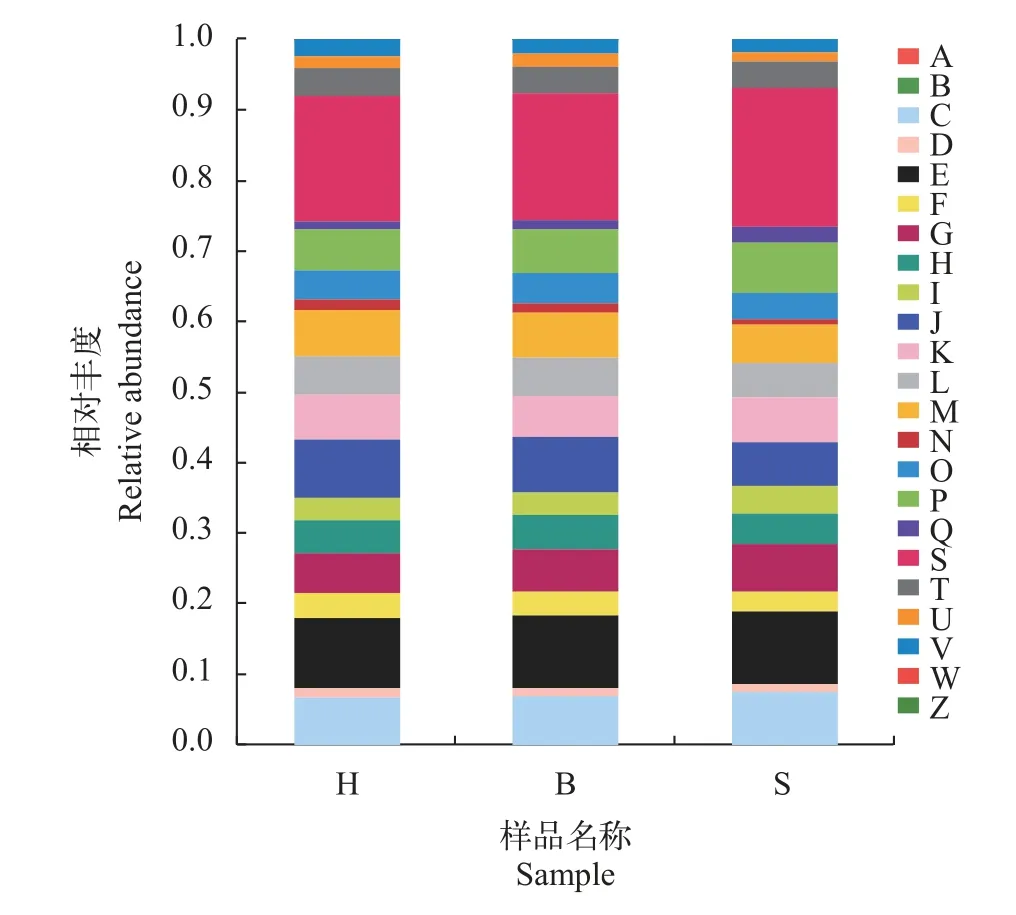
图5 不同投喂组肠道微生物的COG功能分类统计Fig. 5 The COG function classification of intestinal microorganisms in different dietA. RNA处理和修饰RNA processing and modification; B. 染色质结构与动力学Chromatin structure and dynamics; C. 能源生产与转化Energy production and conversion; D. 细胞周期控制、细胞分裂、染色体分裂Cell cycle control, cell division, chromosome partitioning; E. 氨基酸转运与代谢Amino acid transport and metabolism; F. 核苷酸的转运和代谢Nucleotide transport and metabolism; G. 碳水化合物运输和代谢Carbohydrate transport and metabolism; H. 辅酶运输和代谢Coenzyme transport and metabolism; I. 脂质转运与代谢Lipid transport and metabolism;J. 翻译、核糖体结构和生物发生Translation, ribosomal structure and biogenesis; K. 转录Transcription; L. 复制、重组和修复Replication, recombination and repair; M. 细胞壁/膜/信封生源论Cell wall/membrane/envelope biogenesis; N. 细胞运动Cell motility; O. 翻译后修饰、蛋白质周转、伴侣Posttranslational modification, protein turnover, chaperones; P. 无机离子运输与代谢Inorganic ion transport and metabolism; Q. 次生代谢产物的合成、运输和分解代谢Secondary metabolites biosynthesis, transport and catabolism; R. 一般功能预测General function prediction only; S. 功能未知Function unknown; T. 信号转导机制Signal transduction mechanisms; U. 细胞内运输、分泌和囊泡运输Intracellular trafficking, secretion, and vesicular transport; V. 防御机制Defense mechanisms; W. 真核细胞的细胞外结构Extracellular structures; Y. 核结构Nuclear structure; Z. 细胞骨架Cytoskeleton

表3 KEGG代谢通路统计Tab. 3 Metabolic pathway statistics based on KEGG
3 讨论
3.1 不同饵料对大口黑鲈生长的分析
饲料是养殖鱼类能量和营养物质的主要来源,因此决定着鱼类的生长发育, 对鱼类的健康免疫功能也具有重要影响。本实验结果显示, 不同饵料对大口黑鲈的生长具有显著影响(P<0.05), 配合饲料投喂组试验鱼的生长显著低于冰鲜鱼和混合投喂组。这与大菱鲆(Scophthalmus maximus)[26]、斜带石斑鱼(Epinephelus coioides)[27]和珍珠龙胆石斑鱼(Epinephelus fuscoguttatus♀×Epinephelus lanceolatus♂)[28]等肉食性鱼类的养殖对比试验结果一致。究其原因, 可能是冰鲜鱼的诱食效果好, 适口性强, 更利于大口黑鲈的摄食、消化与吸收。解剖取样现场发现, 3组大口黑鲈腹腔内脏团都被脂肪包裹, 这是由饵料中过高的能量/营养物质比所致[29],能量物质摄入体内部分用于新陈代谢, 过量部分就以脂肪的形式沉积在体内组织中。配合饲料中碳水化合物、脂肪和蛋白质含量高于冰鲜鱼[30], 其饵料系数显著低于冰鲜鱼, 饲料利用转化效率极高。而冰鲜鱼能量物质含量低, 水分占比极高(通常在65%—70%)[26,30], 因此其利用转化效率极低, 投喂量是配合饲料的4倍。3组鱼腹腔内都存在大量脂肪, 说明日常养殖过程中配合饲料和冰鲜鱼的投喂量可能超出了大口黑鲈的需求。目前大口黑鲈养殖的普遍存在多投喂、早上市, 追求市场边际效益最大化的现象, 这种养殖模式, 导致脂肪的大量沉积, 影响了鱼类健康, 同时加重了养殖环境的生态负担。我国水产行业已经从片面追求快速发展转换至提质增效绿色发展的新阶段, 农业农村部实施的水产绿色健康养殖“五大行动”中推广实施生态健康养殖模式、减少水产养殖用药量、配合饲料替代幼杂鱼都是大口黑鲈养殖未来需要积极改变的地方。使用配合饲料养殖对鱼类健康和养殖环境都有着显著的优势。但是, 大口黑鲈配合饲料还需要参考冰鲜鱼优质的营养特性, 优化和调整营养配方, 提升配合饲料的品质, 减少蛋白质浪费, 减轻环境污染, 有效促进大口黑鲈的健康生长, 最终提高出肉率, 降低体脂率, 增加养殖效益。
3.2 不同饵料对大口黑鲈肠道菌群多样性的影响分析
肠道微生物定植于宿主肠道中, 在宿主体内平衡、肠道发育、代谢, 甚至神经发育方面发挥着重要作用[31]。研究表明饵料能改变鱼类的肠道菌群,并通过肠-脑轴调节鱼类的免疫、生长和行为[19]。在本研究中, 不同饵料的投喂显著改变了大口黑鲈的肠道微生物多样性和群落结构。α-多样性分析结果表明, 配合饲料投喂组肠道菌群丰富度最高(由Ace指数和Chao1指数表征), 但是肠道菌群的多样性明显降低(由Shannon指数和Simpson指数表征)。该结果与大口黑鲈[21]、乌鳢(Ophiocephalus argus)[31]、花鲈(Lateolabrax japonicus)和日本黄姑鱼(Nibea japonica)[32]等多种鱼类的研究结论一致,原因可能是: (1)配合饲料生产过程中的高温高压膨化步骤杀灭了绝大多数微生物, 而冰鲜鱼则携带了大量的微生物, 因此冰鲜鱼被摄食后, 携带的一部分微生物会在肠道定植, 从而改变养殖鱼类的肠道菌群; (2)配合饲料中碳水化合物、脂肪和蛋白质含量过高, 导致参与运输和代谢的微生物丰度大幅增加, 多样性反而下降。β多样性排序分析样本呈现出较好聚类趋势, 所有组别可以明显区分, 也表明饵料对大口黑鲈的肠道微生物影响显著, 而养殖水体微生物对于肠道微生物影响相对较小。
3.3 不同饵料对大口黑鲈肠道菌群组成和功能的影响分析
不同饵料的投喂也显著改变了大口黑鲈的肠道微的群落结构(图3)。冰鲜鱼组蓝藻门(Cyanobacteria)和拟杆菌门(Bacteroidota)相对丰度最高。进一步的线性判别分析表明, 冰鲜鱼组特异性菌群主要集中于拟杆菌门(Bacteroidota), 拟杆菌目(Bacteroidia), 拟杆菌纲(Bacteroidales), 以及海水蓝藻蓝菌属(Cyanobium)和聚球菌属(Synechococcus)。蓝藻门细菌是养殖水体常见菌群, 属水平分析发现主要是海水蓝藻的聚球菌属(Synechococcus_CC9902),混合投喂组也有发现这些海水蓝藻蓝菌, 但配合饲料组却没有, 这应该是海水冰鲜鱼饵料中所携带,摄食后进入大口黑鲈肠道。拟杆菌是冰鲜组大口黑鲈肠道特异性细菌的结果与先前的研究一致[21]。拟杆菌能够帮助宿主分解营养物质, 提高消化吸收率并维持肠道微生态平衡, 其丰度与宿主脂肪含量密切相关, 而肠道内拟杆菌与厚壁菌的比例直接影响宿主的脂肪积累, 肥胖时脂肪积累主要与厚壁菌增加有关, 而健康动物的肠道则是拟杆菌门(Bacteroidota)的细菌较多[33]。配合饲料组则是变形菌门(Proteobacteria)和放线菌门(Actinobacteriota)相对丰度最高, 优势菌属为克雷伯氏菌属(Klebsiella)、罗姆布茨菌属(Romboutsia)和分枝杆菌属(Mycobacterium)。混合投喂组厚壁菌门(Firmicutes)丰度明显增加, 优势菌属则是支原体属(Mycoplasma)、厌氧氨氧化菌属(Candidatus_Brocadia)及罗姆布茨菌属(Romboutsia)。支原体是水生动物易感染的致病菌, 会破坏宿主免疫的系统并参与其他致病病变的发展和诱导疾病的加重[34], 混合投喂组和冰鲜鱼组支原体属(Mycoplasma)的丰度都显著高于配合饲料组, 可能是冰鲜鱼饵料所携带。冰鲜鱼水分含量高, 相比于标准化加工的配合饲料会携带更多微生物, 同时, 冰鲜鱼投喂量是配合饲料的4倍, 因此也更容易将所携带的微生物通过摄食传递定植与大口黑鲈肠道。所以, 从鱼类健康和食品质量安全角度评估, 配合饲料具有明显的安全优势。克雷伯氏菌属(Klebsiella)也属于条件致病菌, 能通过糖酵解和戊糖磷酸途径降解碳水化合物[35], 罗姆布茨菌属(Romboutsia)能将宿主难以消化的大分子碳水化合物发酵代谢为丁酸等短链脂肪酸, 降低肠道pH,提高宿主的免疫调节能力, 维持肠道微生态平衡[36]。这些菌群在配合饲料和混合投喂组是优势菌, 与配合饲料碳水化合物、脂肪和蛋白质含量有关, 碳水化合物、脂肪和蛋白质含量需要更多的相关菌群进行代谢。细菌群落功能预测, 进一步证实了饵料对大口黑鲈肠道群落结构的显著影响。配合饲料含有较高的碳水化合物、脂肪和蛋白质, 因此肠道菌群在“能量生产与转化”“碳水化合物运输和代谢”“氨基酸转运与代谢”和“脂质转运与代谢”等功能类群的相对丰度也高。
总之, 饵料对大口黑鲈的生长和肠道微生物都具有显著的影响。冰鲜鱼投喂组生长显著高于配合饲料投喂组, 表明现有配合饲料在诱食效果, 适口性及营养成分等方面依然无法满足鱼体及其肠道菌群的需求。混合投喂组生长最快, 表明冰鲜鱼并非最佳饵料, 配合饲料中添加的必需氨基酸、微量元素等营养物也促进了大口黑鲈的生长。因此,今后的大口黑鲈专用配合饲料的研发, 可以参考冰鲜鱼优质的营养特性, 优化和调整营养配方, 同时根据大口黑鲈的营养需求添加益生物质, 更好地促进大口黑鲈健康生长。
