周公河齐口裂腹鱼种群的遗传多样性和遗传结构
2022-11-25胡靖蕊曾丽雯杨世勇武佳韵
杨 鑫 黄 坤 胡靖蕊 曾丽雯 杨世勇 武佳韵
(1. 四川农业大学生命科学学院, 雅安 625000; 2. 四川农业大学动物科技学院, 温江 611130)
周公河发源于荥经、汉源和洪雅三县交界处的老鹰咀, 在瓦屋山镇附近汇合后始称周公河, 由南向北至雅安城下游2 km处汇入青衣江, 全长95.6 km,流域面积1120 km。周公河河道曲折、滩高水急、滩沱交替, 总落差约1700 m, 水力资源丰富。为开发周公河的水能资源, 当地政府在周公河上修建了瓦屋山、葫芦坝、将军坡、沙坪、河坪和大石板等多个水电站。然而, 水利水电工程的建设所引起的水环境的变化对于鱼类的生存存在严重影响, 水电站泄洪时引起的下游总溶解气体(TDG)过饱和现象会导致鱼类出现明显的气泡损伤, 死亡率也随着TDG的过饱和度上升而增长[1,2]。此外, 水利枢纽的建设还有可能会阻断不同区段鱼类的基因交流,使鱼类的生境和遗传结构片段化而导致鱼类区系组成及群落结构改变[3], 对洄游性鱼类的影响尤为显著。水电站蓄水引起水文和水环境的改变会直接影响洄游性鱼类的产卵量, 徐薇等[4]调查了银盘电站蓄水前后乌江下游洄游性鱼类的自然繁殖的变化, 结果显示产卵规模显著下降, 并且在所采集到的鱼卵种类组成中发现典型的流水生境繁殖类群减少, 缓静水生境繁殖类群增加。Quan等[5]研究了黄河源区水电站的建立对黄河本土鱼类花斑裸鲤(Gymnocypris eckloni Herzensten)产卵率及卵存活率的影响, 结果发现水力发电导致的水温降低将推迟花斑裸鲤的产卵期, 卵孵化的过程中将面临更高的风险。
齐口裂腹鱼(Schizothorax prenanti), 俗称雅鱼,是鲤科(Cyprinidae)裂腹鱼属(Schizothorax)的冷水性鱼类。周公河是其发源地之一, 齐口裂腹鱼曾是当地主要的渔获物, 占捕捞产量的70%左右; 然而近年来, 由于环境污染和过度捕捞等原因, 周公河中齐口裂腹鱼种群数量明显下降。在2002年周公河珍稀鱼类省级自然保护区成立后, 政府采取了一系列保护及增殖放流措施, 致力于保护周公河野生鱼类的自然种群资源, 在2010年前后针对种群数量较小的鲈鲤和重口裂腹鱼进行了人工增殖放流工作, 并未放流齐口裂腹鱼, 对齐口裂腹鱼自然种群的遗传起到了保护作用。
动物线粒体DNA(mitochondrial DNA, mtDNA)呈母系遗传, 具有较高的突变率, 而线粒体控制区(D-loop)属于线粒体DNA中的非编码区, 是线粒体DNA中进化速率最快的序列, 被广泛应用于鱼类群体遗传学和分子系统学的研究[6—8]。本研究在周公河上中下游分别设定采样点, 采用D-loop序列为分子标记研究了不同河段齐口裂腹鱼的遗传多样性和遗传结构, 为周公河齐口裂腹鱼资源的有效保护和水电站建设的环境影响评估提供科学依据。
1 材料与方法
1.1 采样地点
沿周公河上下游连续设立6个采样点(图1), 在渔政部门的协助下进行随机采集。在2016年7月至2018年9月间共采集野外齐口裂腹鱼样本63尾, 其中A(瓦屋山大坝王坪)采集12尾, B(瓦屋山大坝下游)采集6尾, C(罗坝)采集12尾, D(将军坡电站下游)采集15尾, E(罗村河大桥)采集14尾, F(张家湾)采集4尾。收集的样本在进行基本生物学测量之后取其鳍条进行DNA提取, 其余组织保存于100%酒精中。

图1 齐口裂腹鱼采样位点图Fig. 1 Sampling locations of S. prenantiA. 瓦屋山大坝王坪; B. 瓦屋山大坝下游; C. 罗坝; D. 将军坡电站下游; E. 罗村河大桥; F. 张家湾A. Wangping of Wawushan Dam; B. Downstream of Wawushan Dam; C. Luoba; D. Downstream of Jiangjunpo Hydropower Station; E. Luocun River Bridge; F. Zhangjiawan
1.2 实验内容及方法
基因组DNA提取及目的基因扩增采用海洋动物组织基因组DNA提取试剂盒(离心柱型)(TIANGEN, 北京)提取齐口裂腹鱼基因组DNA,1%琼脂糖凝胶电泳检测后, 以提取的DNA为模板,用鲤科鱼类线粒体控制区通用引物[9]DL1(5′-ACCC CTGGCTCCCAAAGC-3′) 和DH2 (5′-ATCTTA GCATCTTCAGTG-3′) 进行PCR扩增。扩增采用25 μL体系, 含有TaqE 12.5 μL, 模板DNA1 μL, 上下游引物各0.5 μL, 其余用超纯水补足。PCR扩增条件为95℃预变性4min, 92℃变性30s, 55℃退火1min,72℃延伸1min, 重复35个循环后4℃保存。用1%琼脂糖凝胶电泳检测PCR产物, 使用DNA纯化回收试剂盒(TIANGEN, 北京)进行胶回收后送英骏公司进行测序。
数据分析测序结果用Chromas和Contig软件进行排序和拼接, 辅以人工校对, 去除杂峰, 保留有效片段后使用Mega5.0软件进行序列变异情况、碱基组成及单倍型组成分析; 用PAUP软件依据最大似然法构建单倍型系统发育树, 自展检验(Bootstrap test)评估所建系统发育树的可靠性, 重复1000次评估各分支的置信值; 用DnaSP 4.0软件分析单倍型多态性和核苷酸多态性, 并计算种群间的遗传分化系数Fst, 使用公式Nm=(1–Fst)/2Fst计算群体间的基因流(Nm)。Arlequin软件进行AMOVA分析[10]。
2 结果
2.1 碱基组成及变异特征
本研究获得齐口裂腹鱼线粒体DNA D-loop区的长度为922 bp, 其基本结构可分为中间保守区和2个侧翼区。所有个体T、C、A和G 四种核苷酸的平均比例分别为33.1%、19.8%、32.8%和14.3%(表1),其中A+T含量(65.9%)明显高于C+G(34.1% ), 具有反G偏倚的特点, 符合鱼类线粒体控制区的碱基结构特征[11]。共获得32个单倍型, 从中检测到10个核苷酸变异位点, 占位点总数的0.011%, 均为简约信息位点(表2)。

表2 齐口裂腹鱼种群单倍型多态位点和个体数Tab. 2 Mutation sites and number in different haplotypes of S. prenanti populations
2.2 种群遗传多样性
周公河中齐口裂腹鱼种群的总核苷酸多态性为0.013, 其在不同种群中的变动范围为0.010—0.018; 总单倍型多态性为0.966, 不同种群中的变动范围为0.867—1.000(表1)。种群Pop F呈现出最大的遗传多样性(π=0.018,h=1.000); PopC的核苷酸多样性最低(π=0.010,h=0.970), 而PopB的单倍型多样性最低(π=0.015,h=0.867)。

表1 齐口裂腹鱼种群线粒体控制区碱基组成及多态性指数Tab. 1 Nucleotide composition and genetic diversity index of S. prenanti populations
2.3 种群间遗传分化
种群遗传学认为当Fst值在0—0.05时, 遗传分化较弱; 当Fst值在0.05—0.15时, 遗传分化中等; 当Fst值在0.15—0.25, 遗传分化较大; 当Fst值大于0.25时, 遗传分化极大[12]。在本研究的6个齐口裂腹鱼种群中, Pop C和Pop F间(Fst=0.195,P<0.01), Pop A和PopE间(Fst=0.158,P<0.01)的遗传分化较大且分化显著; PopE和PopF(Fst=0.045), PopB和PopD(Fst=0.049)之间的遗传分化较弱; 其他种群间均呈现中等水平的遗传分化(0.05

表3 齐口裂腹鱼种群间遗传分化系数(Fst)及基因流(Nm)Tab. 3 Genetic differentiation index (Fst) and gene flow (Nm)among S. prenanti populations
2.4 单倍型分布
在定义的32个单倍型中有19个私有单倍型,13个共享单倍型。共享单倍型集中在Pop D和PopE(各4个); PopA和PopC、Pop E各有两个共享单倍型; PopC和PopB、PopD各有两个共享单倍型;PopA和PopB、PopD、PopF各有1个共享单倍型;PopF和PopD、PopE各有1个共享单倍型。单倍型网络结构图显示, 在将军坡电站下游的种群独成一支, 且以单倍型hap21为中心(图2)。

图2 基于控制区序列构建齐口裂腹鱼种群的单倍型网络结构图Fig. 2 Median-joining network of the halpotypes of S. prenanti populations based on control region

续表 2
2.5 单倍型系统发育
以怀头鲶(Silurus soldatovi)和欧鲶(Silurus glanis)为外群, 以最大似然法(ML)构建的系统发育树显示: 所有的单倍型分为4支, 主要来自PopD种群的11个单倍型形成Clade A; 主要来自PopA种群的6个单倍型形成Clade B; 主要来自PopC种群的6个单倍型构成Clade C; 而主要来自PopB种群的9个单倍型构成Clade D(图3)。单倍型在种群间相互交叉分布的现象普遍。
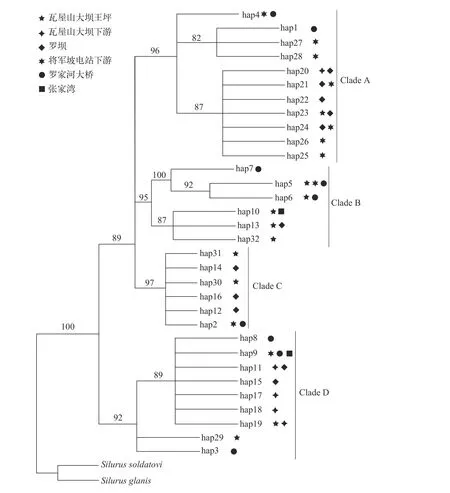
图3 齐口裂腹鱼种群单倍型ML分子系统树Fig. 3 ML phylogegenetic tree of the haplotypes of S. prenanti populations
3 讨论
物种的遗传多样性高低与其适应能力、生存能力和进化潜力密切相关[13]。张争世等[14]使用线粒体片段检测了长江上游4个齐口裂腹鱼野生群体(重庆巫溪大宁河、重庆城口任河、四川雅安大渡河和四川阿坝脚木足河)的遗传特性, 结果显示这4个齐口裂腹鱼种群的π的变动范围为0.007—0.012,h的变动范围为0.704—0.884, 且四川雅安群体与四川阿坝群体间遗传分化最小, 基因交流频繁。与张争世等[14]的研究相比, 本研究中6个齐口裂腹鱼群体的π值和h值略高, 但差异不大, 可能是周公河流域内部以及周公河与其他地区之间都存在一定的基因交流。本研究中PopF的π和h值最高(π=0.018,h=1.000), 遗传变异最丰富, 遗传多样性最高, 而PopB(h=0.867)和PopE(h=0.879)的h值较小,PopA(π=0.011)和PopC(π=0.010)的π值较小。PopF相对较高的遗传多样性可能与其采样地较适宜的水文条件和生存环境有关, 或者与其样本量较少有关。
Liang等[15]于2011年使用线粒体控制区序列检测了5个齐口裂腹鱼种群(高原湖泊伍须海、九龙河、木里河、大渡河和青衣江)的遗传特性, 其中青衣江齐口裂腹鱼种群的π为0.018,h为0.990。周公河与青衣江水路相通, 由南向北汇入青衣江。本研究中周公河齐口裂腹鱼群体的遗传多样性(π=0.0132,h=0.966)与Liang等[15]的研究几乎一致。在本研究的6个采样点中, PopD上游为将军坡水电站, 下游为沙坪水电站, 是唯一一个上、下游均有隔离的采样点。单倍型系统发育及遗传分化分析显示, 该采样点的齐口裂腹鱼种群与其他种群间不仅有一定的共享单倍型, 且遗传分化较小。鱼类资源调查显示, 该河段沿岸居民较少, 人为影响较小, 且水质清澈, 非常适宜齐口裂腹鱼的生存,此河段的齐口裂腹鱼种群数量亦较大。PopD上下游的水电站建设似乎对裂腹鱼资源的遗传结果影响不大。
本研究中相邻采样点间的遗传分化除瓦屋山大坝王坪(A)和瓦屋山大坝下游(B)间遗传距离较大外, 其他均较小。瓦屋山水电站始建于2003年, 是周公河上蓄水量(约5.84×108m3)及建筑施工量最大的水电站, 且已于2008年投入使用。本研究中亦检测出AB采样点间的基因流Nm为3.238, 该基因交流可能主要形成于瓦屋山水电站修建之前, 而该水电站的修建可能在一定程度上影响了水电站上下游齐口裂腹鱼资源的基因交流。
周公河中齐口裂腹鱼种群的遗传多样性较高,不同河段的遗传多样性指数差异不大。各采样点的齐口裂腹鱼种群间遗传分化水平多中等或偏低,存在较密切的遗传关系。水电站的建设对周公河中的齐口裂腹鱼群体产生了一定的影响, 但尚未形成较大隔离效应。
