保安湖菹草种群的时空分布特征及环境效应分析
2022-11-25刘孟梅乔瑞婷刘佳豪余业鑫王海军
刘孟梅 乔瑞婷 刘佳豪 余业鑫 张 苗 李 艳 王海军,5
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049;3. 大连海洋大学水产与生命学院, 大连 116023; 4. 华中农业大学水产学院, 武汉 430070; 5. 云南大学生态与环境学院高原湖泊生态与治理研究院, 昆明 650500)
沉水植物作为水生态系统的重要组成部分, 与水质的关系极为密切, 具有多种重要的生态功能:(1)吸收水体中的氮、磷、重金属等物质, 净化水质[1—7];(2)减缓水体扰动, 稳定沉积物, 降低沉积物再悬浮[8];(3)抑制浮游藻类的生长[9,10]; (4)为植食性动物提供物质和能量[11—13]; (5)为浮游动物及小型鱼类提供栖息和庇护的场所[14,15]; (6)提升水体景观等其他功能[16]。鉴于以上生态功能, 沉水植物群落重建也是目前富营养湖泊生态修复的重要措施之一。
菹草(Potamogeton crispusL.)是一种世界范围广泛分布的沉水植物, 属眼子菜科(Potamogetonaceae Bercht. & J. Presl)、眼子菜属(PotamogetonL.)[17]。与一般沉水植物不同, 菹草的生活史特殊, 秋季气温下降至15℃左右时开始萌发, 可以在水下越冬缓慢生长, 春季生长迅速, 冠层平铺水面, 一般于4—5月达到最大生物量, 并产生夏季休眠体——石芽, 春末夏初集中死亡。菹草主要依靠石芽繁殖,也可以通过地下茎产生无性分株[18,19]。由于菹草繁殖、扩增能力强, 具有一定的耐污性, 所以在很多中-富营养水体中, 菹草成为单优种群[20—22]。菹草植株在春末夏初大量集中死亡, 植物体腐烂后,向水中释放氮、磷等营养物质, 增加了蓝藻水华暴发的风险; 而且其腐烂过程中有机质的分解会消耗水中大量的氧气, 危及鱼类等水生生物的生存[23,24];此外在其腐烂过程中, 厌氧细菌的分解作用会产生一些异味气体, 如甲烷、硫化氢和氨等, 造成水体景观效果较差[25]。以上过程均会对水环境产生不利的影响。
保安湖位于湖北省大冶市, 是长江中游典型的浅水湖泊[26]。保安湖于2011年获批为国家湿地公园, 也是鳜种质资源保护区, 其健康发展对区域生态环境质量的提升具有重要意义。20世纪80年代,保安湖尚处于沉水植物主导的清水状态, 常见种类有微齿眼子菜(Potamogeton maackianus)、菹草(Potamogeton crispus)和穗状狐尾藻(Myriophyllum spicatum)等10余种, 沉水植物覆盖度达水域面积的70%以上, 水质为Ⅲ类[26—29]。21世纪以来, 受过度渔业, 以及周边生产生活产生的各类污水的影响,保安湖水质开始下降, 沉水植物群落结构向简单化发展, 菹草逐渐成为单优种群, 水质降至Ⅲ—Ⅳ类。2018—2020年, 为响应国家生态文明建设, 助推长江大保护工作, 保安湖各湖区陆续推进禁捕工作, 退出渔业生产, 实现转型升级。近年来,保安湖水质稳定于Ⅲ—Ⅳ类。
近些年来, 菹草是保安湖沉水植物的单优种群,其他沉水植物仅在湖湾浅水区零星分布, 在菹草死亡后, 夏季调查时, 在采样点也未发现其他沉水植物。为了解保安湖菹草种群长时间序列发展状况及其对保安湖水质的影响, 本研究对保安湖菹草种群及水质开展了长期监测, 并通过分析菹草分布特征与水质的关系, 阐释影响保安湖菹草种群发展的关键环境因子, 以及菹草种群关键生活史阶段的环境效应。相关研究结果可为保安湖及长江中下游类似的中小型浅水湖泊生态系统健康发展及管理工作提供一定的科学依据。
1 材料与方法
1.1 区域概况
保安湖(114°23′E, 30°15′N)位于湖北黄石的大冶市西北部, 东接三山湖, 西隔梁子湖, 南邻保安镇,北濒长江, 属于梁子湖水系。保安湖水域面积约39.3 km2, 由主体湖(26.7 km2)、桥墩湖(8.0 km2)、扁担塘(3.3 km2)和肖四海(1.3 km2)组成(图1)。平均水深为1.5—2.5 m, 最大深度为4.7 m, 常年水位17.5 m(吴凇), 其水位变动由东沟闸控制, 是典型的浅水湖泊。保安湖地处温暖湿润的亚热带季风气候区, 水热条件比较充足, 多年平均气温在16—17℃,7月温度最高, 平均温度29℃以上, 1月温度最低, 平均温度3.5℃以下。多年平均降水量为1283 mm[26,27]。本文主要以保安湖的主体湖区为研究区域, 分析菹草种群的时空分布特征及其环境效应。

图1 保安湖地理位置及采样点分布Fig. 1 Location of Bao’an Lake and distribution of sample sites
1.2 样品采集与分析
野外调查自2001年开始, 每个季节开展1次。水深用SM-5型便携式超声波测深仪(Speedtech, 美国)测量, 透明度用Secchi盘测量。水样采集分为表(水面以下0.5 m)、中(1/2水深)和底(底泥以上0.5 m)三层, 混合后装入1 L样品瓶中, 带回实验室测定。总氮(TN)使用过硫酸钾氧化-紫外分光光度法测定[30],总磷(TP)使用钼锑抗分光光度法测定[30], 浮游藻类叶绿素a(Chl.a)的测定使用GF/C滤膜(Whatman,GE Healthcare UK Limited, Buckinghamshire, 英国)过滤水样, 然后将滤膜至于90%丙酮中, 在4℃下萃取20—24h, 再用分光光度计测定其在加10%盐酸前后在665和750 nm处的吸光度[30]。沉水植物一般用镰刀型采草器进行采集, 当植株低矮时则用彼得森采泥器采集, 镰刀型采草器单次采集面积为1/5 m2, 彼得森采泥器单次采集面积1/16 m2, 每个样点采集3次(图1)。将采集到沉水植物洗净表面泥沙和附草螺类等水生生物后, 带回实验室, 用吸水纸吸去植物体表面水分, 用电子天平(美国G&G JJ6000Y)称量植株鲜重, 并计算生物量。
1.3 数据处理与分析
数据处理与分析在Excel 2019、OriginPro 2021和SPSS 26中进行。分析保安湖水质状况和菹草种群动态特征时, 选择保安湖菹草种群发展的4个典型阶段, 即2002年(多种沉水植物共存)、2012年(菹草是沉水植物的单优种群)、2019年(菹草种群大面积扩增)和2021年(菹草种群消失)。分析菹草种群的环境效应时, 根据春季调查时是否有沉水植物(菹草), 将主体湖划分为有草区和无草区, 为排除其他沉水植物的影响, 仅分析2012年之后, 菹草已经成为沉水植物单优种群时的数据。即有草区的植物均为菹草, 夏季时无其他沉水植物。菹草春季生物量的空间分布图在ArcGIS 10.6中使用反距离权重插值法(IDW)制作。菹草生物量与环境因子的数据不是正态分布, 在分析二者间关系时使用Spearman秩相关分析; 总磷和浮游藻类叶绿素a之间的关系使用一元线性回归分析; 有草区和无草区之间的环境因子差异采用独立样本T检验。
2 结果
2.1 保安湖水质状况
本研究结果显示, 21世纪以来, 保安湖水质整体呈现先上升后平稳的趋势。从TN含量来看,2002年较低, 均值为0.19 mg/L; 2012年较高, 均值为2.49 mg/L; 2019和2021年则相对平稳, 均值分别为0.83和0.89 mg/L。从TP含量来看, 2002年较低, 均值为0.03 mg/L; 2002—2019年TP含量逐渐上升, 2012年均值为0.05 mg/L, 2019年较高, 均值为0.09 mg/L;2021年, TP含量略有下降, 均值为0.07 mg/L(图2)。
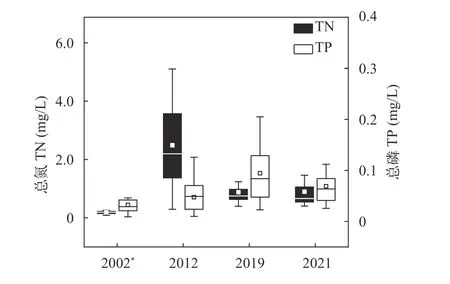
图2 保安湖主体湖区水中氮磷含量变化Fig. 2 Annual mean values of total nitrogen (TN) and total phosphorus contents (TP) in Zhuti Lake during 2001—2021“*” 2002年仅为夏季的数据
2.2 菹草种群动态特征
时间变化菹草生活史特殊, 于秋季萌发,可越冬生存, 春季快速生长, 并于4—5月份达到最大生物量, 春末夏初集中死亡, 本文主要介绍春季时菹草生物量变化特征。从整个湖区春季菹草的平均生物量来看, 21世纪以来, 菹草种群呈现不断扩增趋势, 但也存在菹草种群突然消失的情况。由图 3可以看出, 2002—2019年, 菹草生物量不断上升, 其中2002年均值为356 g/m2, 2012年上升至974 g/m2, 2019年继续上升至1901 g/m2; 2021年春季未发现菹草。
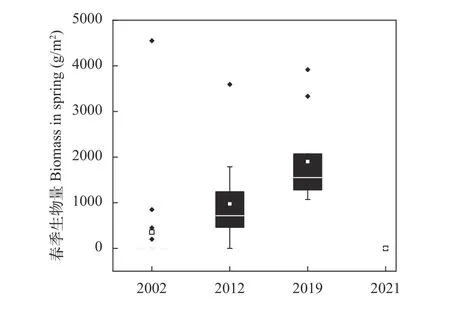
图3 保安湖主体湖区菹草春季平均生物量变化Fig. 3 The average biomass change of Potamogeton crispus in spring in Zhuti Lake
空间变化总体来看, 近20年来, 菹草种群主要分布在主体湖中心区域。2002年, 主体湖的沉水植物除菹草外, 还包括微齿眼子菜(Potamogetonmaackianus)、苦草(Vallisneria natans)和狐尾藻(Myriophyllum verticillatum)等, 其中菹草主要分布在主体湖区西南部, 单个采样点的最大生物量为1517 g/m2。2012年, 菹草是保安湖沉水植物的单优种群,主要分布在主体湖区东部, 单个采样点的最大生物量为3593 g/m2。其他沉水植物仅在湖湾浅水区零星分布, 未在采样点出现。2019年, 主体湖菹草大量生长, 中部最多, 单个采样点的最大生物量为3916 g/m2。2020年秋季至2021年春季未发现菹草(图4)。
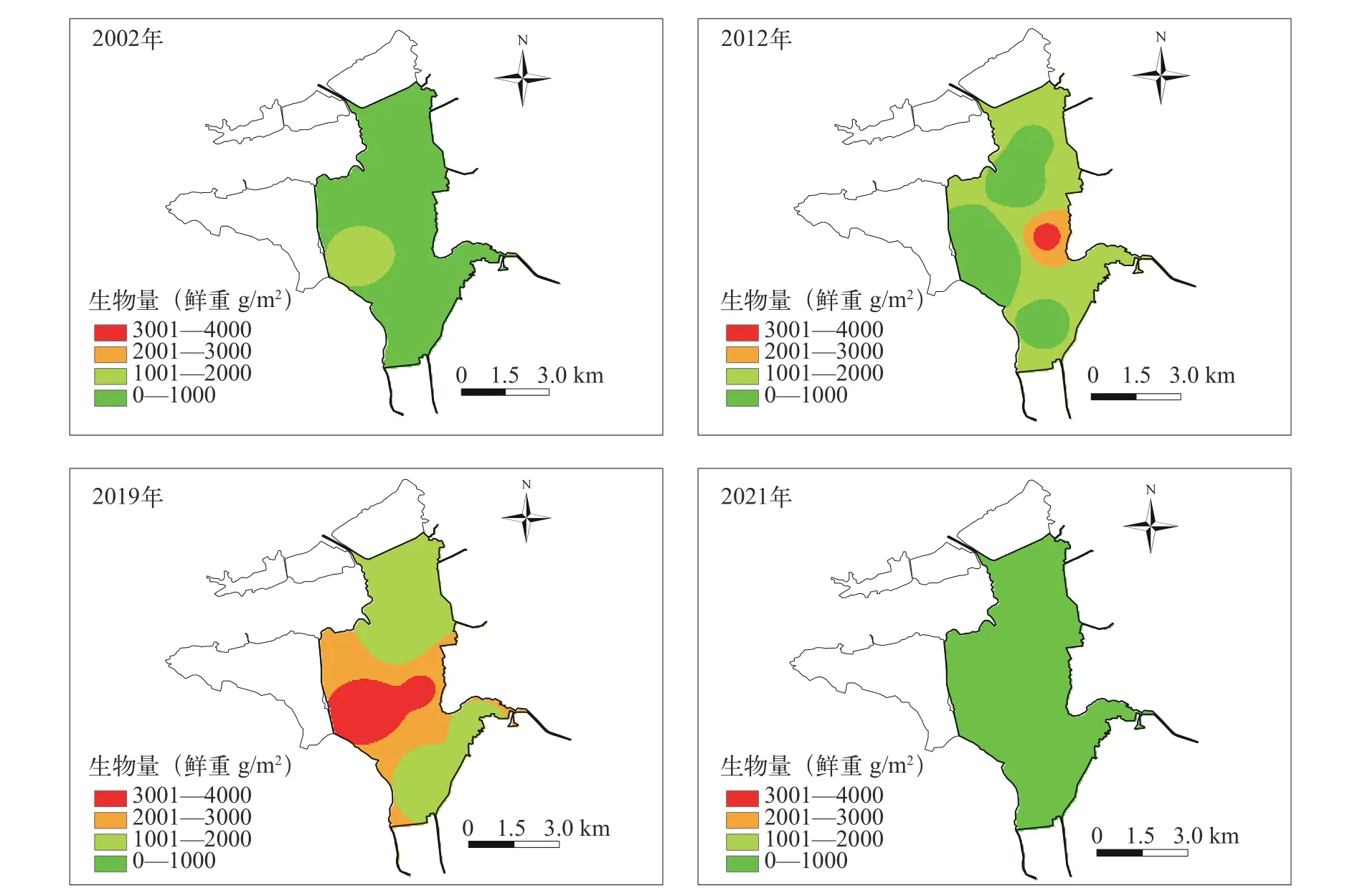
图4 主体湖菹草春季生物量分布Fig. 4 Biomass distribution of Potamogeton crispus in spring in Zhuti Lake
2.3 菹草生物量与环境因子关系
春季菹草生物量与春季水环境因子间Spearman相关分析显示, BP.c与ZM呈显著正相关(r=0.52,P<0.01), 与Chl.a呈显著负相关(r=–0.42,P<0.01),与ZSD、ZSD/ZM、TN、TP无相关关系(表1)。回归分析结果显示, BP.c随ZM(ZM≤3 m)的增加显著上升(R2=0.13,P<0.05), 水中Chl.a的含量随BP.c的增加显著降低(R2=0.17,P<0.01; 图 5)。

表1 主体湖春季菹草生物量与春季水质参数的斯皮尔曼相关系数(下三角), 春季菹草生物量与夏季水质参数的斯皮尔曼相关系数(上三角)Tab. 1 Spearman rank correlation coefficients (lower triangle) between biomass of Potamogeton crispus and water quality parameters in spring; Spearman rank correlation coefficients (upper triangle) between spring biomass of Potamogeton crispus and water quality parameters of summer
春季菹草生物量与夏季水环境因子间Spearman相关分析显示, BP.c与ZM呈显著正相关(r=0.37,P<0.05), 与ZSD/ZM呈显著负相关(r=0.47,P<0.01),与ZSD、TN、TP、Chl.a无相关关系(表1)。回归分析结果显示, 菹草春季生物量(即菹草死亡量)与夏季水体的ZM、ZSD、ZSD/ZM、TN、TP、Chl.a之间的线性关系不显著(图5)。
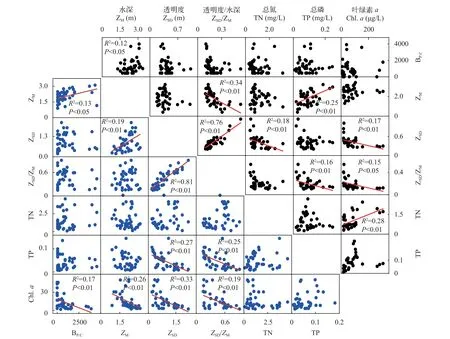
图5 主体湖春季菹草生物量与春季水质参数关系(下三角); 春季菹草生物量与夏季水质参数关系(上三角)Fig. 5 Relationship between the biomass of Potamogeton crispus and water quality parameters in spring (lower triangle) in Zhuti Lake;Relationship between the spring biomass of Potamogeton crispus and water quality parameters of summer (upper triangle) in Zhuti Lake
春季时, 保安湖有草区和无草区的ZM、ZSD、ZSD/ZM及Chl.a存在显著差异(P<0.05; 图 6), 有草区的ZM(中位数为2.1 m)、ZSD(中位数为0.93 m)和ZSD/ZM(中位数为0.48)显著高于无草区(1.8、0.45和0.28 m); 有草区的Chl.a(中位数为8.13 μg/L)显著低于无草区(14.10 μg/L); 二者间的TN和TP没有显著差异(图6)。有草区Chl.a和TP的关系不明显, 无草区Chl.a的含量随TP上升而增加, 在相同TP条件下, 无草区Chl.a多数高于有草区。
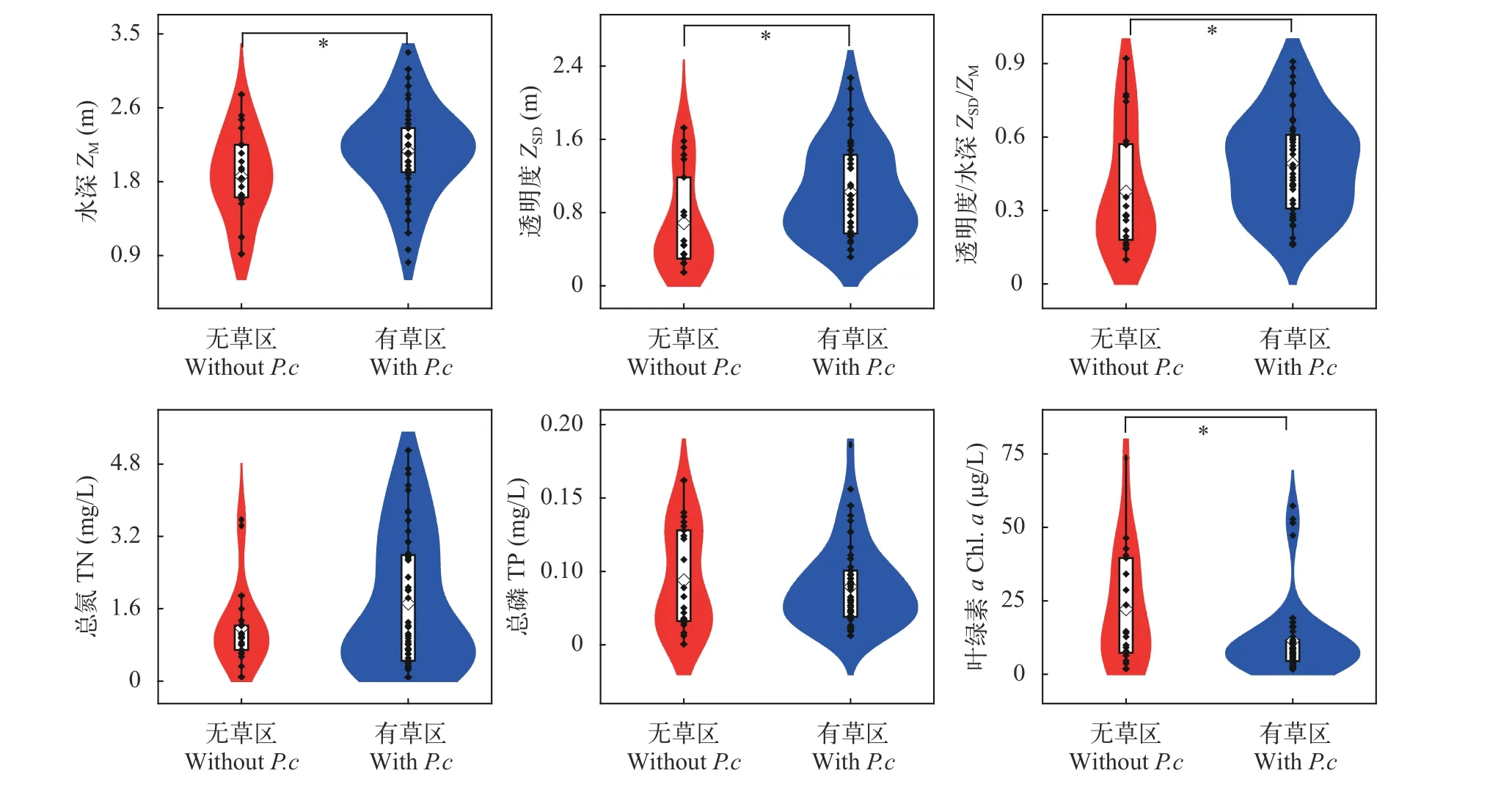
图6 春季有草区和无草区的水深、透明度、透明度/水深、总氮、总磷和浮游藻类叶绿素aFig. 6 Comparison of ZM, ZSD, ZSD/ZM, TN, TP and Chl. a in spring between areas with and without Potamogeton crispus in spring(*P<0.05)
夏季时, 保安湖有草区和无草区的ZM、TN存在显著差异(P<0.05; 图 7), 有草区的ZM(中位数为2.5 m)显著高于无草区(2.1 m); 无草区TN(中位数为1.30 mg/L)显著高于有草区(0.72 mg/L); 二者间的ZSD、ZSD/ZM、TP、Chl.a没有显著差异(图7)。有草区和无草区的Chl.a均随TP的上升而增加, 在相同TP条件下, 无草区Chl.a和有草区差异不显著(图8)。
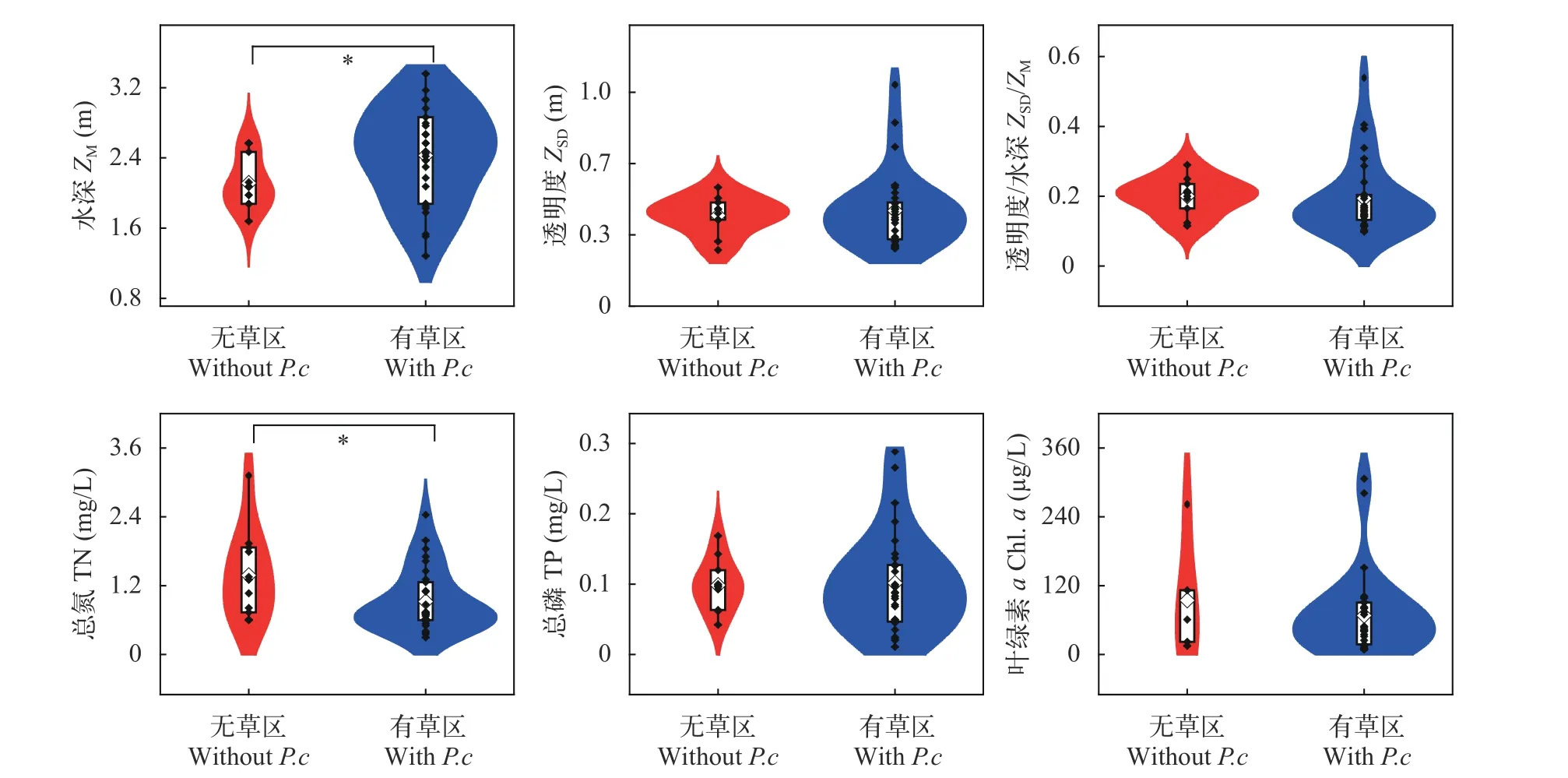
图7 夏季有草区和无草区的水深、透明度、透明度/水深、总氮、总磷和浮游藻类叶绿素aFig. 7 Comparison of ZM, ZSD, ZSD/ZM, TN, TP and Chl. a in summer between areas with and without Potamogeton crispus in spring(*P<0.05)

图8 春季(a)和夏季(b)有草区和无草区水中浮游藻类叶绿素a含量与总磷含量的关系Fig. 8 Relationship of phytoplankton chlorophyll a and total phosphorus in spring between areas with and without Potamogeton crispus in spring (a) and summer (b)
3 讨论
3.1 保安湖菹草种群动态特征及影响因子分析
近20年来, 保安湖菹草种群在生物量和分布范围方面均明显增加。从时间上来看, 菹草生物量呈逐年上升趋势, 2019年上升为2002年的5倍; 从空间分布上来看, 菹草种群的分布范围逐渐由中部扩展至全湖区, 成为主体湖沉水植物的单优种群。菹草石芽的个体较大, 发芽率高, 通过匍匐茎拓展种群的能力强[31,32]; 再加上秋冬季气温下降, 鱼类摄食能力减弱[33], 对菹草的破坏性下降; 2002—2012年,主体湖水中氮磷含量急剧升高, 2012年之后, 水质稳定为Ⅲ—Ⅳ类, 菹草对氮磷等营养的耐受性相对较高[34], 水中营养的增加可能也是菹草生物量及分布范围增加的一个因素。
从局域空间范围来看, ZM可能是导致菹草生物量分布不均的一个重要因素。春季时, 菹草快速生长, 植株接近或已到达水面, 其对水下光照的依赖性降低, 此时菹草生物量和ZM(ZM≤3 m)呈显著正相关, 可能是因为ZM在一定程度上的增加, 可以给予菹草更大的生长空间, 有利于菹草株高增加, 生物量也就随之增加。2021年主体湖未发现菹草, 这可能是受2020年夏季强降雨事件的影响。2020年秋冬季(菹草生长初期), 主体湖水位一直维持在较高水平(最大ZM为3.7 m, 平均ZM约2.7 m, 平均ZSD约0.45 m; 附图 1)。ZM的上升及ZSD的下降, 使得水下光照不足, 2020年秋冬季主体湖底部光照低至0。虽然菹草石芽萌发率与光照关系不大[35—37], 但是幼苗生长却需要1%以上的自然光照[38]。因此主体湖菹草石芽虽然萌发, 但无法绿化长成幼苗。2020年11月至2021年1月, 主体湖水面漂浮大量菹草萌发后未绿化的芽体。类似的情况还发生在湖北省荆州市的洪湖, 近年来, 洪湖中的沉水植物主要是菹草, 分布面积约为132.34 km2, 占全湖面积的38.03%[39]。2020年秋冬季, 水位较往年升高0.5—1.0 m,菹草石芽未能成功萌发, 2021年春季野外调查时洪湖未发现菹草。此外, 主体湖水位上升后, 导致周边大量精养鱼池被淹没, 与主体湖连成一片, 淹没期间, 大量鱼类进入湖内。草鱼等草食性鱼类可通过摄食作用破坏菹草幼苗[40], 鲤、鲫等底层生活鱼类的摄食等生命活动可扰动底质, 不利于沉水植物的定植[41]。因此, 鱼类的强烈干扰可能也是2021年主体湖菹草未能生长的主要原因之一。
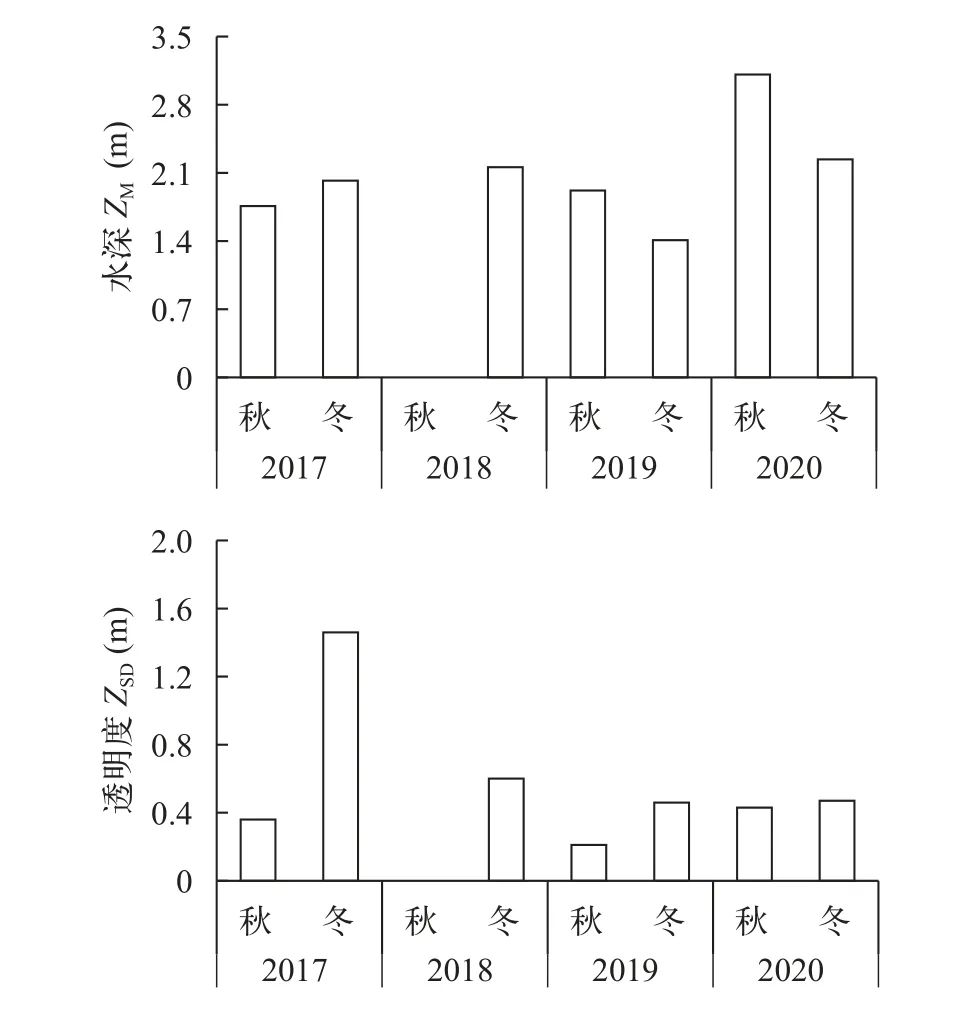
附图1 主体湖区2017—2020年秋冬季的水深和透明度Supplement figure1 Water depth and Secchi depth in Zhuti Lake in autumn and winter from 2017 to 2020
3.2 保安湖菹草种群的环境效应
本研究表明, 菹草种群在快速生长期, 即春季时可以净化水质, 死亡后一段时间内可导致水质恶化, 但其不利影响维持的时间有限。菹草在春季时处于快速生长期, 一般而言, 在5月前后生物量达到峰值。在本研究中, 主体湖多年菹草春季生物量均值为834 g/m2, 有草区和无草区之间的TN和TP没有明显差异, 但是有草区的ZSD和ZSD/ZM明显高于无草区, Chl.a明显低于无草区。已有研究表明, 菹草和其他沉水植物一样, 可以通过根系生长来稳定底质、减少沉积物再悬浮[42], 菹草在春季占据光照和营养条件, 还可以产生化感物质, 在一定程度上抑制了浮游藻类的生长, 从而提升水质[43]。王锦旗等[44]对比玄武湖有草区和无草区水质发现, 有草区TN低于无草区, 有草区和无草区间TP没有显著差异。康丽娟等[45]以洪湖等江淮中下游平原的14个浅水湖泊为研究对象, 发现春季时有草区和无草区之间的TN、TP、Chl.a含量并无显著差异, 而ZSD有极显著差异。华祖林等[46]对菹草不同生长时期的骆马湖水质进行监测, 发现在菹草指数生长期, 菹草密集区的TN、TP含量低于稀疏区。
一般而言, 菹草在春末夏初集中死亡, 植株分解时可向水中释放大量的氮、磷等营养物质, 并消耗水中氧气, 使水质恶化, 散发臭味, 透明度下降,增加蓝藻水华爆发的风险, 危及鱼类等水生生物的生存[23,24]。在本研究中, 主体湖菹草一般在5月底、6月初死亡, 断裂植株随风浪漂移堆积至下风口的湖面, 水体呈黄褐色、有明显臭味。在本研究中, 夏季(7月)的调查结果显示, 有草区和无草区的ZSD、ZSD/ZM、TP和Chl.a之间没有显著差异, 无草区TN显著高于有草区。以上结果表明, 在主体湖中, 菹草死亡造成的水质恶化约持续1个月。这可能由于在浅水湖泊中, 菹草死亡后, 在风力扰动作用下, 湖水流动混合, 水中溶氧增加, 菹草死亡产生的有机质或其分解后产生的无机物已沉降至水底(如磷)或进入大气(如碳), 有草区中菹草死亡带来的环境效应已经减弱, 所以有草区和无草区间的总体水质差别不大。
曹秀云等[47]研究发现菹草的衰亡分解, 导致水中溶解性有机磷含量急剧升高, 为藻类生长提供了适宜的环境, 藻类密度增加。王立志等[48]监测菹草地上部分腐烂分解过程, 发现在菹草分解的前10天,水中的总磷、溶解态总磷和颗粒态磷的含量急剧升高, 第15天左右达到高峰, 之后逐渐下降。杨文斌等[23]发现菹草衰亡分解后确实使水体的总氮和总磷含量增加, 但该效应一般在菹草死亡后45d左右消失。东平湖菹草在5月份的覆盖度达80%以上,张金路等[49]发现菹草死亡前, 水中TP含量较低, 为0.11 mg/L, 死亡后达到最高值0.41 mg/L, 1个月后降为0.22 mg/L。沂蒙湖也有类似现象, 水中TP含量在5、6月较高, 在0.25 mg/L以上, 7月份恢复至菹草死亡前水平, 约0.15 mg/L左右[48]。在菹草为沉水植物单优种群的湖泊中, 菹草大面积死亡带来的负面效应一般会持续1个月左右, 这可能和菹草本身腐烂分解规律有关。菹草在腐烂分解初期(0—2d)生物质衰减较快, 主要是菹草体内水溶性物质发生淋溶作用; 分解第二阶段(2—14d), 微生物分解有机质; 后期(14—40d)难分解物质如纤维素不断积累, 菹草残留物分解受到抑制[50]。考虑到湖泊水环境的容纳量有限, 在菹草集中死亡前, 对其进行适度收割, 可能是降低菹草衰亡对水质影响的有效手段之一。
4 结论
本研究结果表明, 近20年来, 保安湖主体湖区菹草种群的生物量不断增加, 空间分布范围逐步扩增。在长时间尺度上(20世纪80年代至今), 氮、磷等营养可能是影响菹草种群发展的主要因素, 其含量在一定范围内增加后促使菹草演替为沉水植物群落的优势类群。在局域范围内, 水深可能是调节菹草生物量的主要因素, 水深在一定范围内(ZM≤3 m)增加后有利于菹草生物量的增加。本研究结果还表明, 菹草在快速生长期对水质改善有一定的效果,可以提升水体透明度, 降低浮游藻类的含量, 但对水中氮、磷等营养物含量影响不大; 菹草衰亡后,对水质造成不利影响, 但其持续时间有限, 在保安湖主体湖区约为一个月。以上研究通过分析保安湖菹草种群的变化及其与环境因子的关系, 完善了对菹草种群不同生活史阶段环境效应的理解, 对保安湖及长江中下游类似的菹草占优的浅水湖泊的生态管理工作提供了一定的理论依据。
