多西他赛用于实体瘤患者的群体药代动力学研究
2022-11-25董育珠赵成龙李文军刘松青
奚 鑫,董育珠,赵成龙,杨 佳,李文军,杜 倩,刘松青
401120 重庆,重庆医科大学附属第三医院药剂科1;450000 郑州,河南省人民医院药学部2
恶性肿瘤已成为威胁人类健康的公共卫生问题之一,根据国家癌症中心最新数据统计,每年恶性肿瘤发病人数约为392.8万人,我国恶性肿瘤的发病率和病死率位居全球中等偏上水平,肿瘤治疗负担也呈持续上升的趋势[1]。目前,手术治疗是大多数早期癌症患者的首选治疗方案,而化疗仍是终末期癌症患者的主要治疗手段之一[2-3]。
多西他赛(docetaxel,DTX)是一种半合成的第2代紫杉烷类抗肿瘤药物,通过干扰细胞有丝分裂和分裂间期细胞功能所必需的微管或微管蛋白系统发挥抗肿瘤作用。目前,多西他赛单药或与蒽环类、铂类等药物联合应用,广泛用于治疗乳腺癌、非小细胞肺癌、胃癌、头颈癌、卵巢癌、食管癌、子宫癌和前列腺癌[4-7]。
临床常通过体表面积(body surface area,BSA)计算DTX给药剂量,药品说明书推荐剂量通常为每三周给药一次,每次75 mg/m2,但对于一些晚期或转移乳腺癌患者剂量可增加至100 mg/m2,使用DTX期间发生严重不良反应的患者剂量可减少至60 mg/m2。药代动力学(pharmacokinetics,PK)研究显示DTX在体内代谢过程复杂,DTX即使按照BSA计算给药,其在不同个体之间的清除率(clearance,CL)、药时曲线下面积(area under the curve,AUC)、毒性反应等仍然存在较大个体间差异。BRUNO等[8]证明DTX的CL是导致个体间差异的最重要的参数。BAKER等[9]对92名成年白种人肿瘤患者进行DTX的PK数据分析发现,DTX的CL差异可达7.6倍。同时,在美国和欧洲人群中开展的群体药动学研究发现,CL与α1-酸性糖蛋白(α1-acid glycoprotein,AAG)、年龄、BSA和肝功能有相关性[10]。另外,一项DTX的Ⅱ期临床试验表明,DTX的PK参数与疗效和不良反应具有明显相关性,第一疗程中DTX的AUC是肿瘤进展的重要预测指标,而DTX的CL减少50%,中性粒细胞减少伴发热的几率增加3倍[11]。在美国、欧洲和日本人群中进行的前瞻性群体药代动力学(population pharmacokinetics, PPK)研究也表明,不同人种对DTX血液毒性的易感性不同,DTX第一疗程的AUC是严重血液毒性不良反应的预测因素[10,12]。
DTX的PK变异与较多因素有关,包括人种、病理生理特征等,PK的变异也会产生疗效与安全性差异。然而,目前DTX的PPK特征在中国人群中的研究较少且多以单中心、小样本为主,鲜有多中心、较大样本量的PPK研究[13-15]。因此,本研究纳入2个不同中心的DTX血药浓度监测数据,建立一个多中心的PPK模型,进一步阐明DTX在中国人群中的PK特征和变异来源,为患者临床用药提供科学依据。
1 资料与方法
1.1研究对象
本研究纳入2018年1月1日至2020年12月31日,在重庆医科大学附属第三医院乳甲外科、肿瘤科、胸外科和河南省人民医院乳甲外科、肿瘤科、妇产科接受DTX化疗,并监测DTX血药浓度的374名实体瘤患者。本研究获重庆医科大学附属第三医院医学伦理委员会(2019年科伦审第5号)与河南省人民医院医学伦理委员会的批准(2020伦审第11号)。纳入标准:①年龄≥18岁;②具有细胞学或组织学证实的适合多西他赛化疗的实体瘤患者,化疗周期不限;③预计生存期≥6个月。排除标准:①对多西他赛及其赋形剂过敏者;②中性粒细胞绝对计数<1.5×109/L的患者;③严重肝功能损伤患者;④妊娠、哺乳期妇女;⑤患有精神性疾病或存在智力障碍,无法正常交流的患者。
1.2 研究方法
本研究为前瞻性、多中心研究,多西他赛的给药方案为75 mg/m2,每3周1次,持续输注1~2 h。借鉴文献报道的采样策略,河南中心在滴注结束前10 min至滴注结束时和滴注结束后30~60 min内两个时间点采血[8,10-11];重庆中心在输注结束时、滴注开始后6~9 h、滴注开始后12 h 三个时间点采血。采用EDTA抗凝采血管收集样本,样本收集完成后以3 000 r/min离心10 min,移液枪吸取上清血转移至EP管,将样本置于-80 ℃冰柜中保存、待测。
1.3 多西他赛血药浓度测定
重庆医科大学附属第三医院收集到的血样标本采用课题组前期优化并验证的液相色谱-质谱联用法(LC-MS/MS)方法测定DTX的血药浓度,标准曲线范围为1~500 ng/mL,线性相关系数>0.99。定量下限为1 ng/mL,准确度和精密度符合生物分析方法验证的限度要求。低、中、高3个浓度质控样品的日内和日间准确度范围为-4.6%~4.2%,日内和日间精密度均<7.0%。样品回收率为86.9%~99.8%,低、高浓度质控样品的基质效应的相对标准误差分别为4.5%和5.3%。血浆样本在-80 ℃储存3个月,其稳定性均符合生物样本定量分析验证指导原则的标准[16]。河南省人民医院收集到的血样标本使用Mycare的多西他赛检测试剂盒测定DTX的血药浓度[17]。
1.4 数据分析
采用搭建在Mas-studio操作平台的非线性混合效应模型软件(nonlinear mixed-effects model, NONMEM)进行群体药动学模型建立与验证。采用个体间和残差变异交互作用的一阶条件估算法(first-order condition estimation with inter and intra-subject variability interactions,FOCE-I)进行参数估算。
1.5 PPK模型的建立
通过对DTX的血药浓度数据分析,初步判定DTX的药动学特征。根据文献报道[18-20],选择一级消除的二室和三室模型分别进行拟合,通过目标函数值(objective function value, OFV)比较,选择拟合程度更佳的模型作为基础模型。在基础模型上,采用逐步法建立协变量模型,在第1轮向前纳入过程中,假设检验水平为α=0.05(df=1),加入一个协变量后,使OFV值降低数超过3.84则保留。在第2、3轮向前纳入过程中,假设检验水平为α=0.01(df=1),加入一个协变量后,使OFV值降低数超过6.64,认为该协变量对该PK参数具有显著影响,对模型具有改善作用,保留下来,再建立全量模型。在全量模型的基础上进行逆向剔除,检验水平定为α=0.001,当剔除一个协变量后,若OFV值增加数超过10.83,则认为该协变量对模型具有显著影响,在模型中予以保留,从而建立最终模型。采用自举法(bootstrap)和可视化预测检验(visual predictive check, VPC)进行内部验证,评价PPK最终模型的稳定性与预测性。
2 结果
2.1 患者人口学特征
共纳入374名患者,其中河南中心334名,重庆中心40名,收集到772份多西他赛血浆样本。纳入的患者人口学资料,见表1。

表1 患者人口学资料 [例(%),M(P25,P75)]
2.2 多西他赛在实体肿瘤患者血浆的PK特征
DTX的血药浓度与时间散点图如图1所示。河南中心收集到DTX血药浓度在实体肿瘤患者中变异较大,滴注结束前10 min至滴注结束时(给药后0.7~1.08 h)血药浓度范围为656.4~2 491 ng/mL,滴注结束后30~60 min内(给药后1.1~3.43 h)血药浓度范围为32.45~2 378.2 ng/mL(图1A)。重庆中心收集的样本在滴注结束时(0.75~5.83 h)患者血药浓度范围为3.53~798 ng/mL,其中患者血药浓度在滴注开始后12 h内迅速降低(图1B)。在滴注开始后1~2 h以内,两个中心的肿瘤患者DTX血药浓度范围基本保持一致,其中位数为175.5 ng/mL,浓度范围是3.53~2 491 ng/mL(图1C)。

A:河南中心多西他赛浓度-时间散点图;B:重庆中心多西他赛浓度-时间散点图;C:两个中心多西他赛浓度-时间散点图
2.3 模型建立
2.3.1 基础模型 一级消除的二室模型和三室模型均能拟合374名患者的血药浓度-时间数据。三室模型较二室模型具有更低的OFV值(8 646.267vs8 995.381)和赤池信息判断(Akaike’s information criterion, AIC)值(8 664.267vs9 007.381),且三室模型的拟合结果优于二室模型(图2)。因此,本研究最终选用一级消除的三室模型作为DTX在中国实体肿瘤患者群体的基础模型,DTX的三室结构模型图,见图3所示。模型的具体筛选结果如表2所示。

表2 多西他赛基础模型结果 {估计值[RSE(%)]}

A:二室模型的拟合优度图;B:三室模型的拟合优度图
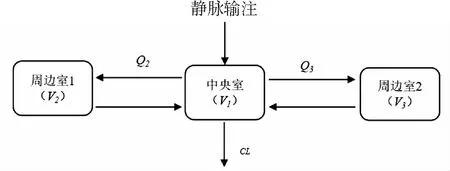
V1:中央室表观分布容积;V2:周边室1表观分布容积;V3:周边室2表观分布容积;CL:血浆清除率;Q2:中央室与周边室1的房室间清除率;Q3:中央室与周边室2的房室间清除率
2.3.2 最终模型
2.3.2.1 协变量初筛 本研究通过绘制协变量诊断图对协变量进行初筛,结果如图4~7所示。研究发现与参数CL有显著相关性的协变量有AGE、ALB、CREA(图4),与参数V2有显著相关性的协变量有AGE、ALB、CREA(图5),与参数Q3有显著相关性的协变量有ALB、CREA(图6)。此外,协变量相关性的筛选图发现,AGE和ALB有相关性,AGE和CREA有相关性,ALB和CREA有相关性(图7)。

AGE:年龄;BW:体质量;BMI:体质指数;ALB:白蛋白;CREA:血肌酐;CL:清除率

AGE:年龄;BW:体质量;BMI:体质指数;ALB:白蛋白;CREA:血肌酐;V2:周边室1分布容积

BW:体质量;BMI:体质指数;ALB:白蛋白;CREA:血肌酐;AGE:年龄;Q3:中央室与周边室2的房室间清除率

BW:体质量;BMI:体质指数;ALB:白蛋白;CREA:血肌酐;AGE:年龄
2.3.2.2 逐步法建立协变量模型和最终模型 在基础模型的基础上,采用逐步法逐一评估各协变量对CL、V2和Q3三个参数的影响。研究发现经过3轮正向筛选过程,将ALB加在CL和CREA加在Q3上时,基础模型的OFV下降最多。而在逆向剔除过程中,分别将ALB对CL的影响和CREA对Q3的影响在模型中予以剔除,模型的OFV分别上升43.377和13.498(P<0.001)。表3详细记录了正向筛查和逆向剔除的过程。

表3 协变量向前纳入和逆向剔除的筛选过程
2.4 基于预测和残差的模型诊断
通过对比多西他赛基础模型和最终模型的拟合优度图(图8)。基础模型和最终模型中DTX血药浓度的个体预测值(individual prediction concentration, IPRED)的趋势线与参考线重合度均较高,表明二者IPRED与DV的拟合较优。最终模型DTX血药浓度群体预测值(population prediction concentration, PRED)的拟合优度较基础模型有所提高。大部分条件加权残差(conditions of weighted residuals, CWRES)在整个PRED范围内,对称分布于-2~+2范围内,且CWRES趋势线随PRED的增加呈水平分布(图9)。个体条件加权残差-个体预测浓度(CIWRES-IPRED)散点图提示,在整个个体预测值范围内,趋势线呈水平分布。CWRES直方图基本服从以0为中心的单峰正态分布,尽管CWRES随时间大部分对称分布于-2~+2范围内,但是10 h后的残差呈明显的趋势性变化。

A:基础模型观测值-个体预测值散点图;B:最终模型观测值-个体预测值散点图;C:基础模型观测值-群体预测值散点图;D:最终模型观测值-群体预测值散点图 虚线:示参考线(y=x) 红色实线:示参数的趋势线 红色点:示多西他赛药物浓度的离群值

A:条件加权残差-群体预测浓度散点图;B:条件加权残差-时间散点图;C:个体条件加权残差-个体预测浓度散点图;D:条件加权残差概率密度图 虚线:示参考线(y=0) 红色实线:示参数的趋势线 红色点:示多西他赛药物浓度的离群值
2.5 模型验证
最终模型中各PK参数估算值以及个体间变异和残差变异的结果如表4所示。利用1 000次bootstrap对最终模型进行验证,共成功运行713次,模型稳健率为71.3%,最终模型的主要PK参数CL、V2、Q2和Q3估算值,个体间变异以及残差变异估算值均落在bootstrap参数结果的95%置信区间内。VPC结果显示(图10),在给药24 h以内,高体质量组的观测组数据中位数、第5和第95百分位均在模拟数据的相应预测区间内(图10C)。在低体质量组多西他赛观测数据中,中位数和第5百分位数附近观测数据较好落在相应的预测区间内,而在第95百分数附近分布差异较大(图10A)。同样,在中体质量组多西他赛观测数据中,观测数据仅在第5百分数附近略偏离模拟数据的预测区间(图10B)。

表4 多西他赛最终模型的参数估计和自举法结果

A:低体质量组(<55 kg);B:中体质量组(55~65 kg);C:高体质量组(>65 kg) 纵坐标:观测值取对数值
3 讨论
既往文献曾报道DTX的PPK模型,包括一级消除的二室模型[19-20]、一级消除的三室模型[8,11,18,21]以及四房室模型[22],本研究应用NONMEM软件,建立了一个稳定、可靠的三房室DTX群体药动学模型,进一步阐明了DTX在中国实体肿瘤患者群体中的PK参数和变异程度。本研究最终模型估算PK参数变异的RSE均小于30%,表明模型估算的PK参数值可靠,Bootstrap验证结果和VPC结果表明本研究纳入的浓度-时间数据建立的PPK模型稳定可靠,模型预测性能好。本研究建立的模型估算出DTX的CL、V1、V2和V3分别为57.2 L/h、6.16 L、11.8 L和660 L,与文献报道的多西他赛CL、V1、V2、V3的群体典型值28.3~60 L/h、5.77~80.7 L、8.68~101 L、243~2 140 L保持一致[8,11,18-22]。
一项利用PPK模型估算DTX清除率的最优采样策略的研究表明,在滴注结束前和输注结束后6 h两个时间点采集多西他赛血浆样本对CL的估算精密度最高[20]。本研究采样时间点包含上述优化采样策略中的两个采样点,同时为了准确估算DTX向周边室的转运过程,研究也纳入了滴注结束后30~60 min的血浆样本,使研究结果能好的体现DTX的体内分布情况。
本研究在协变量初筛过程中发现ALB和年龄是影响CL的显著因素,年龄和CREA是影响V2的显著因素,但均在逆向剔除过程中被剔除。本研究发现CREA是影响Q3的显著协变量。由于ALB和年龄存在相关性,因此在协变量筛选过程中,未同时考察两者对CL的影响,这可能导致最终模型只发现ALB是影响CL的显著协变量。目前文献报道年龄、BSA、AAG、肝功能(包括碱性磷酸酶、丙氨酸氨基转移酶、天冬氨酸氨基转移酶、胆红素、总蛋白、ALB)是影响DTX的CL显著变化的协变量[8,11]。日本两项DTX的PPK研究探讨了不同程度受损的肝功能与多西他赛PK参数之间的关系,发现与肝功能正常的患者相比,轻度和中度肝损伤患者的CL分别减少了22%和38%~49%,该研究进一步表明肝功能对CL的变化有显著的影响[18,22],这与本研究结果不尽一致,后续还需其他大样本、多中心研究进一步证实。
本研究存在一定局限性:第一,本研究中两个中心的DTX血药浓度测定方法不一致,可能会对结果造成一定偏倚,但已有研究表明LC-MS/MS法和基于Mycare的多西他赛检测试剂盒的纳米增强免疫比浊法测定的多西他赛血药浓度具有较好相关性和一致性[24]。第二,本研究纳入的妇科肿瘤患者居多,致使纳入人群存在性别偏倚,但研究结果未发现性别对DTX的清除率有影响,这与BAKER等的研究结果一致[9];第三,既往有研究报道肝药酶CYP3A5和药物外排转运蛋白(ABCB1)基因多态性对多西他赛PK变化存在一定影响[25-26],但本研究未纳入基因多态性相关协变量,未评估基因差异对DTX的PK参数变化的影响。
综上所述,本研究在中国实体肿瘤患者群体中利用多中心数据建立三房室PPK模型,其结果外推性优于单中心数据,在今后的研究中可利用外部验证进一步验证模型的适用性,为临床合理使用多西他赛提供理论依据。
