BMAL1基因单核苷酸多态性与双相情感障碍的关联性研究
2022-11-25闵文蛟孙学礼邹志礼陈樾馨
闵文蛟,孙学礼,邹志礼,张 旭,陈樾馨,周 波
610072成都,四川省医学科学院·四川省人民医院心身医学中心,四川省精神医学中心1;610041 成都,四川大学华西医院心理卫生中心2
双相情感障碍(bipolar disorder, BD)是一类常见的重性精神疾病,在临床上主要表现为情感高涨和低落交替出现或混合发作。流行病学显示,该疾病位列中国人群精神障碍患病率第二[1]。患者疾病负担严重,具有高复发率、高致残率和高自杀率的特点,且罹患其它躯体慢性疾病的风险较高[2]。BD被认为是一种复杂性疾病,发病涉及遗传、神经生化、环境等多方面因素,而明确其病理生理机制有助于该病的早期诊断和干预[3]。
有研究发现,BD与生物节律改变密切相关,是一种情绪节律障碍[4]。患者除了情绪节律的两极化波动外,常存在机体多种节律活动的紊乱,如下丘脑-垂体-肾上腺(hypothalamus-pituitary-adrenal,HPA)和下丘脑-垂体-甲状腺(hypothalamic-pituitary-thyroid,HPT)轴激素分泌节律异常,睡眠-觉醒节律周期延迟,体温节律振幅降低等[5-7]。目前认为生物节律基因通过“转录-翻译-反馈”机制构成的环路调节机体各项节律活动,其不同变异或功能改变可能影响疾病的发生[8]。动物实验显示,CLOCK基因突变的小鼠可表现兴奋、狂躁行为,给予锂盐治疗后上述行为则减轻[9]。一项新近研究发现,节律基因PER2的rs 2304672多态性G携带者罹患BD的风险增加[10]。常用的心境稳定剂丙戌酸盐可缩短BD患者成纤维细胞中CLOCK基因的表达节律[11]。关于节律基因和BD易感性及临床特征的关联性研究相对较少,且结论尚不一致,缺乏重复验证。
BMAL1基因是机体生物节律振荡器的核心元件之一,既往研究发现该基因的 rs11022778多态性与BD患者食欲减退相关[12];BD常用的治疗药物如锂盐、喹硫平等可以改变特定脑区BMAL1基因的表达水平[13-14],这提示BMAL1基因功能的改变可能参与BD疾病的发生及转归。因此,本研究拟以健康人群作为对照,在中国汉族人群中探讨BMAL1节律基因单核苷酸多态性分布与BD发生的关联性,同时比较不同基因型BD患者在神经内分泌轴变化的差异性,以初步揭示节律遗传背景对BD易感性及临床特征的影响。
1 对象与方法
1.1 研究对象
1.1.1 样本量的确定 采用 QUANTO 软件进行样本量的估算,相关参数设置如下:采用病例-对照研究设计,病例组与对照组样本量相当,假设疾病只受基因的影响;检验水准α取 0.05(双侧检验);采用加性模型;小等位基因频率(minor allele frequency,MAF)取0.25;把握度 Power 采用 0.90;比值比(odds ratio,OR)取1.30。由此,计算出人群关联研究中各组所需最小样本量为140例。病例组实际最终纳入患者142例,健康对照组纳入正常对照者138例。
1.1.2 研究对象分组 病例组:在2018年12月至2020年1月收集142例年龄为18~60岁的双相情感障碍患者,均来自四川大学华西医院心理卫生中心及四川省人民医院心身医学中心门诊及住院患者,且符合《美国精神障碍诊断与统计手册》第4版(Diagnostic and Statistical Manual of Mental Disorders,DSM-IV)双相情感障碍诊断标准,由课题组统一培训的精神科医师通过系统精神检查确诊(一致性检验的Kappa值>0.8)。排除标准:①既往患有或合并其他精神疾病以及人格障碍者;②患严重躯体疾病(内分泌、心血管及神经系统疾病等),严重脑外伤史,严重感染,体格检查或实验室检查发现明确异常者;③入组前3个月内使用过可能影响代谢的药物,如糖皮质激素等;④妊娠或哺乳期女性。对照组:同期收集西南地区年龄在18~60岁的健康对照者138例,与病例组具有相似的人文地理背景,并由课题组统一培训的精神科医师使用DSM-Ⅳ轴Ⅰ定式临床精神检查(对照组版)(Structured Clinical Interview for DSM-IV,SCID-NP),排除目前或既往患有精神疾病或严重躯体疾病者。所有入组对象为中国汉族人群,两组患者无血缘关系,并签署知情同意书。本研究通过四川省人民医院伦理委员会批准实施[伦审(研)2018年第18号]。
1.2 方法
1.2.1BMAL1基因单核苷酸多态性检测
1.2.1.1 血样采集 所有研究对象入组后抽取外周静脉血5 mL,EDTA抗凝,充分混匀后置于-20 ℃冰箱冷冻保存。采用常规酚-氯仿法提取外周静脉血DNA。
1.2.1.2 基因分型 筛选了BMAL1基因上次要等位基因频率(minor allele frequency, MAF)>0.2的单核苷酸多态性位点(参考网站:https://www.ncbi.nlm.nih.gov/snp/),使用https://snpinfo.niehs.nih.gov/snpinfo/snpfunc.html 网站进一步对筛选所得的 SNPs 进行功能预测,找出具有功能意义的位点。共筛选出16个SNPs进行检测;使用在线Primer3软件(http://bioinfo.ut.ee/primer3-0.4.0)进行引物设计(表1)。研究采用SNapShot分型技术进行16个位点的基因分型。分型过程包括PCR反应及SNapShot多重单碱基延伸反应。延伸产物使用ABI3730XL测序仪进行测序。原始数据使用GeneMapper 4.1进行分析。

表1 纳入检测的SNP的引物序列
1.2.2 激素水平检测 抽取患者外周静脉血,进行HPT轴的促甲状腺激素(TSH)、三碘甲状腺原氨酸(TT3)、游离三碘甲状腺原氨酸(FT3)、甲状腺素(TT4)、游离甲状腺原氨酸(FT4)和HPA轴的促肾上腺皮质激素(ACTH)、皮质醇(COR)7种激素检测;TT3、TT4、FT3、FT4和COR使用电化学发光定量分析检测;TSH使用ELISA法检测;ACTH采用放射免疫分析法检测。由四川大学华西医院检验科检测所有指标,各激素正常值范围参考如下,TSH:0.27~4.20 mU/L,TT3:1.3~3.1 nmol/L,FT3:3.6~7.5 pmol/L,TT4:62~164 nmol/L,FT4:12~22 pmol/L,ACTH:5.0~78.0 ng/L,COR(晨8:00):147.3~609.3 nmol/L,高于或低于参考值范围定义为“异常”。本研究将上述HPT轴任一激素水平指标异常定义为HPT轴异常,上述HPA轴任一激素水平异常定义为HPA轴异常。
1.2.3 临床心理量表评估 患者入组后,接受大五人格量表简版(neuroticism extraversion openness five-factor inventory, NEO-FFI)进行人格特质评估[15]。NEO-FFI量表包含外倾性、开放性、宜人性、尽责性和神经质5个维度,各维度Cronbach’s α系数分别为0.78、0.63、0.72、0.74、0.77。
1.3 统计学分析
本研究采用SPSS 18.0进行统计分析。采用χ2检验计算哈迪-温伯格平衡(Hardy-Weinberg Equilibrium, HWE),SHEsis软件进行连锁不平衡(linkage disequilibrium, LD)分析[16]。使用PLINK软件进行各组间SNP等位基因、基因型及各SNP相互作用的逻辑回归统计。使用χ2检验或独立样本t检验、单因素方差分析进行两组基本人口学资料比较、不同SNP基因型患者的NEO-FFI量表评分比较及不同SNP基因型患者的HPA轴和HPT轴异常率比较。使用Logistic回归构建多因素模型。多重比较使用Bonfferoni法进行校正。所有检验为双侧检验,检验水准α=0.05。
2 结果
2.1 一般资料比较
在收集的142例患者和138例对照者中,分别有6例和8例因血样不合格(血样过少或溶血)被剔除,本研究最终纳入136名双相情感障碍患者(BD组)和130名正常对照者(对照组)。BD组男性28例,女性108例,对照组男性60例,女性70例。BD组的女性比例显著高于对照组(P<0.001);两组间年龄分布亦有显著性差异(P<0.001),BD组年龄[(29.97±13.46)岁]明显小于对照组[(38.96±8.20)岁]。
2.2 BMAL1基因的各SNP分布与BD易感性比较
2.2.1 HWE及LD分析 所检测的16个SNP位点的HWE检验均P>0.05,提示符合HWE定律。同时各组检测的SNP位点各MAF值均与基因库中相应位点MAF值相似,且连锁不平衡分布亦与基因库信息相似,提示本研究检测的样本具有较好的可靠性和代表性(图1)。

图1 本试验样本(A)与基因库信息(B)连锁不平衡比较
2.2.2 各SNP等位基因及基因型分布频率比较 所检测的16个SNP位点的等位基因频率在BD组和对照组间差异无统计学意义(表2)。rs10832022位点在BD组和对照组间的基因型分布差异有统计学意义(χ2=8.793,P=0.010);rs10832022的A-等位基因携带者在BD组(86.8%)显著高于对照组(73.1%)(χ2=7.805,P=0.005)。rs11022765位点在BD组和对照组间的基因型分布差异亦有统计学意义(χ2=9.009,P=0.010);rs11022765的C-等位基因携带者在BD组(91.2%)亦显著高于对照组(80.0%)(χ2=6.78,P=0.009)。此外,rs6486116位点在BD组和对照组的基因型分布差异有统计学意义(χ2=6.128,P=0.040);C-等位基因在BD组的频率显著高于对照组(前者85.3%,后者73.1%,χ2=6.049,P=0.010),见表3。
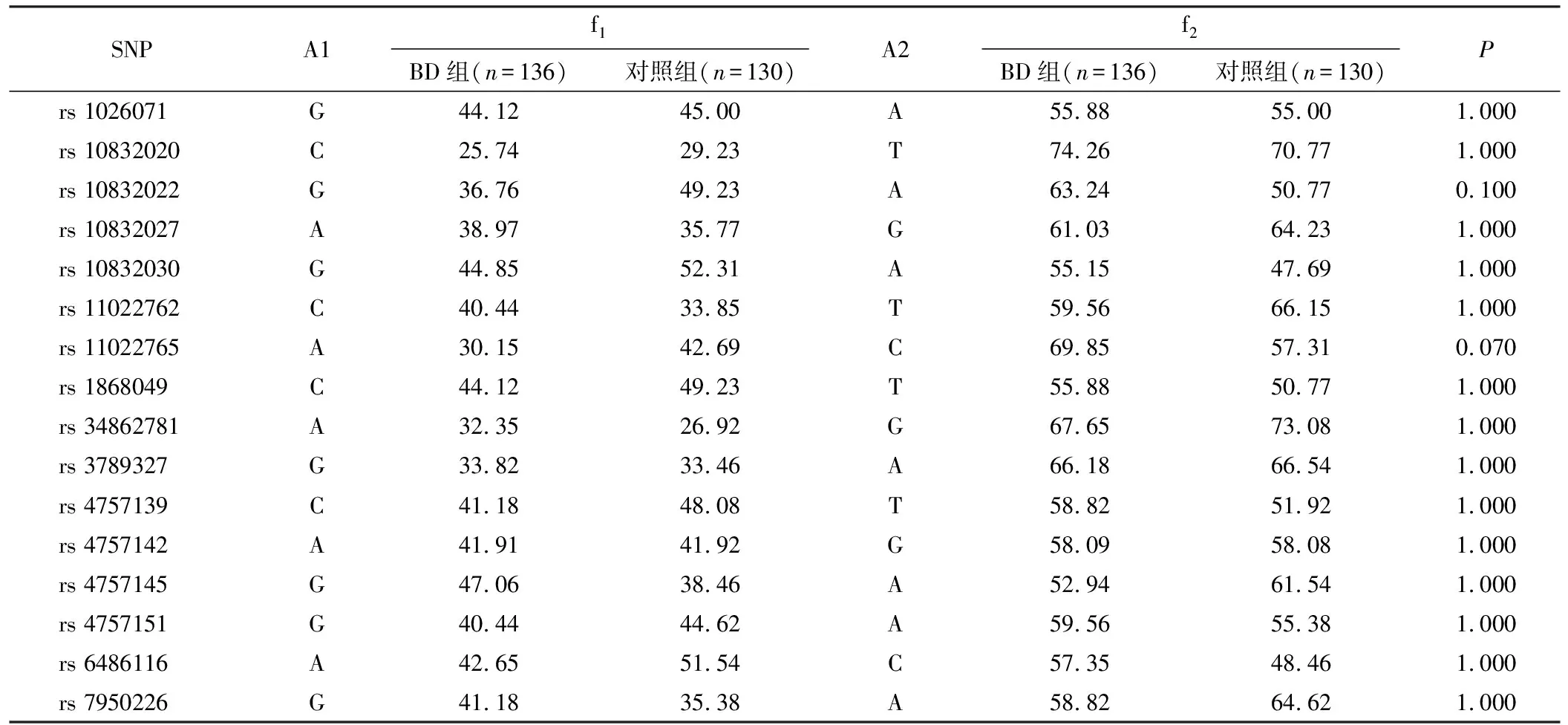
表2 两组间各SNP等位基因频率分布比较 (%)

表3 BD组和对照组各SNP位点基因型分布比较 (例)
2.2.3 单倍型分析 连锁不平衡分析显示,rs6486116和rs10832020,rs10832022、rs11022765和rs11022762分别存在连锁不平衡关系(图2A,B)。单倍型分析显示,rs6486116-rs10832020的CT单倍型在BD组分布显著高于对照组(χ2=4.219,P=0.040,OR=1.430,95%CI:1.016~2.013);而rs10832022-rs11022765-rs11022762的GAT单倍型在BD组(30.1%)分布则显著低于对照组(42.7%)(χ2=9.050,P=0.003,OR=0.579, 95%CI:0.405~0.828,表4)。
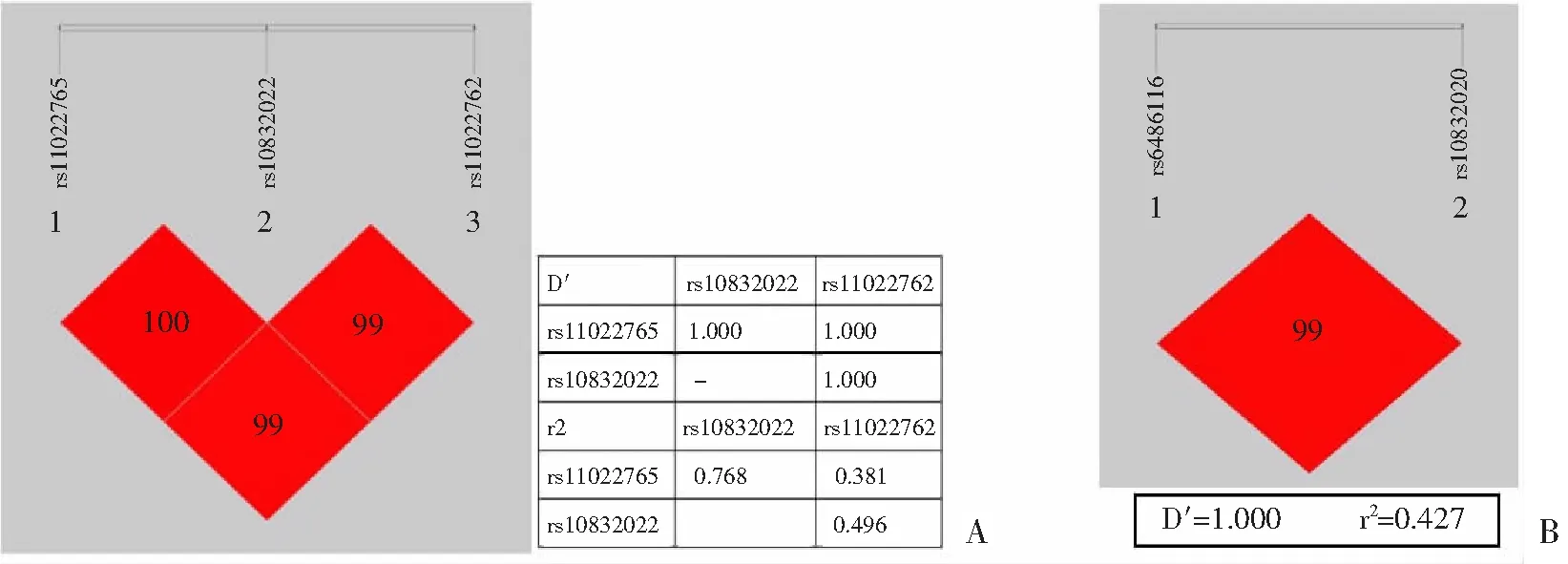
A: rs10832022、rs11022765和rs11022762连锁不平衡分析;B: rs6486116和rs10832020连锁不平衡分析
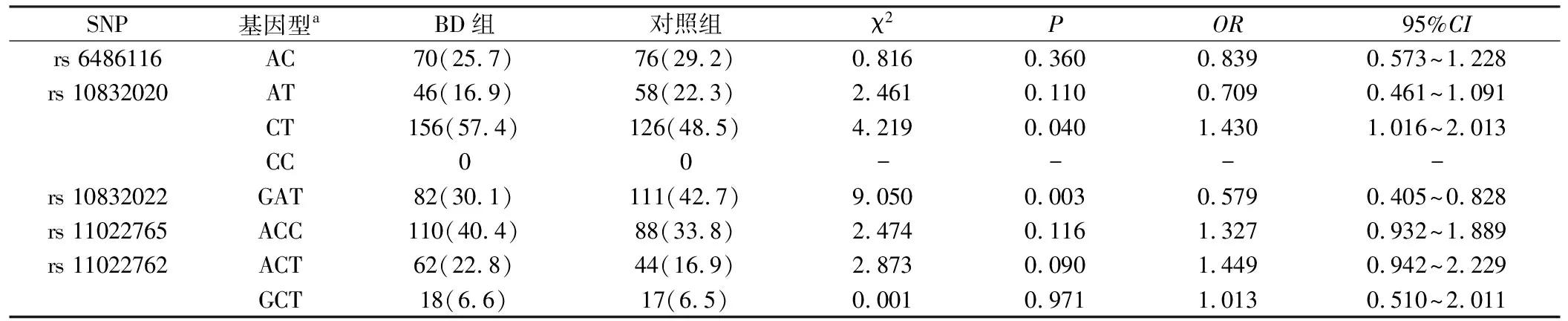
表4 BD组和对照组单倍型分析 [例(%)]
2.3 BMAL1基因的各SNP基因型分布与BD患者临床特征的关联性比较
2.3.1BMAL1基因的各SNP基因型分布与BD患者人格特质的关系比较 对上述在病例组和对照组间分布有显著差异性的SNP各基因型患者的临床特征进行比较。结果显示,rs10832022各基因型患者在NEO-FFI量表的神经质(F=4.482,P=0.013)、外倾性(F=6.682,P=0.002)和尽责性(F=6.130,P=0.003)3个维度评分差异均有统计学意义;rs11022765各基因型患者在NEO-FFI量表的神经质(F=4.326,P=0.015)、外倾性(F=10.508,P<0.001)和尽责性(F=5.812,P=0.004)3个维度评分差异亦具有统计学意义;其中rs10832022的G/A基因型患者(45.13±5.45)和rs11022765的C/A基因型患者的尽责性因子得分(44.93±5.57)均高于常模。rs11022765的A/A基因型患者神经质因子得分(39.67±4.207)亦高于常模。见表5。

表5 BMAL1基因SNP各基因型患者NEO-FFI评分比较
rs6486116各基因型患者的NEO-FFI量表尽责性因子评分有显著性差异(F=4.123,P=0.018),但经Bonferroni多重比较则未显示出两两显著性差异。
2.3.2BMAL1基因的各SNP基因型分布与BD患者神经内分泌轴改变的关系 rs10832022各基因型患者的HPT轴异常率[A/A(3.7%),G/A(21.9%),G/G(22.2%)]差异有统计学意义(χ2=8.644,P=0.013),其中G/G等位基因携带者的HPT轴异常率(22.2%)显著高于A/A基因型患者(3.7%)(χ2=8.643,P=0.003)。rs11022765各基因型患者的HPT轴异常率[A/A(22.9%),C/A(20.7%),C/C(6.1%)]差异亦有统计学意义(χ2=8.908,P=0.012),A/A等位基因携带患者的HPT轴异常率(22.9%)显著高于C/C基因型患者(6.1%)(χ2=7.641,P=0.006)。此外,虽然rs10832020各基因型患者的HPA轴异常率差异有统计学意义(χ2=8.594,P=0.014),但由于C/C基因型患者仅2名,在与C/T基因型患者合并后与T/T基因型比较差异无统计学意义(χ2=0.190,P=0.663)。
2.3.3 不同SNP基因型临床特征的逻辑回归分析 将rs10832022和rs11022765作为因变量,HPT轴异常率作为自变量,分别进行多元逻辑回归。结果显示:以rs10832022为因变量的回归模型中,HPT轴异常率通过似然比检验进入模型(χ2=8.628,P=0.013);以rs11022765为因变量的回归模型中,HPT轴异常率通过似然比检验进入模型(χ2=14.281,P=0.001);此外,两个回归模型的拟合信息显著性水平分别为0.001和<0.001,均提示模型有统计学意义。
3 讨论
3.1 BMAL1基因与疾病
分子生物钟系统维持生物体的日常循环。昼夜节律基因的转录-翻译反馈环路(transcription-translation feedback loop,TTFL)保证了这个周期,即使没有外部时间提示,它也能保持昼夜节律时钟的运转[17]。在哺乳动物的TTFL系统中,主要由CLOCK和BMAL1组成的异源二聚体构成[18]。BMAL1基因又被称为ARNTL基因,在机体节律中枢常与CLOCK结合形成异二聚体,与靶基因启动子区上游的E-box增强子识别并结合,从而促进靶基因转录;其编码的转录因子蛋白通过自身及正负反馈通路产生昼夜节律[8]。相关研究显示,BMAL1缺失会导致强烈的心律失常表型、葡萄糖耐受不良和过早衰老[19-21]。迄今为止,BMAL1基因与精神疾病关系的研究相对较少。LEE等[22]在对一种与多种精神障碍有关的支架蛋白DISC1的研究中发现,DISC1的表达表现出每日振荡的模式,并通过CLOCK/BMAL1异二聚体来调控其启动子中的E-box序列, DISC1缺乏增加了BMAL1的泛素化并使其失稳,从而降低了其蛋白质水平。QIU等[23]研究BMAL1基因敲除对食蟹猴的影响,猴子表现出更高的夜间活动能力和更少的睡眠,此外BMAL1缺陷的猴子表现出焦虑和抑郁,这与它们稳定升高的血液皮质醇一致。BMAL1 rs11600996多态性位点被发现与男性BD患者酒精依赖的共病风险相关[24]。既往学者通过对精神特质的全基因组关联研究(genome-wide association studies,GWAS)认为,BMAL1基因可作为鉴别BD和精神分裂症的少数位点之一,该基因被敲除的猕猴可表现出精神分裂症样症状[25]。
3.2 BMAL1基因与BD临床特征的关系
本研究发现BMAL1基因的rs10832022、rs11022765和rs 6486116 3个SNP位点基因型分布在BD患者和健康对照者中,rs10832022 A-、rs11022765 C-和rs6486116 C-等位基因携带者在BD组的频率均显著高于对照组。rs10832022和rs11022765均位于BMAL1基因内含子2区,它们与同在该区域的rs11022762组成的单倍型GAT在双相情感障碍患者分布显著低于健康对照者;而位于内含子1区的rs6486116和rs10832020组成的单倍型CT则在BD患者中分布频率显著高于对照者。上述结果提示,BMAL1基因的某些多态性位点与BD发生的易感性相关。虽然这几个位点所在的内含子区域并不直接参与相应RNA转录翻译,但仍可能对基因线性表达及转录翻译的选择性剪接产生影响,进而影响节律相关疾病的发生[26]。下一步研究将结合表观遗传学及下游表达水平检测,探讨这一区域功能改变在BD发生中的作用。
不同人格特质被认为在BD疾病的发生发展中起着重要作用。既往研究发现,BD患者的神经质、外向型特质明显高于抑郁障碍患者和健康对照者;存在高神经质、高精神质的BD患者具有更明显的冲动性倾向[27]。目前关于遗传异质性与BD患者人格特质的关系研究主要集中于单胺系统。近期的国内研究发现,携带多巴胺D4受体(DRD4)基因第3外显子的48 bp可变数目串联重复序列(VNTR)长重复等位基因的BD患者人格特质中冲动、自私、寻求刺激等特征更为突出[28];同时,多巴胺转运蛋白基因(DAT1)启动子区变异可能与BD患者避免伤害的人格特质相关[29]。本研究发现位于内含子区域的rs10832022和rs11022765两个SNP的不同变异与BD患者的神经质、外倾性和尽责性人格特质相关,其中rs11022765的A/A基因型患者的神经质得分高于常模,提示该基因型患者可能存在不稳定的情绪波动,或对预后产生影响。经过逻辑回归排除混杂因素影响后,rs11022765仍与外倾性人格特质显著相关,其中C/A杂合子基因型患者该人格特质最为突出。外倾性特质的个体常表现为具有积极情绪、充满活力、乐于与人相处,且外倾性特质增高被认为与BD患者冲动攻击行为减少有关。因此,这一基因型可能成为BD患者出现暴力风险的保护性因子,有待在下一步的前瞻性研究中通过观察不同基因型和人格特质BD患者的预后分析。
BD患者存在多种神经内分泌节律的紊乱,HPA轴功能亢进,海马和杏仁核区糖皮质激素受体mRNA表达异常。既往研究显示,HPA轴相关基因中,促肾上腺皮质激素受体(CRHR1)基因多态性与BD患者精神病性症状的发生及BD的发病相关[30]。本研究未发现所检测的BMAL1基因各SNP变异与HPA轴激素水平异常相关,但发现rs10832022和rs11022765两个SNP与HPT轴激素水平异常存在关联,rs10832022的G-等位基因携带者和rs11022765的A-等位基因携带者均存在更高的HPT轴异常率。HPT轴功能的异常亦常见于BD,患者的血清甲状腺素水平异常率可高于健康人群的2倍以上,且FT4水平亦明显升高[31-32]。同时,HPA轴功能的持续亢进会造成对HPT轴功能抑制,因此HPT轴的异常情况可能成为评估BD病情严重程度的参考指标[33]。从节律失调角度,结合本研究结果,推测BMAL1 rs10832022的G-等位基因和rs11022765 A-等位基因携带的患者体内可能存在更严重的神经内分泌节律受损情况,提示这两种基因型有望作为今后预测疾病严重程度的生物学标志物。既往研究发现,BMAL1基因的rs2228099多态性位点与女性人群发生失眠相关[34]。近期研究发现,睡眠可驱动脾脏单核细胞内的BMAL1基因有节律的迁移,从而提高免疫细胞功能[35],提示BMAL1基因可能参与睡眠节律的调节。由于BD患者常存在睡眠节律的紊乱,因此本研究发现的BMAL1基因多态性变异与BD易感性和神经内分泌轴功能改变的相关性进一步支持了可将BD视为一种节律障碍这一观点[4]。
本研究发现的与对照组存在显著差异性基因型分布的rs10832022和rs11022765两个SNP与BD患者神经内分泌轴改变相关,提示在影响疾病易感性的同时,这些基因多态性可能参与特定疾病临床表型的发生。
BMAL1基因rs11824092和CLOCK基因rs11932595多态性在BD抑郁患者的睡眠障碍中存在交互作用[12];且BMAL1基因和单胺氧化酶A基因在BD患者和健康对照者中的表达呈显著相关性,提示生物节律与神经递质失衡之间的强连接[36]。由于单胺类神经递质的改变被认为与BD这一类重性精神疾病的发生密切相关,因此,结合基因相互作用及神经生化、社会心理、疾病临床表型等多维度因子建立疾病的节律遗传易感性模型有助于对BD这一类复杂性疾病的整体认识。
3.3 本研究的不足及总结
本研究尚有不足之处。研究样本量偏小,且尚不足以发现其他可能与BD易感性相关的BMAL1基因多态性位点。其次,本研究发现的与BD相关的基因多态性在考虑年龄、性别因素影响后显著性不突出。由于本研究收集的BD组患者的女性比例显著高于对照组,年龄显著小于对照组,这与目前BD的流行病学特征一致[37],虽然上述差异的显著性受到影响,但仍提示本研究样本具有一定代表性和可靠性。
综上所述,本研究在中国汉族人群中发现BMAL1基因内含子区SNP不同变异与BD的易感性以及神经内分泌轴改变存在相关趋势,初步提示节律遗传异质性参与了BD疾病及某些临床表型的发生,有助于对该疾病的早期预测和预后评估,并为基于不同节律遗传背景的个体化治疗模式的研发提供了一定线索。
利益冲突声明本文所有作者声明不存在利益冲突
