荧光假单胞CLW17菌株对草甘膦的降解及其机制初探
2022-11-25曹永清张丽慧晋婷婷任嘉红
曹永清,刘 艳,张丽慧,晋婷婷,任嘉红
(1山西师范大学生命科学学院,太原 030000;2长治学院生命科学系,山西长治 046011)
0 引言
草甘膦(Glyphosate)俗称农达,学名N-(膦酸甲基)甘氨酸(C3H8NO5P),是一种高效除草剂[1]。草甘膦虽具有低廉、高效、毒性低、残留少、易降解等优点,但一旦施用于土壤,便会借助其极性基团与土壤颗粒紧密结合,难以祛除,长时间使用或者施用不当容易对非靶标生物和环境造成破坏[2]。目前,由于人们对草甘膦的无节制使用,在自然界的草甘膦量已远超出了环境对其的自然分解能力,产生的许多有害物质慢慢的积累下来,通过土壤扩散或者水流等途径进入食物链中,对生态环境乃至人类的健康带来了很大的威胁[3-6]。目前国内外对草甘膦污染的处理方法均存在一定的局限性,主要原因包括设备成本高、工程量大、处理效果与预期相差甚远且容易造成二次污染等[7]。因此有关草甘膦带来的环境效应及其修复技术逐渐成为了学者们讨论的热点话题。
利用微生物降解草甘膦是低成本高效率且对环境影响小的草甘膦降解方法,极具发展前景[8]。降解草甘膦的微生物种类主要包括假单胞菌属(Pseudomonas)、节杆菌属(Arthrobacter)以及产碱杆菌属(Alcaligrenes)[9]、产黄菌属(Flavobacterium)[10]等;同时土壤中的真菌也具有降解草甘膦的能力[11]。随着草甘膦降解菌的深入研究,菌株的降解途径也逐渐被阐明,微生物主要通过草甘膦氧化酶途径和肌氨酸途径[12]降解草甘膦。因此,寻找更多具有强降解草甘膦能力的菌株,对于开发降解草甘膦微生物菌剂以及修复草甘膦造成的环境危害都具有重大意义。
荧光假单胞菌(Pseudomonas fluorescens)CLW17是任嘉红等[13-14]从南方红豆杉根际筛选出的一株高效溶无机磷细菌,该菌株可显著提高土壤中可溶性磷含量,增加植物对磷元素的吸收,还可分泌嗜铁素、生长素以及ACC脱氨酶等来促进植物的生长。经过对CLW17全基因组数据进行分析和注释,发现该菌株的全基因组中存在与草甘膦降解相关的基因和途径。为探讨CLW17菌株降解草甘膦的能力,本研究通过Plackett-Burman(PB)及Central Composite Design(CCD)方法联用对影响其降解草甘膦的相关因素进行筛选和优化,以期达到最大降解率;同时通过分析CLW17菌株的基因组学信息,对甘氨酸氧化酶基因thiO基因进行敲除和回补,为深入探究其功能基因及揭示该菌株草甘膦降解途径奠定基础。研究结果可为利用微生物降解草甘膦的应用提供依据。
1 材料与方法
1.1 材料
1.1.1 主要菌株、质粒P.fluorescensCLW17、
Escherichia coliS17-1、自杀型质粒pEX18-Gm、回补质粒pJN105由本实验室低温保存。抗生素工作浓度:氨苄青霉素(Amp)100 μg/mL,庆大霉素(Gm)50 μg/mL。所需引物见表1。

表1 PCR引物
1.1.2 主要试剂 供试草甘膦为山东胜邦绿野公司生产(含量为41%);氨苄青霉素、庆大霉素,溶菌酶,Solarbio公司;蛋白酶K,MERCK公司;DNA胶回收试剂盒、质粒提取试剂盒,OMEGA公司;HindⅢ、EcoRⅠ、Q5polymerase,NEB公司;T4DNA Ligase,RNaseA,Takara公司;RapidTaqMaster Mix,Vazyme公司;其余药品为常规分析纯。
1.2 方法
1.2.1 草甘膦耐受性检测 将CLW17菌株活化后,取500 μL于50 mL LB液体培养基中,28℃、180 r/min培养,菌悬液稀释至10-7分别涂布于含草甘磷0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%的NA固体培养基,置于28℃恒温培养箱中倒置培养3天,观察CLW17菌株的生长情况。
1.2.2 唯一碳源、氮源和磷源试验 参照李冠喜等[19]的方法开展CLW17菌株的唯一碳源、氮源和磷源试验,通过测定OD600以确定CLW17菌株以草甘膦作为唯一碳源、唯一氮源和唯一磷源生长状况最好的培养基。
1.2.3 最佳碳源、氮源的确定 在含有0.4%草甘膦的基础无碳培养基中分别加入质量分数为1%的麦芽糖、葡萄糖、乳糖、蔗糖,以不加碳源的培养基为对照;同时,在含有0.4%草甘膦的基础无氮培养基中分别添加质量分数为0.05%的蛋白胨、硫酸铵、草酸铵、硝酸钾、硝酸铵,以不加氮源的培养基为对照,参照康纪婷等[16]的方法测定发酵液无机磷及全磷含量,并计算CLW17菌株对草甘膦的降解率。
1.2.4 降解草甘膦Plackett-Burman(PB)试验及Central Composite Design(CCD)试验 以草甘膦降解率为响应值,选择影响CLW17菌株降解草甘膦的8个因子(温度、pH、接种量、装液量、葡萄糖加入量、硫酸铵加入量、转速、草甘膦),每个因子取高低两个水平,X9、X10、X11为虚拟因子,以试验次数设置为12的PB设计法分析影响草甘膦降解的重要因子,试验设计见表2。采用CCD法[20-21]对由PB筛选出的关键因子进行试验设计,固定其他非关键因子。中心复合试验包括含3个关键因子的20组实验,每个变量设置5个水平,试验设计见表4。
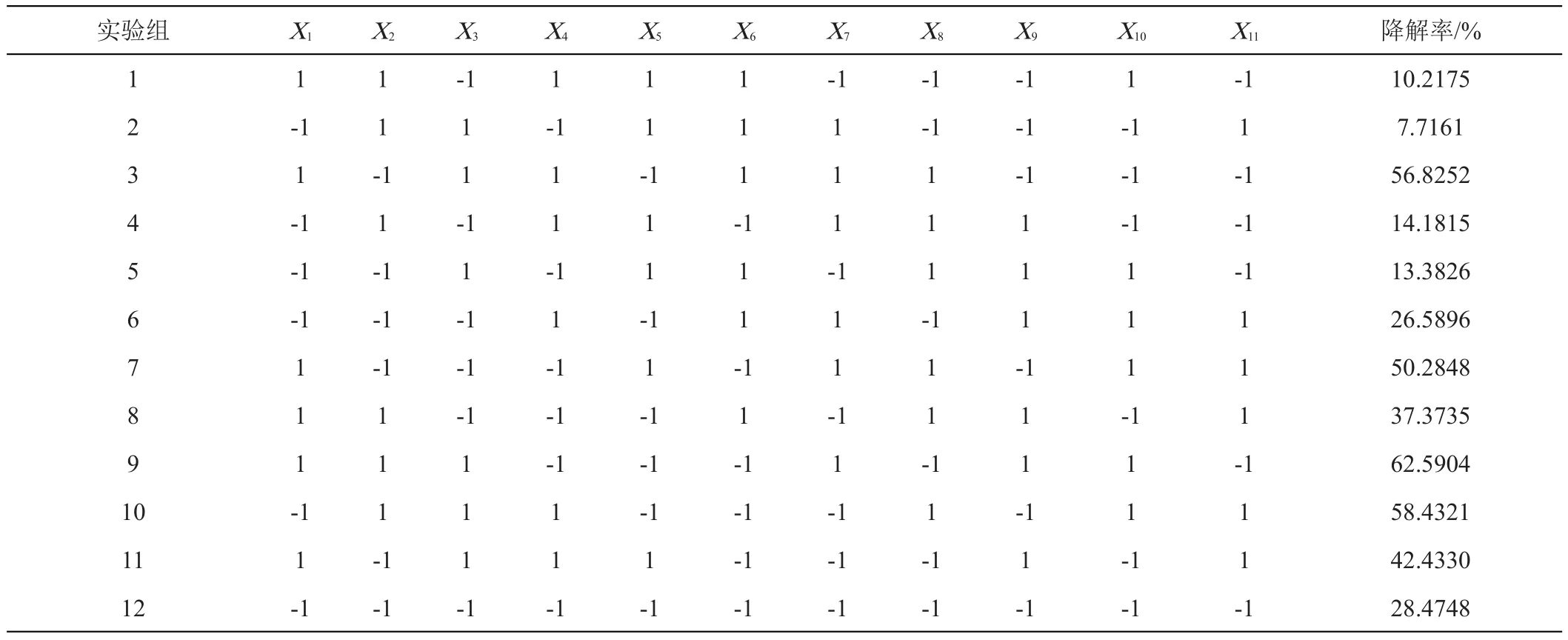
表2 Plackett-Burman试验设计及结果
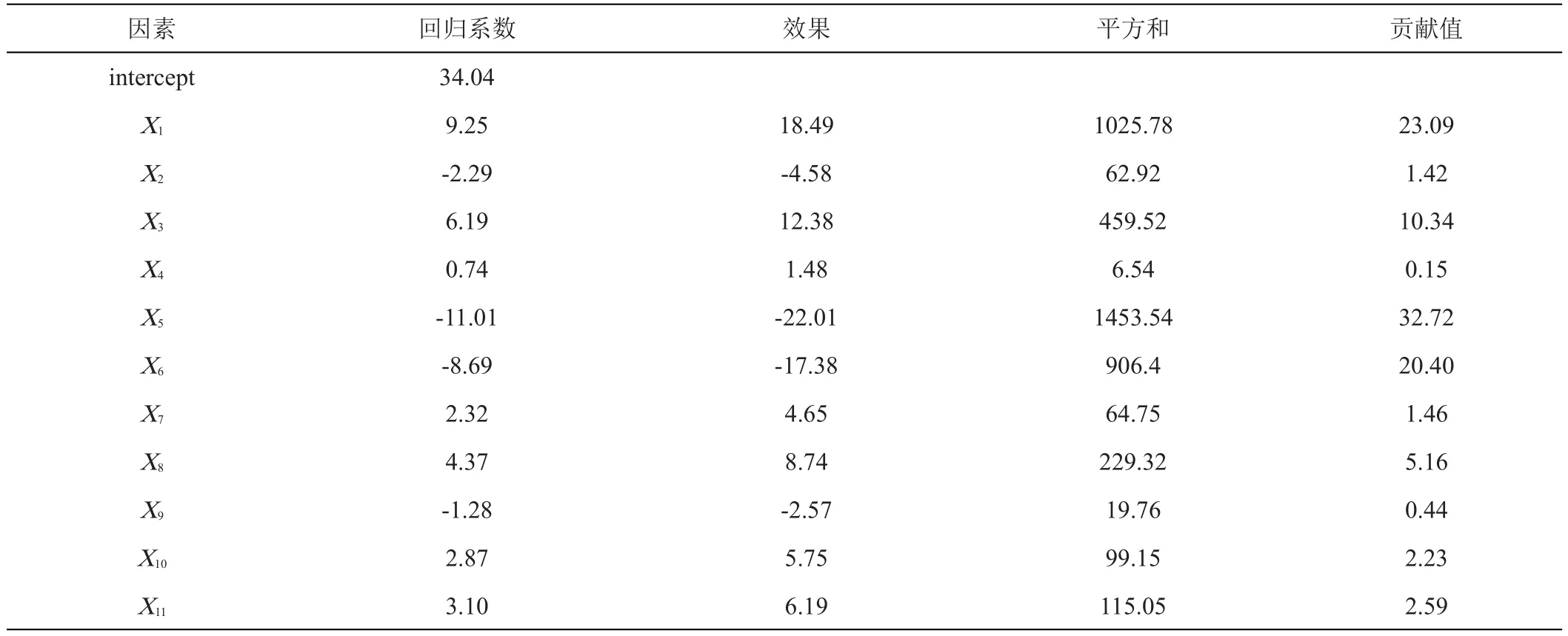
表3 偏回归系数及影响因子的显著性分析
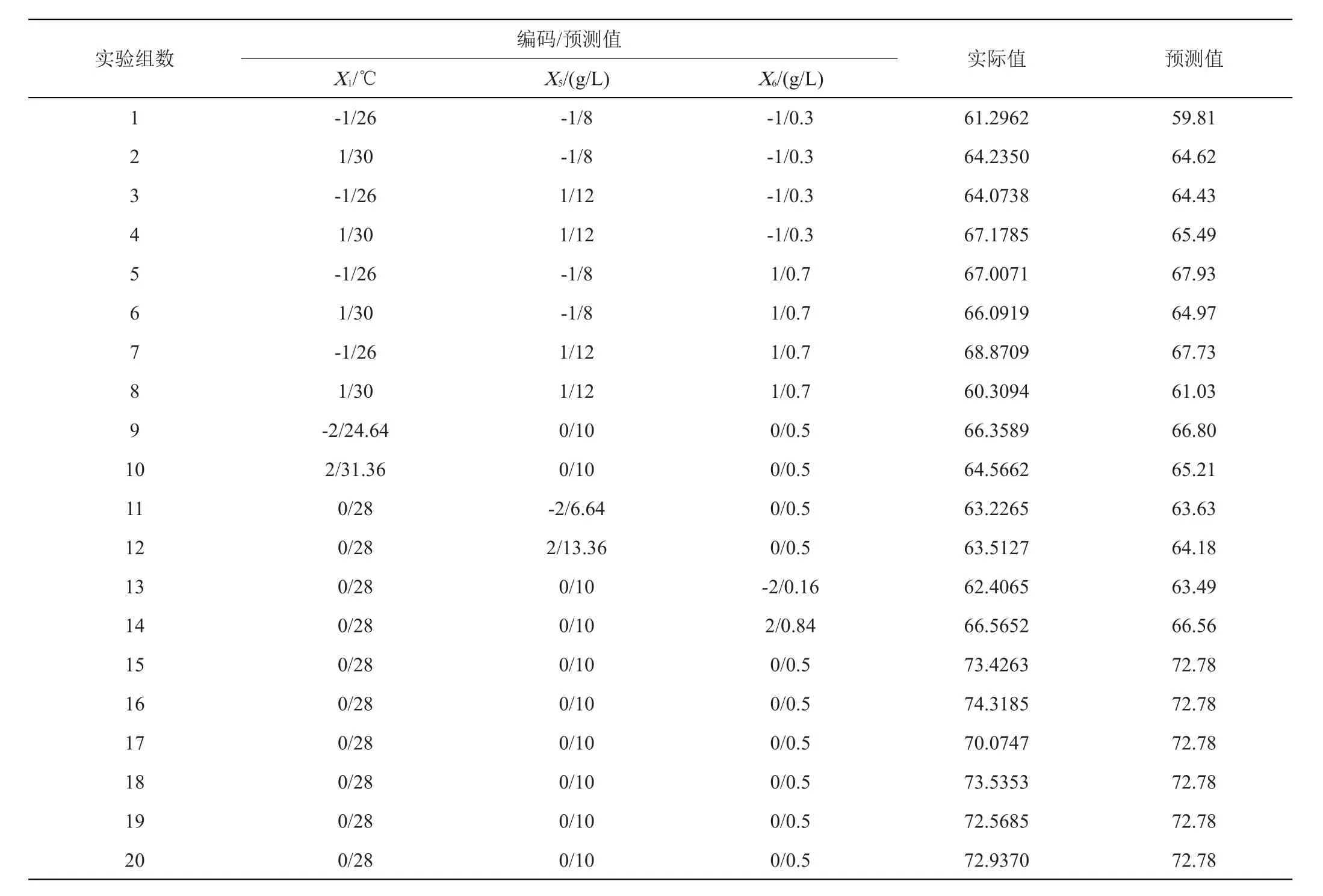
表4 中心组合及设计结果
1.2.5 草甘膦降解途径的基因组分析 通过对P.fluorescensCLW17全基因序列与KEGG和NCBI的相似性分析,筛选草甘膦降解途径中的关键基因,推测可能的草甘膦降解途径。利用Protparam(ExPASy-ProtParam tool)分析了预测的蛋白基本理化性质;利用NetPhos 3.1 Server(NetPhos-3.1-Services-DTU Health Tech)进行磷酸化位点分析;利用SignalP 5.0 server(SignalP-5.0-Services-DTU Health Tech)进行信号肽分析;利用TMHMM(TMHMM-2.0-Services-DTU Health Tech)进行蛋白序列跨膜区分析;利用NCBI CDD数据库(NCBI Conserved Domain Search(nih.gov))对蛋白质保守结构域进行分析;利用SMART(SMART:Main page(embl.de))对蛋白质结构功能域进行预测;利用SOPMA(NPS@:SOPMA secondary structure prediction(ibcp.fr))预测了基因编码蛋白的二级结构。
1.2.6thiO基因敲除突变株的构建 采用CLW17_04770FW(HindⅢ)/CLW17_Del04770FW及CLW17_04770RV(EcoR I)/CLW17_Del04770RV引物分别从CLW17基因组中扩增thiO基因同源前臂A和同源后臂B,利用重叠PCR将同源前臂A与同源后臂B连接起来,命名为thiO-A+B,产物经DNA胶回收试剂盒回收。将thiO-A+B和质粒pEX18-Gm酶切并连接,转化至E.coliS17-1感受态,之后进行菌落PCR验证并抽提质粒进行双酶切验证,测序正确后即获得重组质粒pEX18-Gm-thiO-A+B。通过接合转移[22]的方法将构建好的敲除载体pEX18-Gm-thiO-A+B导入CLW17中,在含有Gm(50 μg/mL)+Amp(100 μg/mL)的LB平板上分级划线,30℃过夜培养,将获得的单菌落在LAS平板上分级划线。之后分别在LAS平板及含有Gm 50 μg/mL的LB平板影印筛选,仅能在LAS上生长的为双交换菌株。最后使用引物CLW17_04770SQFW/CLW17_04770SQRV进行验证,获得敲除突变菌株CLW17ΔthiO。DNA测序委托北京华大基因公司。
1.2.7 ΔthiO/thiO回补株的构建 使用引物CLW17_Comp04770FW-EcoRⅠ/CLW17_Comp04770 RV-SpeI进行PCR扩增获得thiO基因,用限制性内切酶EcoRⅠ和SpeⅠ同时酶切thiO基因片段及质粒pJN105后进行连接,并转化至E.coliS17-1感受态,之后进行菌落PCR验证,并抽取质粒酶切验证,测序正确后获得重组质粒thiOcomp-pJN105。通过接合转移的方式将重组质粒导入到敲除株CLW17ΔthiO中(记为ΔthiO/thiO),同时将空载体pJN105导入到敲除株CLW17ΔthiO作为对照(记为ΔthiO/pJN105),过夜培养。挑取菌苔在含有Gm 50 μg/mL M9基本培养基平板上分级划线,待长出单菌落后点种于Gm 50 μg/mL+M9平板。挑取单菌落,以pBAD-Forward/T7为引物进行PCR验证,以ΔthiO/pJN105为阳性对照。
1.2.8 敲除株及回补株草甘膦降解率的测定 敲除株CLW17ΔthiO与回补株ΔthiO/thiO草甘膦降解率的测定方法同1.2.4。
语言不能脱离文化而存在,脱离文化的语言学习是难以成功的。同一事物在不同文化中意义可能千差万别,因此,了解语言所处的特定文化背景是交际成功的保障。
2 结果与分析
2.1 CLW17菌株对草甘膦的耐受性
CLW17菌株在草甘膦含量为0.1%~0.4%的NA平板上长势良好,均表现为旺盛生长;当草甘膦浓度大于0.4%,菌株生长受到抑制;当达到0.8%时,菌株停止生长。这说明CLW17菌株对草甘膦的最大耐受浓度为0.7%,菌株在该浓度以下均能发挥降解作用,但浓度低于0.4%时CLW17能更高效地降解草甘膦。
2.2 CLW17菌株降解草甘膦的最适碳源和氮源
2.2.1 唯一碳源、氮源、磷源试验 CLW17菌株在以草甘膦为唯一碳源、氮源、磷源的培养基上均能生长。由图1可知,菌株在以草甘膦为唯一磷源的培养基上生长最好,以草甘膦为唯一碳源的培养基次之,以草甘膦为唯一氮源的培养基上生长最差,说明CLW17菌株能够高效利用草甘膦作为自身生长的磷源。因此,后续实验均采用草甘膦作为CLW17菌株生长的唯一磷源。这也进一步说明该菌株具有应用于草甘膦污染土壤的巨大潜力。
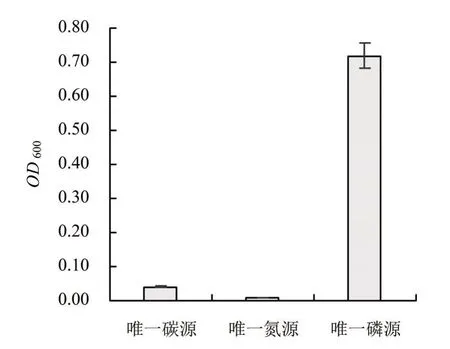
图1 CLW17在以草甘膦为唯一碳源、氮源、磷源培养基上的生长状况
2.2.2 最佳碳源和氮源的确定 不同碳源对于CLW17菌株降解草甘膦的影响程度如图2所示。CLW17菌株在添加外源碳源的条件下对草甘膦的降解率均显著高于无碳源培养时对草甘膦的降解率,其中以葡萄糖作为唯一碳源时对草甘膦的降解率最大,说明CLW17菌株降解草甘膦时所需的最佳碳源为葡萄糖,因此后续实验均采用葡萄糖作为CLW17菌株降解草甘膦培养基中的唯一碳源。
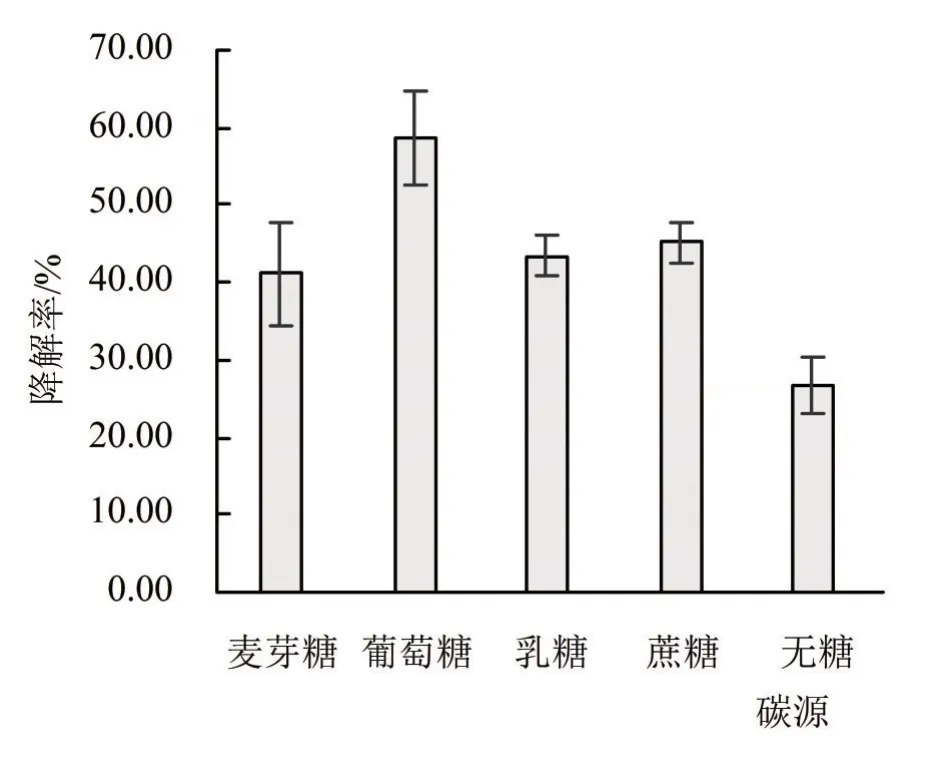
图2 不同碳源对CLW17菌株降解草甘膦的影响
不同氮源对于CLW17菌株降解草甘膦的影响程度如图3所示。由图3可以看出,添加外源氮源条件下CLW17菌株降解草甘膦的效率显著高于无氮源培养时对草甘膦的降解率,且以硫酸铵为唯一氮源时对草甘膦的降解率最大,因此后续实验均采用硫酸铵作为CLW17菌株降解草甘膦培养基中的唯一氮源。
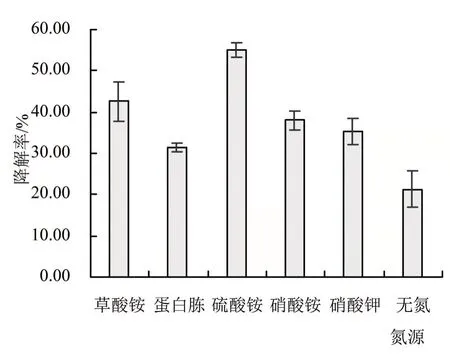
图3 不同氮源对CLW17菌株降解草甘膦的影响
2.3 降解草甘膦关键影响因子的筛选
Plackett-Burman试验设计及结果如表2所示。利用Design Expert 12软件进行ANOVA分析,由分析结果可知(表3),X2(初始pH)、X5(葡萄糖加入量)、X6(硫酸铵加入量)对降解率的影响均表现为负效应,其他各因素对降解率的影响均表现为正效应。经过试验得到以草甘膦降解率为响应值的线性回归方程:Y=-9.45169+4.62282X1-11.01X5-8.69X6,方程中Y为预测的降解率,Xi为变量。其中由贡献值可知,X1(温度)、X5、X6对草甘膦降解率影响较大,ANOVA分析中P值为0.0071,表明拟合效果极显著。决定系数(R2)为0.7621,调整系数(adjR2)为 0.6729,变化系数(CV)为33.77%,精密度为8.7223,说明该数学模型可以较好的反映实验结果,能够用来对草甘膦降解率进行评估。
2.4 降解草甘膦关键影响因素CCD试验结果及效应分析
将PB试验筛选出的3个关键因子进行组合设计,结果如表4所示。经回归拟合得到二次方程模型Y=-637.55284+38.08443X1+23.81997X5+239.05650X6-0.233762X1X5-4.85006X1X6-3.01244X5X6-0.599247X12-0.784240X52-68.55762X62(Y为预测的响应值,X1为温度,单位℃,X5、X6分别为葡萄糖和硫酸铵加入量,单位g/L)。由表5可得,因素X6对降解效果的线性效应显著,而因素X1和X5不显著;因素X12、X52、X62对降解效果的曲面效应极显著;X1X6对降解率的交互影响极显著,X5X6对降解率的交互影响显著,而X1X5对降解率的交互影响不显著。回归模型P值(prob>F)<0.0001,失拟项(P=0.4660>0.05),说明拟合程度好。决定系数(R2)为0.9387,调整系数(adjR2)为 0.8835,变化系数(CV)为2.23%,精密度为12.262,表明该模型的可信度较高,能较好的反映实际情况,可以对降解率进行合理的预测。
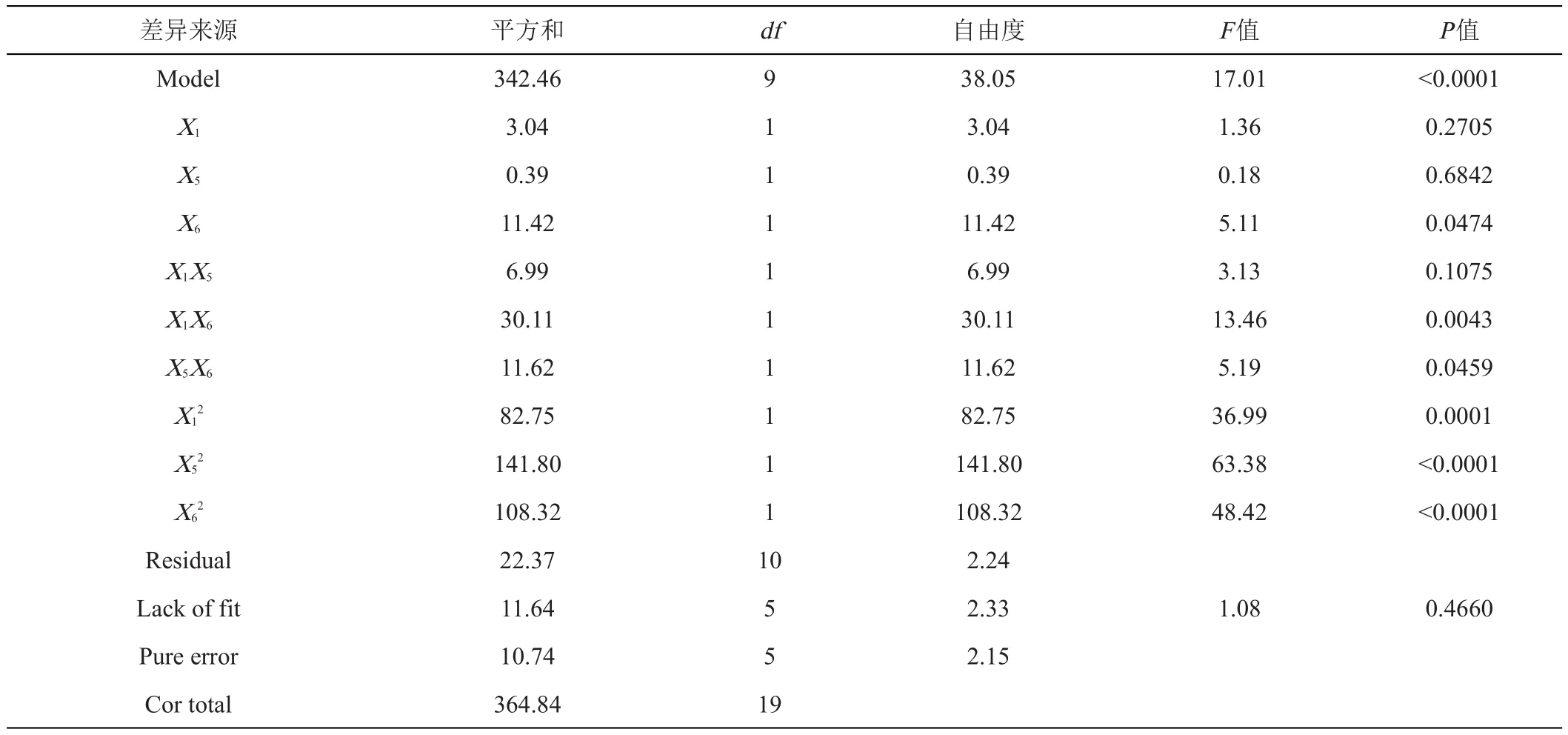
表5 降解率优化的模型适配和方差分析结果
由Design Expert 12软件对模型优化处理得到CLW17菌株降解草甘膦的最佳条件为:固定其他因素(草甘膦加入量0.4%,100 mL三角瓶装液量50 mL,接种量1%,初始pH 7.0,转速200 r/min),关键因素温度30℃,蒙金娜培养基中葡萄糖9.82 g/L,硫酸铵0.47 g/L,其他成分按基础配方,理论计算对草甘膦的降解率达到70.03%。为了验证模型的准确性,采用优化后的条件,共重复3次试验,3天后测定CLW17菌株对草甘膦的降解率分别为71.72%、73.87%、72.84%,菌株对草甘膦平均降解率为72.81%,与预测值70.03%较相近,表明模型拟合较好。证明了采用PB和CCD方法联用优化CLW17菌株降解草甘膦的条件的可行性。
2.5 草甘膦降解途径关键基因筛选
通过对CLW17全基因组数据分析和注释,该菌株预测到的与草甘膦降解可能相关基因如表6所示。其中thiO基因编码甘氨酸氧化酶,参与草甘膦氧化酶(CN)途径,在该酶作用下,草甘膦分子C-N键断裂,生成氨甲基磷酸(AMPA)和乙醛酸。乙醛酸进一步代谢为甘氨酸或通过甘氨酸循环转化为微生物生物量和二氧化碳,而AMPA可以被C-P裂解酶降解,释放无机磷和甲胺,后者被降解为甲醛;此外,C-P裂解酶是由phn或htx操纵子指定的一个小途径的酶,参与肌氨酸(C-P)途径,在该酶作用下,草甘膦分子C-P键断裂,释放无机磷酸盐和肌氨酸。肌氨酸可能通过肌氨酸氧化酶进一步降解为甘氨酸和甲醛[23-26]。根据已报道的草甘膦降解途径,预测CLW17草甘膦降解的可能途径如图4所示,包括C-N途径和C-P途径。
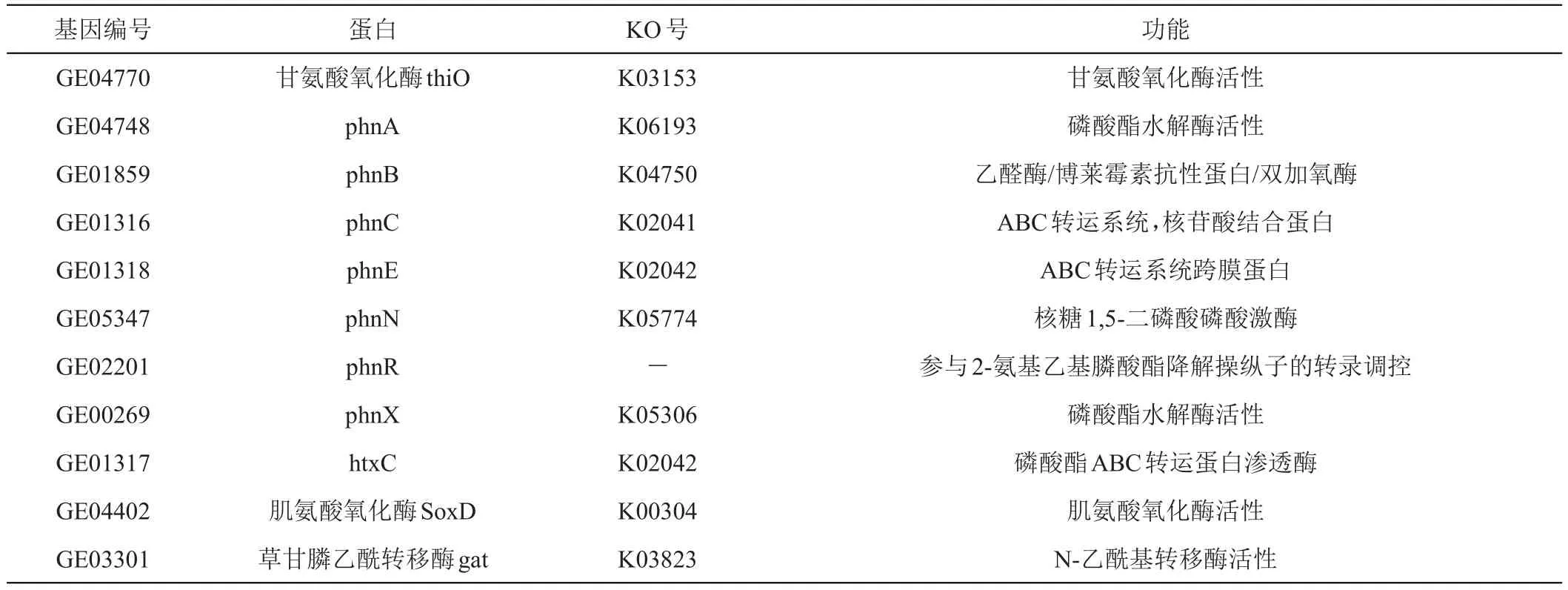
表6 CLW17草甘膦降解相关基因预测
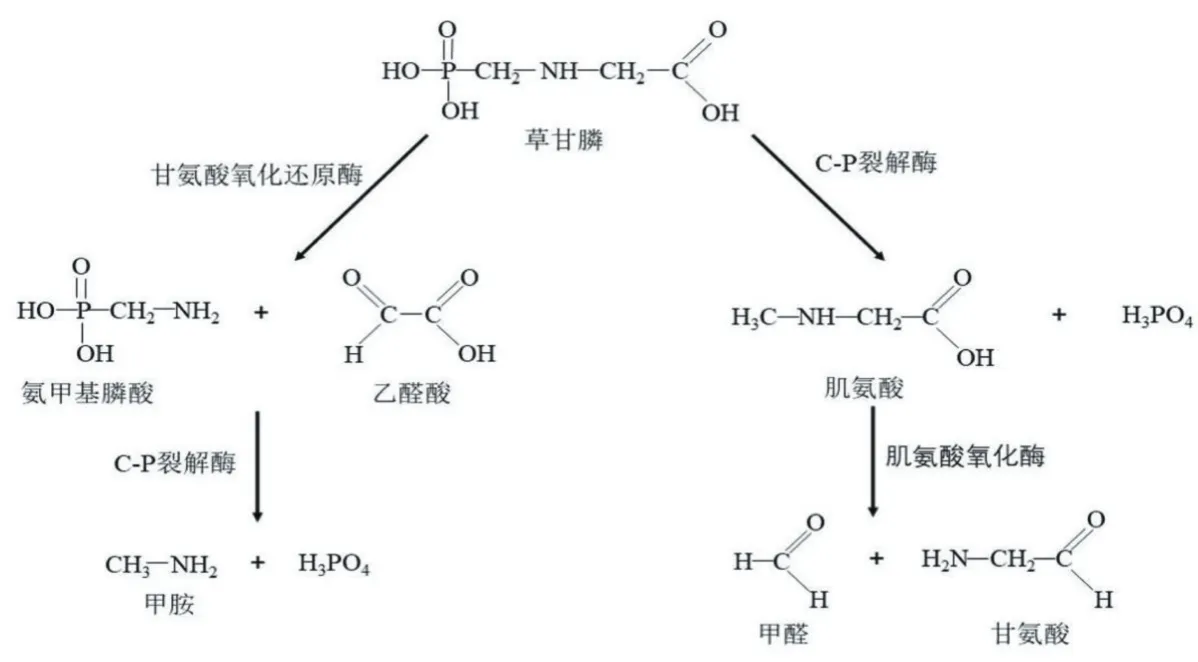
图4 CLW17草甘膦降解代谢途径的推测
2.6 甘氨酸氧化酶基因thiO的生物信息学分析
thiO蛋白质的理化性质:序列分析表明,thiO基因的开放阅读框为1101 bp,据Protparam在线软件分析,该开放阅读框共编码366个氨基酸。编码蛋白理论分子量为39.09 kDa,等电点(pI)为5.30,脂肪系数为101.26,平均疏水性为 0.096,分子式为C1756H2758N480O513S9,不稳定系数为38.43,是稳定蛋白。
thiO蛋白磷酸化、信号肽及跨膜结构域:用NetPhos 3.1 Server在线软件,对thiO蛋白进行磷酸化位点分析。结果表明,thiO蛋白有11个Ser、5个Thr、2个Tyr可能成为蛋白磷酸化位点;据SignalP 5.0 server在线软件分析,thiO蛋白具有信号肽(图5A);据TMHMM在线软件分析,该蛋白拥有一个跨膜结构域,为跨膜蛋白(图5B)。
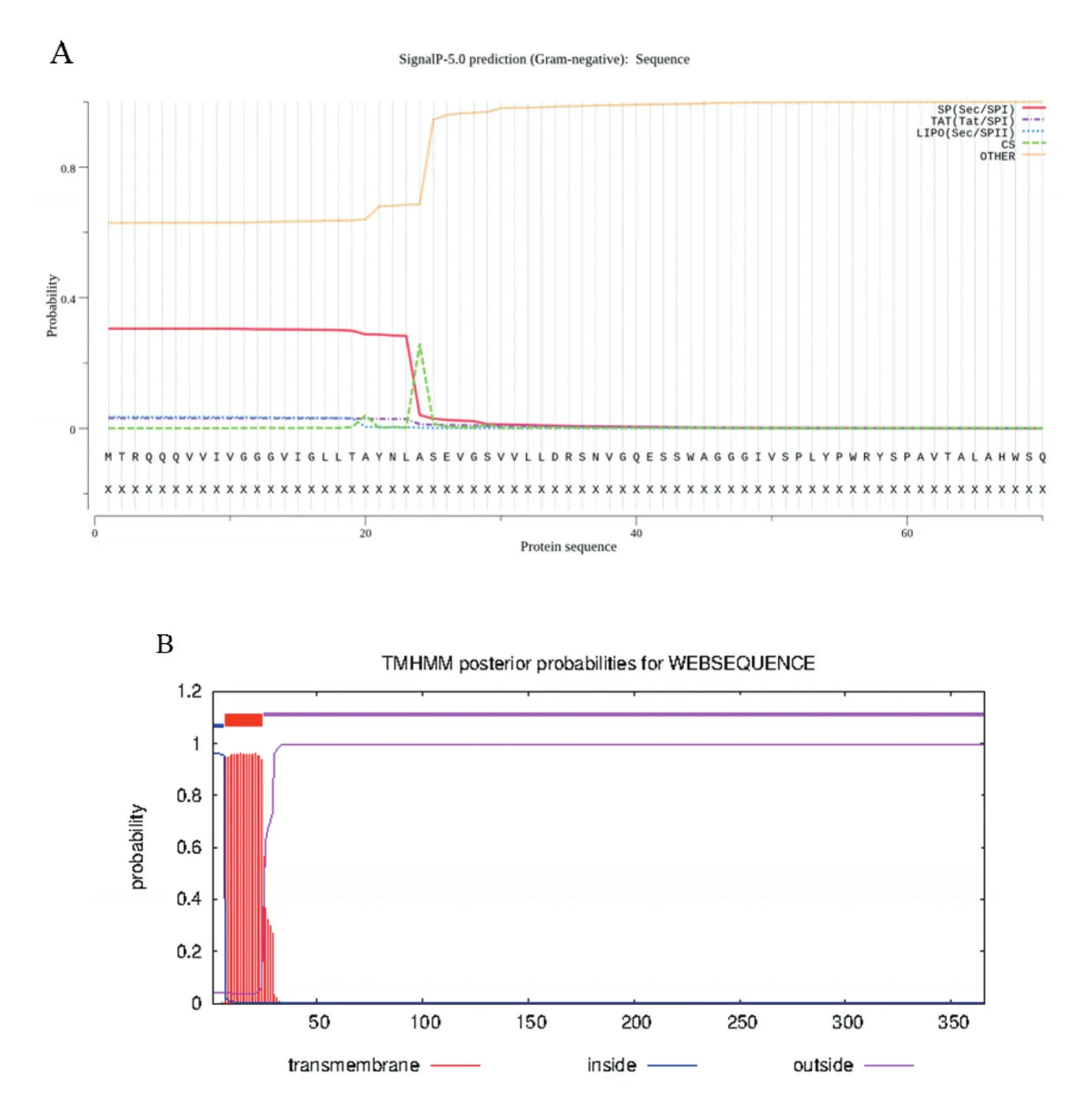
图5 thiO蛋白信号肽及跨膜结构域预测
thiO蛋白结构功能域:应用NCBI CCD数据库对thiO基因编码的氨基酸序列进行蛋白质保守结构域预测,结果显示,该蛋白质属于thiamin ThiO家族,该家族由同源四聚体组成,依赖于FAD的甘氨酸氧化酶硫代。采用SMART软件对thiO蛋白的结构功能域进行预测,在位于7~24的区域存在一个跨膜基序,该基序由大约18个氨基酸残基组成。
thiO蛋白结构分析:用SOPMA在线软件对thiO蛋白二级结构进行预测。结果显示,其主要以α-螺旋、β折叠、延伸链和无规则卷曲等为蛋白最大量的结构原件。在该氨基酸序列中,α-螺旋有125处,占总二级结构的34.15%;β折叠有42处,占总二级结构的11.48%;延伸链有66处,占总二级结构的18.02%;无规则卷曲有133处,占总二级结构的36.34%。
2.7 CLW17菌株甘氨酸氧化酶基因thiO的功能
2.7.1thiO基因敲除突变株和回补株的构建 通过同源重组技术获得thiO基因敲除突变株CLW17ΔthiO,结果如图6A所示,3、5、6、7、9泳道扩增出的条带大小约为1399 bp,明显小于阳性对照CLW17野生株的大小(2488 bp)。将3、5、6、7、9泳道的克隆送测序公司进行测序,测序结果表明thiO基因敲除突变体构建成功。
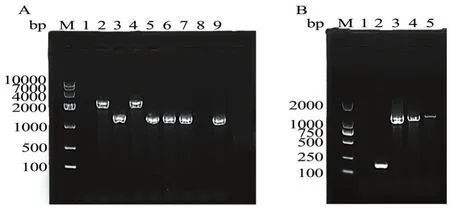
图6 CLW17ΔthiO和ΔthiO/thiO PCR鉴定
将测序验证成功的重组载体经接合转移导入到CLW17ΔthiO中,通过平板筛选后,挑取单菌落进行PCR鉴定,同时以空载体pJN105导入到CLW17ΔthiO为对照,结果如图6B所示,以ΔthiO/thiO为模板扩增出了目的片段,而以ΔthiO/pJN105为模板,没有扩增出目的片段,证明thiO基因回补株构建成功。
2.7.2thiO基因敲除株及回补株草甘膦降解率的测定采用钼锑抗比色法分别测定CLW17野生菌株、敲除株CLW17ΔthiO及回补株ΔthiO/thiO草甘膦降解率。结果显示(表7),CLW17野生株和回补株ΔthiO/thiO对草甘膦降解率分别为72.81%和54.33%,明显高于thiO基因敲除株CLW17ΔthiO(32.78%)。可以看出,CLW17菌株thiO基因敲除后该菌株的降解草甘膦能力有很大降低,但降解草甘膦能力并没有完全消失。以上结果表明,thiO基因在该菌株草甘膦降解过程中起着重要作用,结合CLW17草甘膦降解基因及其降解途径的预测,当thiO基因缺失时,推测C-P裂解酶直接参与的C-P途径在其降解过程中发挥了一定作用,也就是说该菌株存在C-N和C-P两个降解途径。

表7 不同菌株草甘膦降解率
3 结论与讨论
草甘膦在造福人类的同时,也带来了严重的环境和生态危害。随着对草甘膦农药研究的进一步深入以及对农药微生物修复技术的掌握,生物修复因低毒、低耗,使其成为了一项具有极大发展前景的技术,在草甘膦环境污染治理方面的作用也越来越突出[9]。
P.fluorescensCLW17是本团队前期分离到的一株多功能细菌,该菌株具有较强草甘膦耐受能力,能耐受浓度为0.7%的草甘膦,并且在浓度为0.4%的草甘膦培养基中生长旺盛。根据文献报道,当草甘膦浓度为0.01%时,Burkholderia vietnamiensisAQ5-12对其降解率高达92.32%[20];Bacillus subtilisBs-15草甘膦降解率为66.97%[27];Enterobacter cloacaeK7草甘膦降解率为40%[28]。本研究通过PB试验和CCD试验联用对影响CLW17菌株降解草甘膦的关键因素进行优化,在最优条件下,该菌株对草甘膦降解率为72.81%,具有较高的草甘膦降解率。全基因组数据分析表明,CLW17菌株具有草甘膦降解途径中重要酶类的编码基因,如甘氨酸氧化酶,编码C-P裂解酶的多种多肽。对草甘膦氧化酶途径中的关键基因,即甘氨酸氧化酶基因thiO进行敲除,使得菌株对草甘膦降解率下降到32.78%,明显低于野生株的72.81%,这表明thiO基因与CLW17菌株对降解草甘膦的能力密切相关,但该基因敲除后菌株对草甘膦降解能力并没有完全消失,也暗示着该菌株存在肌氨酸(C-P)途径。
总之,P.fluorescensCLW17具有草甘膦降解性能,其降解代谢途径已被推测,并从基因层面证实了该菌株具有草甘膦降解能力。后续实验有望进一步验证其他基因功能,就酶的性质,以及各酶之间的关系等方面进行深入研究,以期阐明该菌株降解草甘膦的机理。
通过本研究的数据证明,P.fluorescensCLW17是一株具有极大潜力应用价值的生物修复菌株。此次探究的结果为有机磷农药污染的治理提供了重要的理论依据,同时也为降解草甘膦微生物菌剂的研发提供了良好的实验材料。
