不同甜菜单胚细胞质雄性不育系与保持系的遗传多样性分析
2022-11-25赵雅儒马语嫣吴则东
赵雅儒,邳 植,刘 蕊,马语嫣,吴则东
(1黑龙江大学现代农业与生态环境学院,哈尔滨 150080;2黑龙江省普通高校甜菜遗传育种重点实验室/黑龙江大学,哈尔滨 150080;3黑龙江省种业技术服务中心,哈尔滨,150080)
0 引言
糖用甜菜(Beta vulgarisL.)是苋科、甜菜属植物[1],是中国重要的糖料作物之一,其糖分主要在块根中形成[2]。为了得到优质的甜菜品种,对甜菜育种的要求也较为严格,需充分利用现有的甜菜资源进行育种,为新品种的培育奠定基础[3]。ZHUZHZHALOVA等[4]的研究表明,在非生物胁迫条件下进行离体培养可培育出具有高抗性的甜菜等基因系,为甜菜在不良种植条件下依然能够良好生长提供可能。细胞质雄性不育(CMS)是许多作物杂交育种的重要特性,甜菜的杂交育种也不例外[5]。
育种工作者面临的首要任务是不断的选择性状优良的植株[6]。SSR分子标记已经在大豆[7]、玉米[8]、高粱[9]等作物中广为应用。由于SSR分子标记具有稳定性较好、多态性高的优点,且为共显性标记,所以被广泛运用于作物育种中[10-12]。对作物进行遗传多样性研究,能够为作物育种提供理论依据。孙艺琦等[13]通过SSR分子标记技术分析了蔓荆子基原植物的遗传多样性,从而为蔓荆子的种质资源提供了保护策略。徐彪等[14]以品种改良为目的,用分子标记法分析了花生的遗传多样性,以此提供分子水平上的依据。
目前,世界上除了少数国家还有多胚种外,绝大多数国家使用的甜菜品种均为单胚种,而单胚种又大多是以优良多胚授粉系为父本,二元不育系为母本杂交而成的三交种,育种家获得不同的成对单胚细胞质雄性不育系和保持系的数量直接决定了育种家能够得到二元不育系的数量。本研究所用到的40对甜菜单胚细胞质雄性不育系和保持系大多是通过多胚保持系改良而成的,为了得到更多的二元不育系,首先需要更多的遗传基础不同的纯合不育系和保持系。为达到这一目标,本试验对课题组现有的40对甜菜单胚细胞质雄性不育系和保持系利用SSR分子标记技术进行分析,了解40对供试材料的遗传多样性,分析不育系与保持系的纯度,观察遗传距离较大的不育系和保持系的对数,以便今后继续进行回交育种,确定纯合度较高的不育系与保持系,为今后配制二元不育系奠定基础。
1 材料与方法
1.1 试验材料
试验所用的材料为黑龙江大学甜菜改良团队的40对甜菜单胚细胞质雄性不育系与保持系,试验母根于2021年4月种植于黑龙江省哈尔滨市呼兰区甜菜研究所试验基地内。在种植区域内,除种植材料不同以外,其余条件基本相同。供试材料序号及名称见表1,其中HD-CMS1和HD-O1、HD-CMS2和HD-O2为成对的甜菜单胚细胞质雄性不育系和保持系,以此类推。
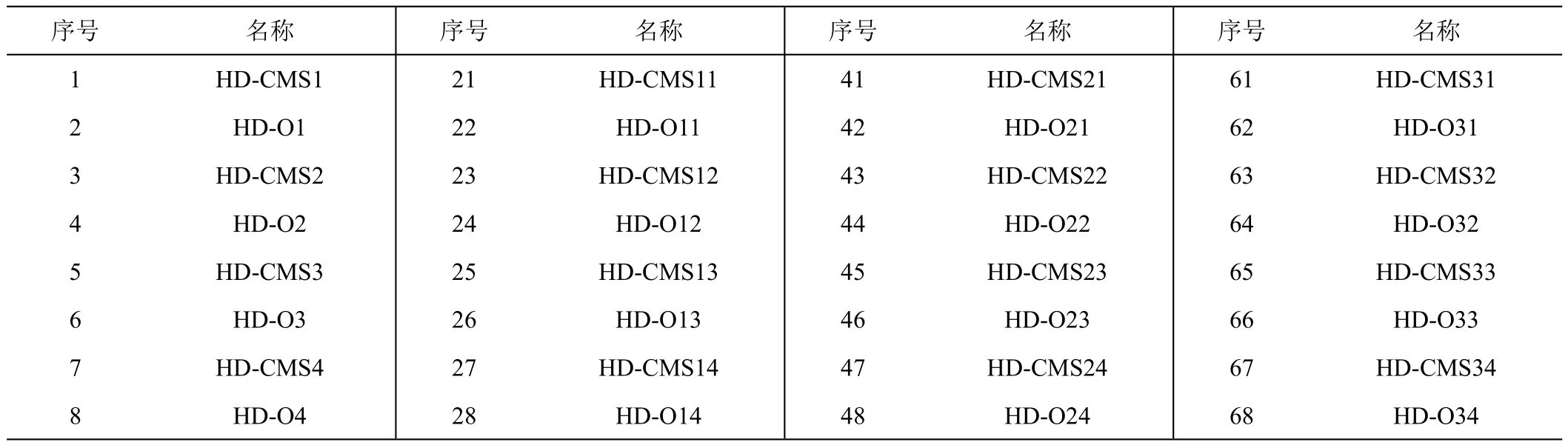
表1 80份供试材料序号及名称

续表1
1.2 DNA提取
利用CTAB法提取甜菜基因组DNA,用NanoDrop 2000紫外分光光度计测定DNA的纯度和浓度,纯度的判定以OD260/OD280的值在1.8~2.0之间为标准。将测定纯度合格的DNA的浓度稀释至10 ng/μL备用。
1.3 SSR引物筛选
筛选出条带较清晰的SSR引物。引物序列来自黑龙江大学甜菜遗传育种重点实验室及参考文献[15]。SSR引物由上海生工生物工程股份有限公司合成。
1.4 PCR扩增
PCR反应体系为:总体系为5 μL,其中2.5 μL的2×PCR Master Mix,正反向 Primer(10 μmol/L)各0.2 μL,1 μL DNA模板(10 ng/μL),最后加去离子水至5 μL。
PCR反应程序为:(1)94℃预变性3 min;95℃变性15 s,退火15 s,72℃延伸15 s,35个循环;72℃终延伸5 min。(2)Touch down反应程序参考邳植等[16]的研究方法进行。其中,根据引物筛选,不同引物所需要的退火温度不同,见表2。

表2 SSR引物多态性分析及退火温度

续表2
1.5 电泳
采用8%的非变性聚丙烯酰胺凝胶电泳,在180 V条件下电泳90 min,之后用红色荧光核酸染料浸染凝胶,用凝胶成像仪观察条带并拍照保存。
1.6 数据处理与分析
采用人工读带,在同一迁移率位置上,有条带的记为1,无条带的记为0[17];利用Popgene软件分析有效等位基因数(Ne)、Shannon’s信息指数(I)和Nei’s基因多样性指数(H),通过MEGA 7软件利用类平均法(UPGMA)构建聚类分析图并计算供试材料之间的遗传距离[18-20]。
2 结果与分析
2.1 SSR引物多态性分析
通过筛选,共得到35对条带清晰、多态性较高的SSR引物。每对SSR引物在80份供试材料中扩增得到的条带数在2~12之间,平均每对引物扩增条带数为5.257;Ne在1.265~4.010之间;I的最大值为1.481,最小为0.364;H最大值为0.751,最小值为0.209。Ne、I、H的平均值分别为2.306、0.891和0.519。
2.2 聚类分析
通过MEGA软件得到聚类分析图,见图1。结果表明,除品系22的遗传距离与其他材料之间的遗传距离较大,单独为一类群;其他供试材料可分为4个类群,类群Ⅰ中共分为4个亚类群,其中,有9对原配组甜菜单胚细胞质雄性不育系与保持系聚合在一起;类群Ⅱ中共包含6份不同的细胞质雄性不育系和保持系;类群Ⅲ中包含3个亚类群,其中有2对原配组单胚细胞质雄性不育系与保持系聚合在一起,分别为品系53和54、73和74。类群Ⅳ可分为4个亚类群,有3对原配组单胚细胞质雄性不育系与保持系聚合在一起。

图1 40对甜菜单胚细胞质雄性不育系与保持系聚类分析图
2.3 遗传距离分析
利用MEGA 7软件计算80份供试材料的遗传距离在0.120~0.462之间,其中品系59和61、63和74,即HD-CMS31和HD-CMS30、HD-CMS32和HD-O37的遗传距离最远,为0.462;品系29和30,即HD-CMS15和HD-O15的遗传距离最近,为0.120。
共计14对成对的甜菜单胚细胞质雄性不育系和保持系聚合在一起,这14份不同的甜菜单胚细胞质雄性不育系之间的遗传距离有所不同,其中品系11与品系27的遗传距离为0.304;品系27与品系29、31、35、37之间的遗传距离分别为0.288、0.337、0.304和0.321;品系31与品系35、47、53之间的遗传距离分别为0.304、0.359和0.359;品系61、65与品系53之间的遗传距离分别为0.408和0.348;品系67、69与品系61之间的遗传距离分别为0.402和0.370;品系73与67的遗传距离为0.364;品系73与品系77的遗传距离为0.386。这些遗传距离较大的不育系与其异型保持系可以配制不同的二元不育系。
3 结论与讨论
3.1 结论
本试验所用的甜菜单胚细胞质雄性不育系与保持系材料,大多是多胚不育系与保持系改良而来,用SSR引物分析供试样本的遗传多样性并采用UPGMA法进行聚类分析。试验结果表明,35对SSR引物的多态性良好;通过遗传多样性分析,80份甜菜单胚细胞质雄性不育系与保持系的遗传距离在0.120~0.462之间。聚类结果显示,除品系22与其他材料的遗传距离较大外,其余79份供试材料可分为4大类群;共有14对原配组细胞质雄性不育系与保持系聚合在一起,说明这14对不育系和保持系之间细胞核基因组的差异极小,可以直接用于今后的育种。还有26对未聚合在一起的不育系与保持系遗传距离大,细胞核之间还存在着较大的差异,需要继续进行回交和自交至纯合。
3.2 讨论
目前中国现有的甜菜种质资源较少,由于甜菜的遗传基础较窄,培育出新的甜菜品种较为困难。随着分子标记技术的发展,分子标记技术也越来越受到认可,其可靠性及高效性加快了分子育种的研究进程,同时在分子层面上揭示了样本的亲缘关系和遗传距离等,因此利用分子标记技术分析作物遗传多样性的应用越来越广泛[21-23]。遗传多样性的研究对选择具有更优组合能力的亲本非常重要,可以增加杂交后获得优良基因型的机会,通过了解群体间和群体内的亲缘关系,能够更高效的选择杂交组合方式,为育种提供进一步的理论依据[24-25]。由于甜菜是无限花序作物,在之前的田间种植过程中,可能因为扣罩不及时或植株间发生混杂等原因导致同对不育系与保持系之间不纯合。本实验对课题组现有的甜菜单胚细胞质雄性不育系与保持系进行遗传多样性分析,以观察同对不育系与保持系之间细胞核的一致性程度,明确它们的遗传距离。在今后种植时,可将聚合在一起的14对原配组之间遗传距离大的不育系和其异型保持系作为配制二元不育系的亲本,用于杂交育种的研究。未聚合的26对原配组不育系与保持系之间继续进行回交与自交,以达到细胞核同核的目的,并在今后再次进行检测。通过遗传多样性分析,加大了培育出甜菜新品种的可能性,同时可以减少育种工作中的盲目性,有效的提高了甜菜育种效率,奠定了配制二元不育系的基础。
