水稻白叶枯病抗性基因和相关因子研究利用进展
2022-11-25杨雅云戴陆园张斐斐阿新祥汤翠凤
李 舟,杨雅云,戴陆园,张斐斐,阿新祥,董 超,王 斌,汤翠凤
(1云南大学资源植物研究院,昆明 650504;2云南省农业科学院生物技术与种质资源研究所,云南省农业生物技术重点实验室,农业部西南作物基因资源与种质创制重点实验室,农业部云南稻种资源科学观测实验站,昆明 650223)
0 引言
水稻是世界上最重要的粮食作物,由Xanthomonas oryzaepv.Oryzae,Xoo引起的水稻白叶枯病,严重制约稻谷产量[1]。水稻生产上广泛使用化学药剂防治该病害,但长期实践表明发掘抗病新基因、培育抗病品种是解决这一问题的最经济和有效的途径。然而,近年鲜有研究对经国际鉴定报道的抗病新基因进行概述归纳与总结,抗病基因作用机制并不清晰,也并未有文章报道白叶枯病抗病相关因子的研究进展。因此本文基于Xoo侵染、抗病机制研究,对近年来水稻抗白叶枯病基因的定位克隆、功能类型以及抗病相关因子的研究进展做了简要综述,以期为现阶段抗白叶枯病基因的发掘利用和抗病机制深入研究提供参考。
1 Xoo致病机制与水稻抗病机制概述
白叶枯病菌通常从水稻自然开口处进入叶片组织,在细胞间隙繁殖,并通过木质部容器传播到其他部分[2-3]。白叶枯病原菌通常会利用II型或III型分泌系统在植物体内更好的生长繁殖。其中,II型分泌系统能分泌多种碳水化合物降解酶削弱细胞壁,使Xoo更容易获取营养[4-5];III型分泌系统分泌效应蛋白转录激活物样TAL和非TAL效应蛋白劫持寄主代谢以促进其生长发育[6-7]。同时,Xoo还能产生群体感应信号分子检测局部种群密度以调节自身基因表达模式并分泌胞外多糖,阻塞木质部增强致病性[8-9]。
而水稻植株受到Xoo侵入后,基础免疫PTI与效应触发免疫ETI防御机制被触发[10-11]。PTI和ETI由受体激酶蛋白、重复序列蛋白以及其他抗病因子介导。PTI包括活性氧(ROS)的产生、细胞内钙浓度的增加、细胞壁胼胝质沉积、抗菌化合物以及丝裂原活化蛋白激酶(MAPK)的激活等[12];ETI是定性抗性[13],大部分由主效抗病基因调控,对病原菌某个或少数生理小种免疫或高抗,主要在细胞内发挥作用,这些抗性蛋白能够直接或间接识别病原体在宿主细胞内分泌的特定毒力效应子,反应出了快速且更强的抗病性,它们通常与感染部位的程序性细胞死亡有关,还涉及其他防御反应包括ROS的产生、细胞壁的增强、有毒代谢物或蛋白质的积累以及激素水平的改变[14]。在植物抗病这一过程中,抗病基因与抗病相关因子参与植物PTI与ETI反应,通过编码抗性蛋白、改变植物通路信号、改变细胞形态与结构等多种方式,调控植物抗病反应,最终使植物抵御白叶枯病或减轻植物感病症状等。
2 水稻抗白叶枯病基因的定位与克隆
2.1 水稻抗白叶枯病基因的定位现状
在水稻抵御白叶枯病过程中,抗白叶枯病基因普遍参与植物PTI或ETI反应,由于宿主植物遗传多样性与抗病基因紧密关联,不同的水稻品种或群体会出现不同的感染症状[15]。迄今利用各种方法定位出的抗白叶枯病的主效基因经过国际确认和文献报道的至少有48个(见表1),其中31个为显性基因Xa,17个为隐性基因xa,且发现的大量抗白叶枯病基因在第4号和第11号染色体上成簇分布,而第9和第10染色体上则暂未有抗白叶枯病基因被定位。对抗白叶枯病基因进行定位,促进了基因的进一步克隆及在水稻抗病育种中的利用。
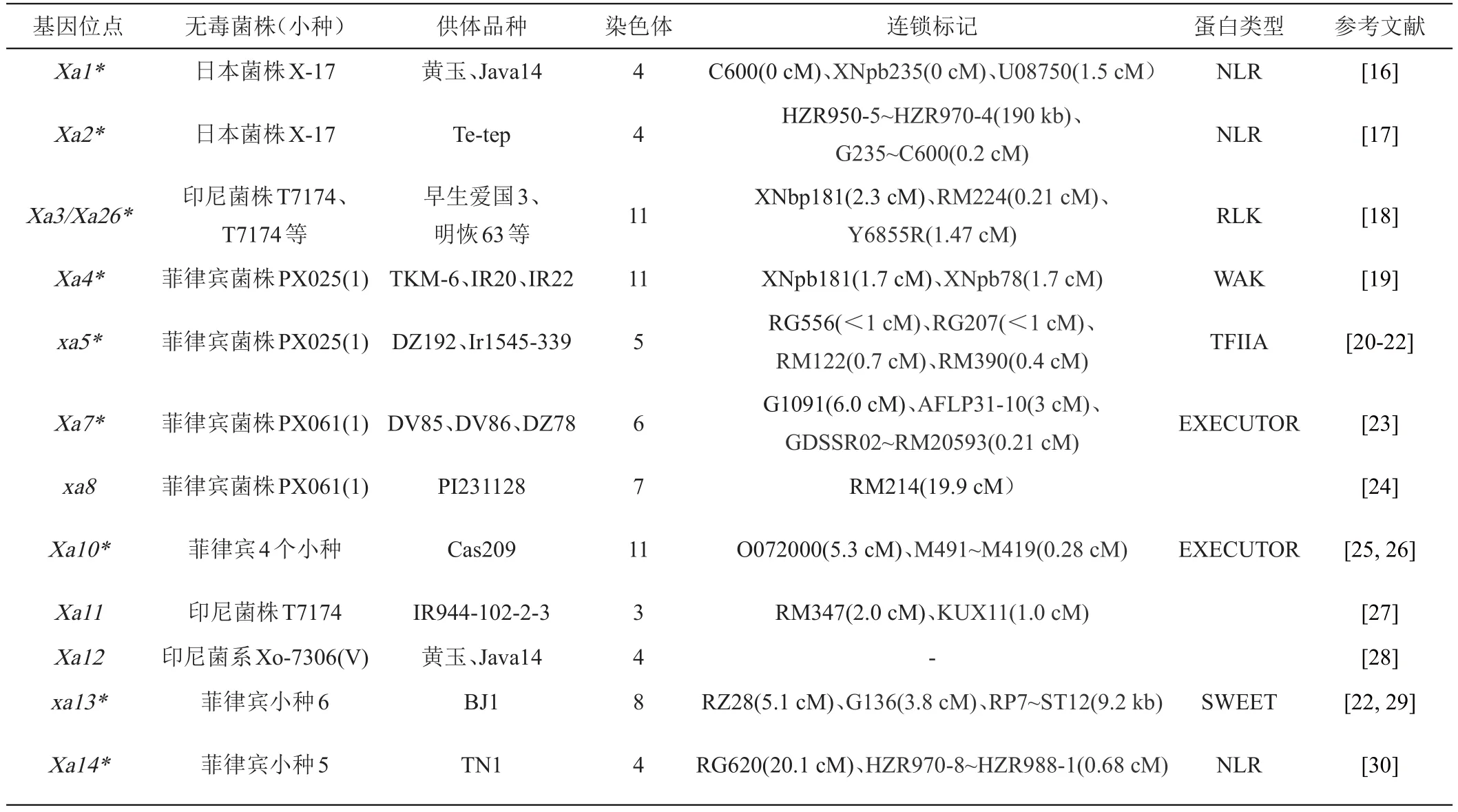
表1 水稻抗白叶枯病基因的定位、连锁标记、蛋白类型(*代表已克隆基因)
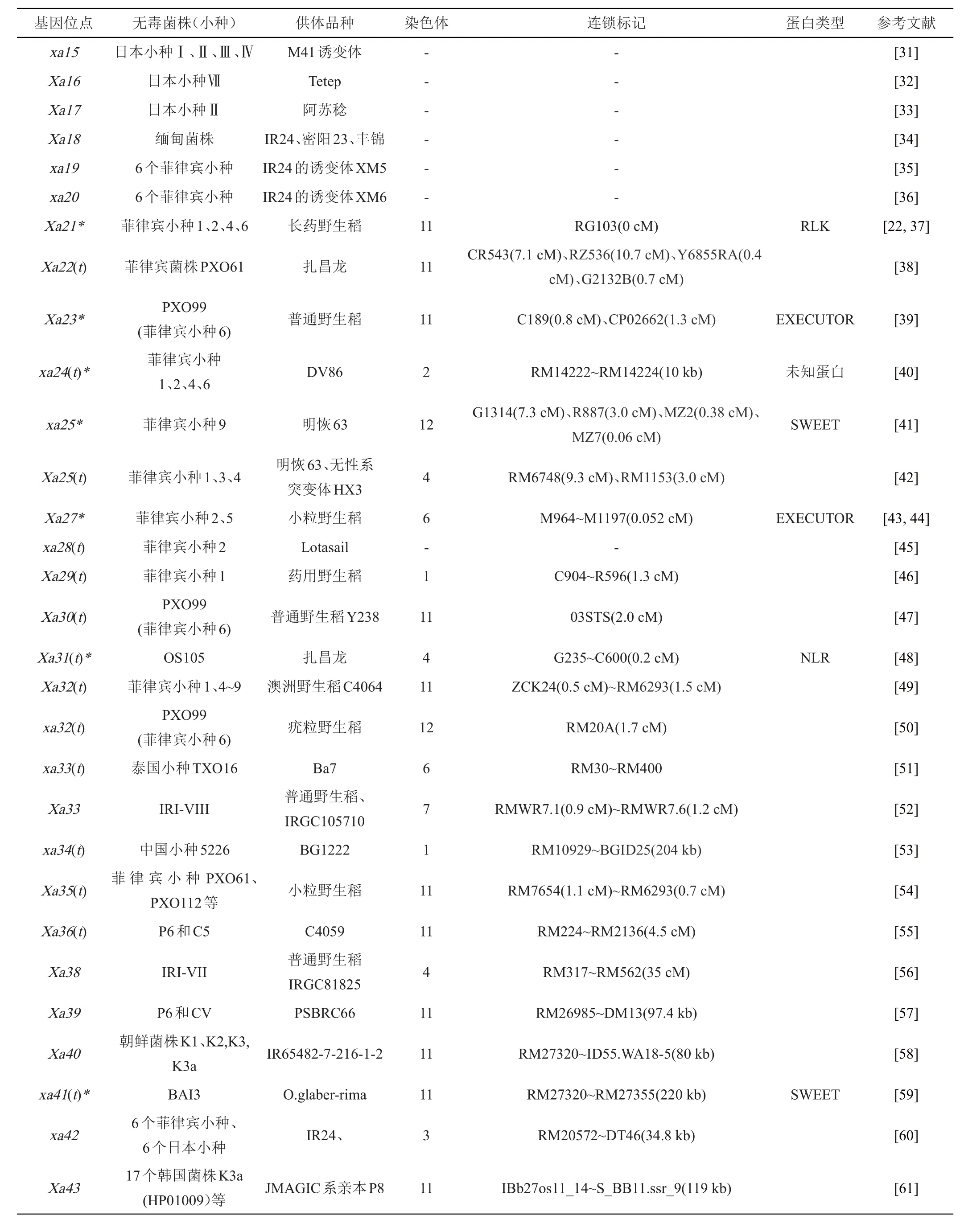
续表1
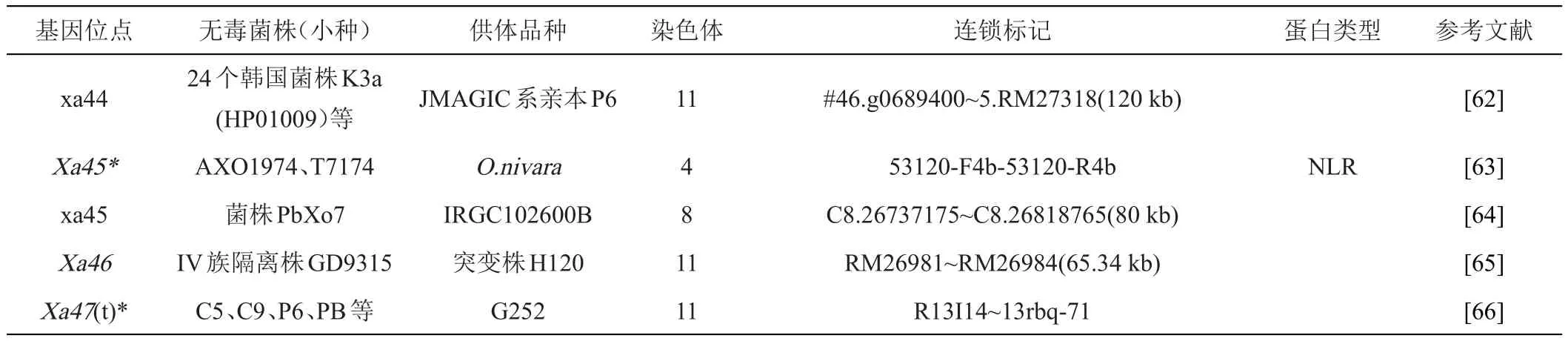
续表1
2.2 水稻抗白叶枯病基因的克隆
目前已被克隆的水稻抗白叶枯病主效基因有18个,其中Xa1、Xa3/Xa26、xa5、Xa21等基因的克隆研究情况已被何翔等[67]、李定琴等[68]介绍,故下面仅对2017年以来克隆的7个抗白叶枯病主效基因作简要介绍。
Xa10从水稻品种Cas209中发现并定位于第11号染色体[26],TIAN等[25]将其分离并发现编码了126个含氨基酸蛋白,通过诱导消耗内质网上的Ca2+,诱导细胞程序性死亡,抵御病菌侵入;SUN等[19]将Xa4定位于第11号染色体47 kb区段上,HU等[59]在精细定位的基础上将Xa4分离克隆并发现编码细胞壁相关激酶(WAK),能增强细胞壁进而增强了对Xoo的抵抗力,同时发现该基因增强水稻抗倒伏性,在实际生产当中被广泛应用[69];ZHANG等[48,70-71]过同源克隆和图位克隆的方法分离克隆了Xa2、Xa14和Xa31(t),发现Xa31(t)与Xa2是相同的基因,且发现Xa1,Xa2和Xa14之间的相互作用使得水稻表现出不同的抗病性,且至少存在一个由Xa1,Xa2和Xa14所组成的独特基因座赋予了水稻抗病性。同期,JI等[63]克隆了Xa2,Xa31(t),Xa14,CGS-Xo111和Xa45(t),通过序列分析发现这些基因及其预测的蛋白质高度保守,形成一组Xa1等位基因,与ZHANG等[69]研究结果一致;Xa7由COHEN等[72]定位在水稻第6号染色体51 kb的区段上,梅乐[73]在此基础上通过构建BAC文库,比对水稻品种间的序列同源性,筛选出易感突变体,通过映射区域比对,将Xa7锚定在28 kb的区域中最终分离克隆;xa41(t)是HUTIN等[59]在OsSWEET14的启动子中筛选并分离克隆,启动子缺失的18 bp与其他几个已知激活OsSWEET14基因的TAL效应子靶向的结合位点重叠,进而产生了对白叶枯病的抗性。
2.3 抗白叶枯病基因的功能类型
水稻抗白叶枯病基因编码蛋白结构分为五类,即编码受体激酶蛋白RLK的抗性基因,编码NLR蛋白的抗性基因、编码糖转运蛋白SWEET基因、执行基因和其他类型的基因。
受体激酶蛋白RLK是一类植物细胞膜表面的模式识别受体,是植物先天免疫系统的关键组成部分[74]。通常包含胞外结构域、单程跨膜结构域和胞内激酶结构域[69]。Xa21编码的跨膜富亮氨酸重复序列LRR结构域能识别Xoo中的RaxX蛋白进而激发免疫反应[37]。Xa3/Xa26编码蛋白的胞外的结构域由26个不完全的LRR组成,研究推测该基因编码的LRR能够识别Xoo中的特异蛋白而激发免疫反应[18,75]。Xa4[76]编码由707个氨基酸组成的细胞壁相关激酶WAK,能将细胞壁与质膜连接起来,并把细胞外信号传递到细胞质,促进纤维素合成并抑制细胞壁松弛来增强细胞壁结构,进而增强了对Xoo的抵抗力[77]。
NLR蛋白是含有核苷酸结合结构域和富含亮氨酸重复序列的抗病蛋白,通常能识别病原菌的特定效应蛋白TAL来触发小种特异性免疫反应。Xa1[16]编码的NLR蛋白通过识别包括PthXo1、Tal4和Tal9d在内的几种TAL效应子来赋予对Xoo的抗性[78]。近期被克隆的4个Xa1的等位基因Xa2、Xa14、Xa31(t)和Xa45,均编码禾本科特有的NLR蛋白,这些基因互相协同作用,组成的独特基因座能激发水稻对Xoo的抗性[63,69]。
SWEET家族蛋白是一类独特的糖转运蛋白,通过SWEET蛋白输出到细胞质外体的糖会被病原体的TAL效应子劫持[79]。研究发现Xoo中的一种TAL效应器PthXo1直接靶向显性基因Xa13效应子结合元件EBE,以诱导病原菌的表达,同时还能利用OsSWEET11蛋白协同其他铜转运蛋白去除水稻木质部导管中的铜[80],而xa13[29]编码的SWEET蛋白不受Xoo诱导,木质部导管中的铜抑制了Xoo的生长,进而表现出抗病性。隐性基因xa25[41]编码蛋白OsSWEET13相关抗病机理暂不明确。xa41(t)编码蛋白对Xoo中两种TAL效应器AvrXa7和Tal5的识别位点发生了缺失突变,进而产生抗性[59]。
执行基因Executor是一类重要的抗白叶枯病基因,具有多个潜在的跨膜结构域作为启动子陷阱,能被TAL效应子转录激活并触发防御反应。Xa27能被携带AvrXa27效应器的Xoo特异性诱导,使水稻维管束细胞次生细胞壁变厚,抵御白叶枯病[44]。Xa23启动子区域含有结合位点UPT[81],因而拥有更广的抗谱。Xa10[25-26]通过直接结合Xa10的启动子特异性诱导AvrXa10表达。Xa7启动子中存在效应子结合元件EBE能被AvrXa7或PthXo3诱导,进而激发Xa7产生免疫反应[72]。
TFIIAγ是一种特殊的转录因子能直接影响聚合酶的转录[82]。抗白叶枯病基因xa5编码突变的转录因子TFIIAγ5V39E,相比与TFIIAγ5/Xa5,xa5编码的蛋白仅含有一处氨基酸突变[20],xa5编码的TFIIAγ5V39E阻碍了TFIIAγ5与TAL的结合,从而影响了白叶枯菌的侵染[83]。
3 水稻抗白叶枯病相关因子的研究
在植物抗病过程中,抗病基因发挥了关键性作用,同时大量抗病相关因子也参与抗病过程,这类因子正向或负向调控抗病反应,或者间接调控抗病基因,但因其调控的抗性水平相对较低,通常需要使用超量表达或者抑制表达的方法研究抗病相关因子[84]。对抗病相关因子的研究与利用,有助于更深入理解水稻抗病机制,增强水稻对白叶枯病的抗性并拓宽其抗谱。目前,水稻中编码抗病相关因子的基因约有900个,其中至少30个基因编码抗病因子从而影响Xoo的侵染[85],下面仅列举几种常见的类型。
3.1 植物激素类抗病因子
生长素是一种重要的植物激素,也是植物抗病机制中的关键因子。吲哚-3-乙酸IAA是生长素的一种主要形式,外源施用IAA会增加水稻白叶枯病斑的面积[86]。植物GH3基因家族成员编码的GH3蛋白能将IAA与氨基酸连接,从而使IAA失活。超量表达水稻OsGH3-2或OsGH3-8后,水稻体内游离生长素的含量下降,但是对白叶枯病产生了广谱抗性[87-88]。
水杨酸通常在植物被Xoo侵染后合成,侵染的部分迅速合成水杨酸,使被侵染部分发生超敏反应,随后通过维管束组织向其他的未被侵染的部分运输,逐渐使整个植株获得抗性。NPR1是拟南芥中一个重要基因,通过超量表达该基因在水稻中的同源基因NH1后,激活了水稻的防御反应,抑制白叶枯病菌的生长,推测该基因能够直接结合水杨酸以单体的形式进入细胞核,并与相关的TGA转录因子互作[89]。
茉莉酸作为植物抗病反应的重要信号分子,能激活与植物抗病反应相关的防御保护机制,诱导植物产生对多种病害的系统获得抗性[90]。KE[91]等发现水稻基因OsPAD4编码一种质膜蛋白,能与植物体内游离的茉莉酸结合,增强水稻对Xoo的抗性。研究发现水杨酸信号通过诱导多种OsPIPs基因的表达,抑制白叶枯病菌侵染,提高水稻抗病性。
3.2 WRKY类转录因子编码基因
WRKY转录因子是调节基因转录的蛋白质分子,广泛参与植物各种生理过程。目前从水稻基因组中克隆和鉴定出WRKY基因至少有109个[92],根据功能类型分为:响应生物胁迫类、响应非生物胁迫类、参与植物激素信号转导类、参与植物的生长发育类。其中一部分响应生物胁迫类WRKY基因能通过多种方式调节植物对Xoo的免疫反应[93],例如OsWRKY13[94]能影响类植物抗毒素——黄酮素的合成,超量表达该基因后发现对白叶枯病的抗性有所增强;WRKY30的超量表达增强了水稻对白叶枯病的抗性,并且该基因的转录物在受到水杨酸和茉莉酸的影响下迅速积累,推测该基因可能还与植物激素类抗病因子有协同关系[95];WRKY45-1和WRKY45-2介导不同的防御信号传导途径,他们编码的蛋白在抗病过程中发挥了相反的作用。OsWRKY45-1过表达的植株显示出对白叶枯病的抗性随着水杨酸和茉莉酸的积累增加增强,而WRKY45-2则与之相反[96];WRKY6[97]正向调控水稻防御相关基因OsPR10a,通过直接与OsICS1启动子结合,激活SA介导的调控通路,从而增强防御反应;WRKY62[98]负调控抗白叶枯病主效基因Xa21介导的抗性,水稻在白叶枯病菌感染后对防御相关基因的激活受到抑制。
3.3 sRNAs类抗病因子
sRNAs是一类长度在21~24 nt的非编码小分子,参与基因转录后的表达调控,作用机制复杂。在植物体中,sRNAs对植物的生长发育、激素转导、适应生物与非生物胁迫等生物进程具有重要作用,同时也参与调控植物的免疫反应。抗白叶枯病相关的OsmiR1858a,其靶基因为OsHIN1,编码一类特殊的sRNA,对该基因进行超量表达发现对Xoo表现出更强的抗性[99]。另外研究发现,植物除了可以利用RNA结合蛋白这一机制来调节自身免疫,还可以利用sRNA与蛋白互相作用来调节自身免疫,例如Bsr-k1基因能编码一种TPR域蛋白,该蛋白通过与植物体内的miRNA相互作用,进而增强对Xoo的抗性[100]。
4 抗白叶枯病基因利用设想与展望
4.1 抗病新基因的发掘
目前已被发掘的抗白叶枯病基因约有1/3被定位于水稻第11号染色体上,如Xa4、Xa10、Xa21[19,26,38]等。因此,可以推断水稻第11号染色体上应该还有很多新的抗白叶枯病基因,而基于高通量测序的信息解析技术以及基因编辑技术有望对第11号染色体上的基因进行挖掘和功能验证,系统的解析抗病新基因。本实验室在前期的研究中发现一个来自云南耿马县的地方稻种毫糯扬中携带有新的抗白叶枯病基因Xa48(t),该基因定位在第11号染色体长臂端的0.12 Mb区段内,挖掘该基因将为解析水稻抗病机制提供新的线索。
4.2 抗病新基因的克隆与利用
迄今,被克隆的抗白叶枯病基因有17个,仅占被报道抗病基因的1/3,仍有大量抗病基因未被克隆利用,有些被确定的抗病基因由于定位区间过大、候选基因复杂而难以被克隆。就现阶段而言,可以利用多方法组合克隆目标基因,例如将图位克隆与突变体筛选相结合克隆出了Xa7。而今后基于高通量测序的克隆技术有望对曾被出定位的基因进行更精细定位以及克隆,甚至对易感基因片段进行基因编辑与功能验证,进而探究基因、蛋白的互作机理,加速水稻的抗病育种研究进程。
4.3 抗病基因与抗病相关因子的协同利用
目前发掘的抗白叶枯病相关因子30余个,不同家族之间的抗病因子互相影响,使水稻具有特异性或广谱性的抗性。例如部分WRKY基因能调控水稻的PR基因,进而激活植物激素或者其他抗病因子[96],多种抗病因子相互协同,编码丰富的抗病产物,激发植物免疫反应。此外,抗病相关因子还受到主效抗病基因的影响,共同抵御Xoo的侵染,例如抗病基因Xa21编码的XA21能与一个WRKY转录因子OsWRKY62结合,负向调控水稻抗病性[101];此外,XA21还能与类生长素蛋白XB21互作,提高对Xoo的抗性[102]。但由于抗病相关因子数量多且功能复杂,编码抗病相关因子的基因并未全部发掘与定位,今后有望利用多组学手段对编码抗病因子的基因进行克隆鉴定,对抗病相关因子进行分类整理,与其他植物抗病相关基因进行横向比较,研究其同源基因在其他植物上的功能特征,以期在植物大背景下深入研究对抗病相关因子与抗病基因的相互作用,通过抗病基因与抗病因子的综合利用,选育出更持久广谱的抗性品种。
