丙硫菌唑对水稻纹枯病菌的生物活性研究
2022-11-24汪章勋张立新檀根甲
张 森,檀 立,汪章勋,张立新,李 淼,檀根甲
丙硫菌唑对水稻纹枯病菌的生物活性研究
张 森,檀 立,汪章勋,张立新,李 淼,檀根甲*
(安徽农业大学植物保护学院,合肥 230036)
丙硫菌唑是目前广泛应用的三唑类广谱杀菌剂。为了明确其对水稻纹枯病菌的生物活性,采用生物测定的方法研究了丙硫菌唑对水稻纹枯病菌的抑菌活性,应用生理生化和分子生物学方法研究了丙硫菌唑对水稻纹枯病菌的可溶性蛋白合成、麦角甾醇合成、 DNA 合成、菌丝脂质过氧化程度、菌丝细胞膜通透性以及水稻防御酶活性的影响。通过田间药效试验研究了其防治纹枯病效果及对水稻的安全性。结果表明,丙硫菌唑对94株水稻纹枯病菌有较高的抑菌活性,平均EC50值为(1.062 9 ± 0.795 9)mg·L-1。没有出现敏感性下降的抗药性群体,可以釆用菌株的平均EC50值作为水稻纹枯病菌对丙硫菌唑的敏感性基线。丙硫菌唑导致病菌麦角甾醇含量降低,菌丝细胞渗透压、菌丝脂质过氧化程度升高,DNA含量和可溶性蛋白含量随降低。丙硫菌唑使POD、CAT、SOD和PAL 4个植物基础防御酶活性升高,具有一定诱导抗病性。田间试验结果显示4.8×105mg·L-1丙硫菌唑悬浮剂,每亩施用剂量为25、30和35 mL时,对水稻纹枯病的防治效果分别达90.40%、96.29%和98.17%,与对照试剂噻呋酰胺的防效相当,且对水稻生长安全。
丙硫菌唑;水稻纹枯病;生物活性;作用机制
由立枯丝核菌()引起的水稻纹枯病在我国发生严重,在缺少高抗纹枯病水稻品种时,农业防治效果不明显,而生物防治速效性低,易受环境因素影响。目前防治水稻纹枯病主要依赖于化学药剂,但井冈霉素、噻呋酰胺等药剂的使用会导致纹枯病菌产生抗药性[1-2]。因此,从环境、食品安全的角度来看,探寻新的替代杀菌剂防治纹枯病将是今后的发展方向。丙硫菌唑(Prothioneazole)是由美国拜耳公司研发,并于2004 年在美国上市的三唑类广谱杀菌剂,该类杀菌剂杀菌活性高,作用范围广,与环境相容性好,是目前广泛应用的一类杀菌剂[3]。丙硫菌唑对小麦和玉米等禾本科作物常见病害均有较好的防治效果[4-5],但对水稻纹枯病菌的作用效果和作用机理尚鲜见系统研究。蛋白质是水稻纹枯病菌的组成成分之一,若蛋白质合成受到抑制,则可能影响能量代谢的某一部分,从而抑制菌丝的生长。丙二醛是纹枯病菌菌丝脂质过氧化产物,丙二醛含量增加会导致病原菌菌丝脂质过氧化,破坏病原菌菌体稳定性。DNA 是水稻纹枯病菌的遗传物质,若DNA 含量减少,则削弱了病菌繁衍能力,降低了水稻纹枯病菌的数量,从而遏止了水稻纹枯病的发展。
纹枯病菌菌丝的电解质相对外渗率反映出菌丝细胞膜的通透性,从而验证丙硫菌唑对菌丝细胞膜的影响。麦角甾醇是真菌细胞膜的重要组成部分,能够维持细胞膜的流动性、生物调控和三维结构。构成真菌细胞膜的甾醇是C-4去甲基麦角甾醇。病菌合成麦角甾醇的能力受到抑制,可导致真菌细胞的破裂和死亡。为了明确其对水稻纹枯病菌的生物活性,采用生物测定的方法研究了丙硫菌唑对水稻纹枯病菌的抑菌活性,通过田间药效试验研究了其防治纹枯病效果及对水稻的安全性;应用生理生化和分子生物学方法研究了丙硫菌唑对水稻纹枯病菌的可溶性蛋白合成、麦角甾醇合成、 DNA 合成、菌丝脂质过氧化程度、菌丝细胞膜通透性以及水稻防御酶活性的影响。研究旨在明确丙硫菌唑对水稻纹枯病菌的作用机制,为水稻安全绿色生产和科学使用化学农药提供依据。
1 材料与方法
1.1 供试水稻品种
徽两优996号,武运粳31,安徽春泽种业有限公司提供。
1.2 供试菌株
94株水稻纹枯病菌(),由安徽农业大学植物保护学院植物病理实验室提供,是从安徽省15个县市采集回来的病样分离鉴定所得。
1.3 供试杀菌剂
98%丙硫菌唑原药(用于室内毒力测定),安徽久易农业股份有限公司;4.8×105mg·L-1丙硫菌唑悬浮剂(用于田间药效试验),安徽久易农业股份有限公司;43%井岗霉素粗粉,上海农乐生物制品股份有限公司;2.4×105mg·L-1噻呋酰胺悬浮液,日本日产化学工业株式会社。
1.4 丙硫菌唑对水稻纹枯病菌株的敏感性测定
称取丙硫菌唑原药0.02 g,先用8 mL无水乙醇溶解,然后用蒸馏水定容到50 mL,配制成浓度为400 mg·L-1的母液。然后再用蒸馏水配制成不同浓度的的丙硫菌唑溶液备用。采用菌丝生长速率法测定水稻纹枯病菌的毒力[6]。在无菌条件下,将配制好的浓度为5、10、20、40和80 mg·L-1的丙硫菌唑溶液各5 mL,分别加入到 45 mL PDA培养基中,混匀后分别倒3个平板。将平板培养3 d的纹枯病菌用无菌的5 mm的打孔器制成菌饼,接种于培养皿中央,放置于28 ℃恒温培养箱中倒置培养2 d。设置3次重复,以无菌水作为对照。2 d后用十字交叉法测量菌落的直径大小,对菌丝形态显微镜观察,记录实验数据,使用软件DPS计算出EC50值。
用Excel软件构建94株纹枯菌株的敏感性分布图,再根据EC50值的范围,将其从高到低分为不同的浓度区间,统计每个区间内的菌株数量,计算相应的区间频率。以EC50值为横坐标,相应的频率为纵坐标,绘制频率分布图,并通过DPS软件进行正态性检验。若绘制的频率分布图呈正态或拟正态分布,可将所有菌株对供试药剂的EC50平均值作为水稻纹枯病菌对其的敏感基线。
1.5 丙硫菌唑对水稻纹枯病菌蛋白质合成的影响
将水稻纹枯病菌接种在含有不同浓度丙硫菌唑的 PDA 培养基上,28 ℃下培养 4 d。将刮下的不同药剂浓度处理菌丝各称量 0.2 g加入到2 mL离心管,加入直经5 mm和2 mm钢珠各1个,再加入1.5 mL pH 7.0 磷酸盐缓冲液,在冷冻混合球磨仪下研磨至糊状,转移到 10 mL离心管中并定容到10 mL,离心 15 min(4 ℃,4 000 r·min-1),吸取上清液备用。取上一步提取的各浓度药剂处理的上清液即粗蛋白质液 1 mL 加入 5 mL 考马斯亮蓝G-250溶液,静置反应 2 min后,在595 nm条件下利用紫外分光光度计测定吸光度[7-8]与牛血清白蛋白标准曲线进行比较[7-8]。
1.6 丙硫菌唑对病原菌菌丝脂质过氧化程度影响
通过测定病原菌菌丝研磨液的 MDA 含量来了解丙硫菌唑对病原菌菌丝脂质过氧化程度影响,MDA 含量采用硫代巴比妥酸法测定。将病原菌接种至 PD 培养液中,于 28 ℃以 160 r·min-1摇培 3 d。将丙硫菌唑梯度浓度接种至 PD 培养基中,于 28 ℃以 200 r·min-1摇培 12 h,多次抽滤处理后收集菌丝。取0.05 g 菌丝,向其中加入 0.05 mol·L-1的Tris-HCl 溶液 2 mL,用冷冻混合球磨仪磨成匀浆,并将匀浆在4 ℃下12 000 r·min-1离心 20 min。吸取上清 1 mL 于新的2 mL离心管中,再加入0.5%硫代巴比妥酸 1 mL,放于沸水中 30 min,立即冰浴冷却至0 ℃,再以0 ℃、4 000 r·min-1离心 10 min。使用紫外分光光度计分别于 450 nm、532 nm 和600 nm 波长下测定吸光度(OD 值)[7-8]。
MDA 浓度/(mmol·L-1) = 6.45 × (532﹣600) ﹣0.56450(1)
1.7 丙硫菌唑对水稻纹枯病病菌DNA合成影响
水稻纹枯病菌菌丝的制备:将水稻纹枯病菌接种于系列浓度丙硫菌唑的 PDA 培养基上,活化培养 3 d(28 ℃),将菌丝与培养基充分分离,60 ℃烘箱烘干菌丝备用。
DNA 的提取[7-8]:利用CTAB提取法提取菌丝中的DNA含量。
DNA浓度/(mg·L-1)=260÷(0.020×B) ×稀释倍数 (2)
式(2)中:B为比色皿的厚度;0.020为DNA含量为1 mg·L-1的溶液中的吸光度。
1.8 丙硫菌唑对病菌菌丝细胞膜通透性的影响
在经紫外灭菌20 min的操作台中,将培养的菌株用已灭菌的打孔器打下大小相同,长势均匀的菌片(5 mm),每 90 mL PD培养液接种 5 片菌片,28 ℃、120 r·min-1条件下摇床培养 24 h,将不同浓度的丙硫菌唑溶液各10 mL加入后继续培养 12 h,漏斗上放置滤纸片过滤菌丝,每处理设3次重复,通风橱晾干菌丝备用。称取晾干菌丝样品0.2 g放入2 mL离心管中,放入真空干燥器,用抽气机抽气7 ~ 8 min以抽出细胞间隙中的空气;加入大小钢珠各1个(直径5 和2 mm)和1.5 mL 无菌水,在冷冻混合球磨仪下研磨直至糊状;转入50 mL离心管定容到20 mL,静置20 min,轻轻地搅动,然后使用电导仪测量电导率。测过电导率之后,再使用沸水加热15 min,达到杀死病菌组织的目的,流水冷却10 min,在室温下测电导率,最终求得电解质相对外渗率[9]。
电解质相对外渗率/% = (处理电导率/煮沸电导率)×100 (3)
1.9 丙硫菌唑对病菌麦角甾醇合成的影响
水稻纹枯病菌在 PDA 培养基上活化 3 d,用直径5 mm打孔器打取相同大小、长势均匀的菌块接种于 90 mL PDB培养液中,每个处理6个菌块,150 r·min-1,28 ℃条件下摇床培养3 d。加入系列浓度的丙硫菌唑,每个处理重复 3 次,设无菌水对照,继续培养 2 d,放置滤纸片于漏斗上,完全滤去菌丝中的培养液,60 ℃下烘干菌丝备用。分别称取不同药剂浓度处理下的菌丝各 0.2 g 进行皂化反应[9]:将干燥的菌丝粉碎后放在50 mL离心管并加入 20 mL 乙醇溶液和10 mL 50% KOH 溶液,密封,剧烈振摇后在80 ℃下皂化120 min。第1个30 min内,每10 min 摇 1 次,然后每30 min振摇 1 次。趁热加入 10 mL水,用 5 mL 正己烷振摇提取 1 次,再加正己烷振摇提取 2 次,每次5 mL,合并正己烷液75 ℃旋转蒸发得到沉淀物质,用适量异丙醇溶解所得沉淀后在 5 mL 离心管中定容,使用0.45 μm规格的有机微孔滤膜过滤后,0 ℃储存备用。在设定的色谱条件下,分别测定不同样品中的麦角甾醇的峰面积,计算麦角甾醇在菌丝中的含量[8, 10]。
1.10 丙硫菌唑对水稻防御酶活性的影响
以不同药剂浓度处理下第1、第3和第7 天的水稻叶片为材料,采用分光光度计法测定喷施药剂后不同时间点的水稻组织内的防御酶活性的变化,设无菌水为阳性对照,100 mg·L-1的井岗霉素为对照药剂,比较丙硫菌唑与对照药剂之间以及其不同浓度间的差异,初步了解防御酶活性与丙硫菌唑之间的关系。
将水稻种子用0.5%的KMnO4溶液浸泡12 h,再用无菌水反复冲洗2~3次,将种子放在湿润的垫有无菌纱布的培养皿中黑暗培养2 d,待种子冒出白芽后放于口径21 cm、高13 cm的装有营养土与基质土等量混合的培养种植盆中,等到水稻苗长至三叶一心时用于下一步试验。
试验设置7个处理组,每个处理25 株稻苗,设3次重复。处理 1、2、3、4和5分别为0.5、1、2、4和8 mg·L-1的丙硫菌唑,处理6为无菌水,处理7为井岗霉素100 mg·L-1。7个处理溶液对水稻植株进行均匀的喷施,分别取在处理后1、3和7 d的水稻植株相同部位的叶片,用于CAT、POD、SOD和PAL活性的测定[11]。
取上述样品 0.2 g 于液氮预冷的2 mL离心管中,加入 1.5 mL 0.05 mol·L-1(pH=7.8)PBS 和适量 1%()的聚乙烯吡咯烷酮(PVP),加入大小钢珠各一个(5 和2 mm),在冷冻混合球磨仪下研磨直至匀浆后,4 ℃低温 8 000 r·min-1离心 20 min 后,取 1 mL 上清液于新的离心管中 4 ℃冰箱保存,上清液即为酶提取液。
1.11 丙硫菌唑防治水稻纹枯病田间效果
试验在庐江县万山镇永桥村刘传应户水稻田中进行。本试验田前茬为早稻,本茬水稻2018年6月30日播种,7月30日抛栽,每亩大田用种量7.5 kg。水稻品种为武运粳31,试验药剂为4.8×105mg·L-1丙硫菌唑悬浮剂,剂量每亩分别为25、30和35 mL。对照药剂为2.4×105mg·L-1噻呋酰胺悬浮剂,剂量为每亩20 mL,设清水对照。小区面积30 m2;重复4次。水稻分蘖末期至幼穗分化期第一次施药,孕穗期第二次施药。使用容量为每亩30 L,均匀喷雾。第2次施药后7和14 d,进行药效调查。采取对角线取样法,每小区取样5点,每点调查相连5丛,每小区调查25丛,记录总株数、病株数,并按9级分级标准调查分级,计算病株率、病情指数和防治效果,评价推荐剂量下对水稻的安全性。
2 结果与分析
2.1 丙硫菌唑对水稻纹枯病菌的毒力及菌株的敏感性
结果表明,不同浓度杀菌剂对94株水稻纹枯病菌的毒力有明显差异。EC50值最大值与最小值相差34.21倍,其中菌株AHGD1对丙硫菌唑的敏感性较强,EC50值为 0.136 5 mg·L-1。菌株AHFT6对丙硫菌唑的敏感性较差, EC50值为 4.669 2 mg·L-1(图1)。这些菌株的平均EC50值为(1.062 9 ± 0.795 9)mg·L-1。94株水稻纹枯病菌对丙硫菌唑的敏感性频率分布呈连续单峰曲线,接近正态分布。可以看出所测菌株对丙硫菌唑的EC50值分布主要集中在0.5~1 mg·L-1这一区间内。没有出现敏感性下降的抗药性群体,因此,这些菌株均为丙硫菌唑敏感菌株,可以釆用这些菌株的平均EC50值(1.062 9 ± 0.795 9)mg·L-1作为该地区水稻纹枯病菌对丙硫菌唑的敏感性基线。
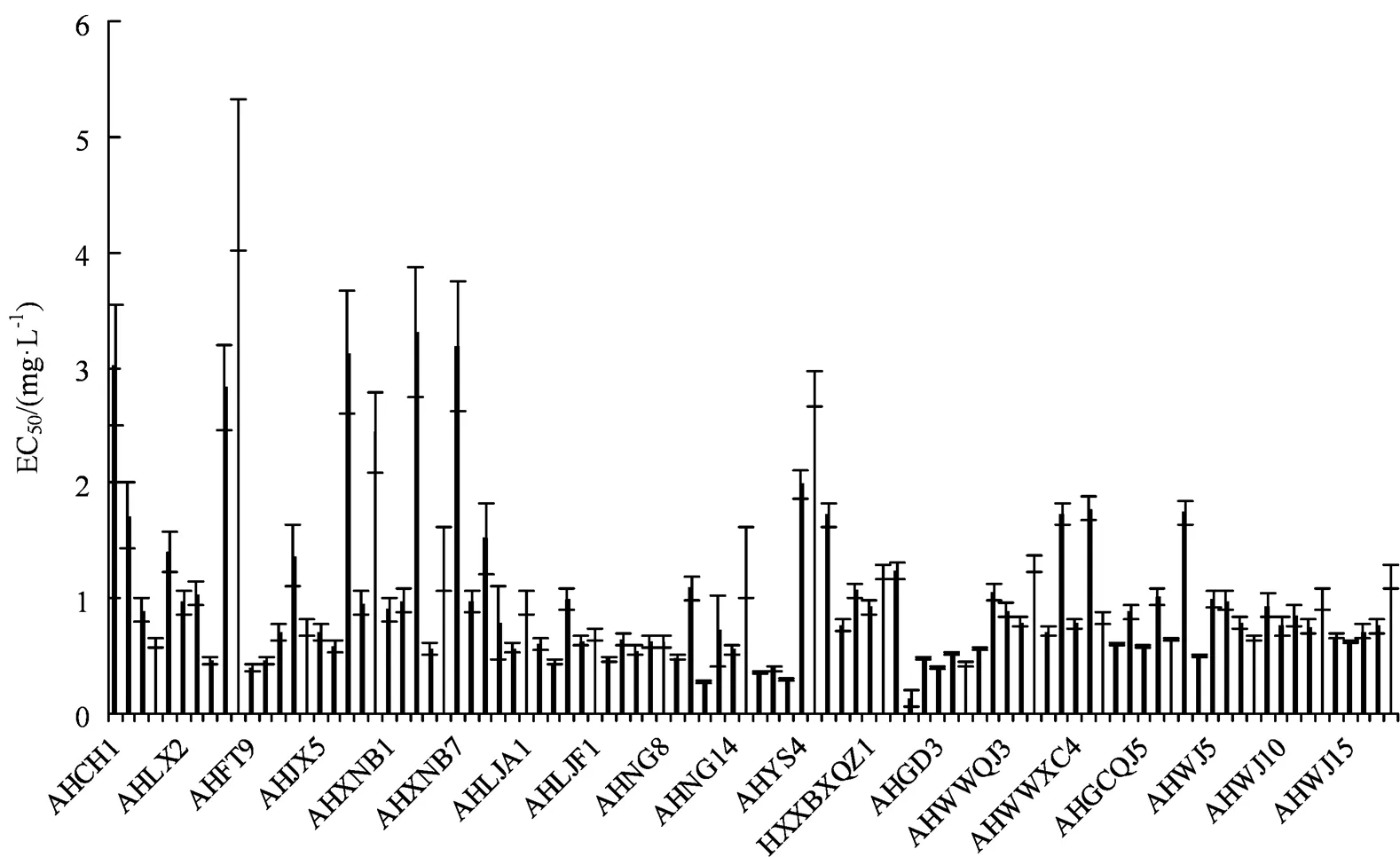
图1 94株水稻纹枯病菌的EC50值分布
Figure 1 EC50distribution of 94 strains of rice sheath blight fungi
2.2 丙硫菌唑对水稻纹枯病菌的作用机制
2.2.1 丙硫菌唑对水稻纹枯病菌菌丝的影响 将纹枯病菌在室内培养3 d后,用倒置显微镜观察。结果表明,在不含药培养基上培养3 d的CK菌丝分叉多,而且菌丝交联程度大;随着丙硫菌唑药剂浓度的提高,菌丝的分叉减少,菌丝分叉间隔变大,交联程度降低(图2)。
2.2.2 丙硫菌唑对病菌 DNA 合成的影响 丙硫菌唑不同浓度处理的水稻纹枯病病菌菌丝 DNA 含量差异显著,且药剂处理的菌株DNA 含量均低于对照(图3)。丙硫菌唑处理后菌丝中 DNA 含量随药剂浓度的递增呈减少趋势,在药剂浓度为4 mg·L-1含量最低。DNA 含量的减少,削弱了病菌繁衍能力,降低了水稻纹枯病菌的数量,从而遏止了水稻纹枯病的发展。
2.2.3 丙硫菌唑对病菌可溶性蛋白合成的影响 结果表明,与空白对照相比,经过丙硫菌唑处理的水稻纹枯病菌菌的可溶性蛋白含量都有所降低,且随着浓度的增加,病菌可溶性蛋白含量呈现下降趋势(图4)。各浓度丙硫菌唑对病菌的可溶性蛋白合成影响效果差异性显著(< 0.05)。

图中A、B、C、D、E、F分别表示无菌水对照、0.5、1、2、4和8 mg·L-1。
Figure 2 Morphology of mycelium under different concentration of agents

图中不同小写字母表示处理间差异显著(P<0.05)。下同。
Figure 3 Differences of DNA synthesis in mycelia under different concentrations of agents
2.2.4 丙硫菌唑对病菌菌丝脂质过氧化程度的影响
丙硫菌唑处理后纹枯病菌的 MDA 含量始终高于未用丙硫菌唑处理的 MDA 含量,且差异显著,并且随着丙硫菌唑浓度的提高,菌丝中MDA的含量呈现递增趋势。CK处理的 MDA 含量最低,丙硫菌唑处理后提高了病菌菌丝脂质过氧化产物丙二醛的含量会导致病原菌菌丝脂质过氧化。说明丙硫菌唑处理后立枯丝核菌菌丝的脂质过氧化程度显著升高,会增加菌体氧化程度,破坏病原菌菌体稳定性(图5)。
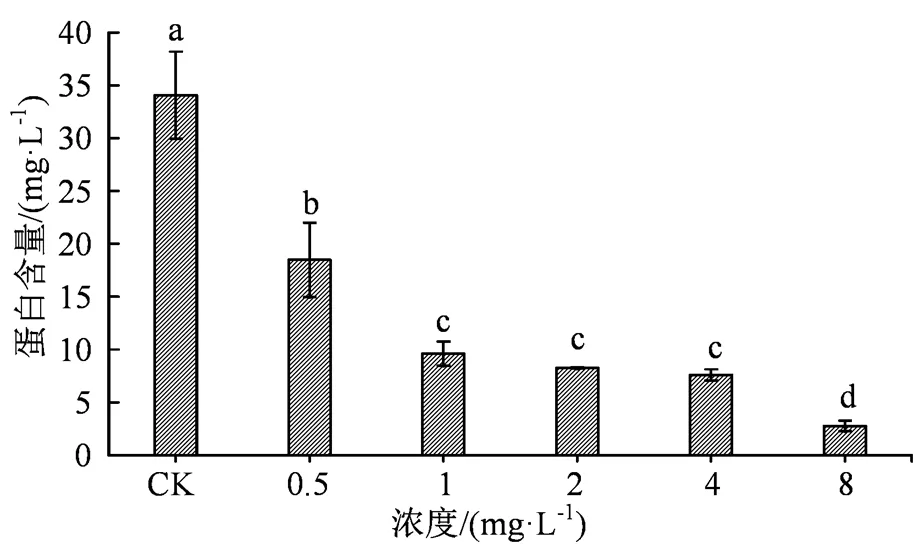
图4 不同药剂浓度下菌丝可溶性蛋白含量的差异
Figure 4 The content difference of soluble protein in mycelium under different concentration of agents
Figure 5 Differences of MDA content in mycelia under different concentrations of agents
2.2.5 丙硫菌唑对病菌菌丝细胞膜通透性的影响
由电导率测定结果(表1)可知,随着药剂浓度的增加,菌丝的电解质相对外渗率呈递增趋势。电解质相对外渗率反映了菌丝电解液泄漏的能力,决定着菌丝破损的严重程度。表明丙硫菌唑对水稻纹枯病菌细胞膜有损伤效果, 且损伤程度随着处理药剂浓度的增大而增加。

表1 不同药剂浓度处理下水稻纹枯病菌菌丝的破损差异
2.2.6 丙硫菌唑对病菌麦角甾醇合成的影响 不同浓度的丙硫菌唑处理的水稻纹枯病菌丝中的麦角甾醇的含量可以通过峰面积的大小来反映。峰面积越大,麦角甾醇含量越高。如表2所示,经药剂处理后,水稻纹枯病菌丝合成麦角甾醇的能力得到有效抑制,且抑制效果随丙硫菌唑浓度的提高呈递增趋势。在药剂浓度为4 mg·L-1时,抑制率可达30.97%。

表2 不同浓度药剂处理后水稻纹枯病菌菌丝麦角甾醇的含量
2.2.7 丙硫菌唑对水稻寄主防御酶的影响 结果表明(图6),施药后第1天 CAT 、SOD和POD活性在药剂浓度为1 mg·L-1处理达到第1次峰值,随后活性随着药剂浓度提高开始轻微下降后再次呈现递增趋势;PAL活性在药剂浓度为0.51 mg·L-1时最低,之前随药剂浓度的提高而递增,在药剂浓度为2 mg·L-1时达到峰值,之后随浓度升高再度下降。药后第3 天,CAT活性在0.5 mg·L-1时最低,然后随着药剂浓度的提高,活性呈递增趋势,在药剂浓度为4 mg·L-1时达到峰值;SOD活性随药剂浓度提高呈递增趋势,在2 mg·L-1时达到峰值;POD活性在0.5 mg·L-1时最高,然后随着药剂浓度提高呈递减趋势;PAL活性在药剂浓度为1 mg·L-1时最小,然后随着药剂浓度增加呈现递减趋势。药后第7 天,CAT活性在0.5 mg·L-1时达到峰值,而后呈现递减趋势;SOD活性随药剂浓度提高而表现出递增趋势;POD和PAL活性随着药剂浓度增加显现出递减趋势。综上所述,CAT活性在1 mg·L-1丙硫菌唑诱导水稻后第1 天时最高;POD和SOD活性在药后第3 天药剂浓度高于8 mg·L-1时呈现增强趋势;PAL活性在药剂处理第1天活性最好且浓度为2 mg·L-1活性最高,然后活性随着时间的推移而降低。总体而言,在药剂浓度作用下,酶活性均呈现较好的状态。与井岗霉素相比,丙硫菌唑表现出诱导抗性能力强于井岗霉素(< 0.05)。

(A: SOD;B: CAT;C: POD;D: PA;CK代表空白对照。0.5、1、2、4和8 mg·L-1代表不同的丙硫菌唑悬浮剂药剂浓度;阳性对照为100 mg·L-1的井岗霉素粗粉)。
Figure 6 Effects of different pesticide concentrations on the activities of CAT, SOD, POD and PAL in rice
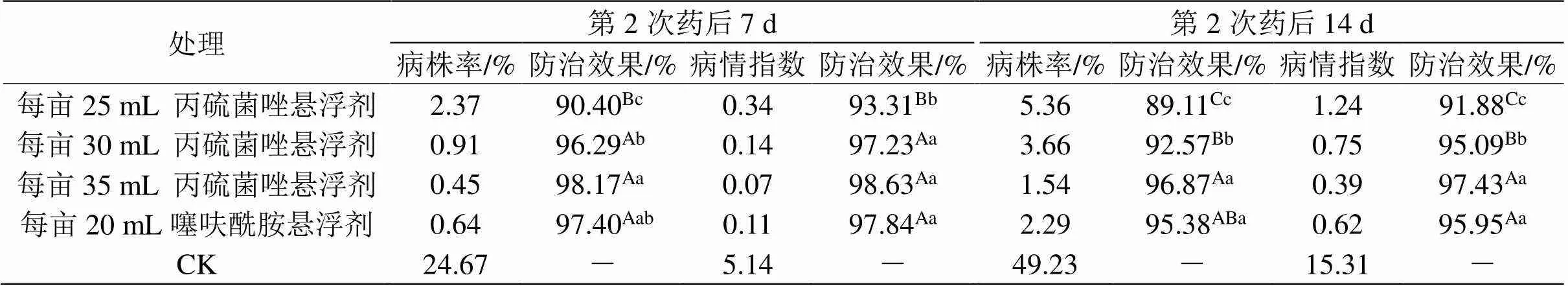
表3 丙硫菌唑防治水稻纹枯病的田间效果
2.3 丙硫菌唑对水稻纹枯病田间防治效果
结果表明,两次防治后病株率和病情指数的防治效果均大于90%,与噻呋酰胺的防效相当,说明丙硫菌唑对水稻纹枯病的防治有较好的效果,且中、高剂量处理对水稻纹枯病防治效果显著高于低剂量处理(表3)。
3 讨论与结论
3.1 丙硫菌唑对水稻纹枯病菌的敏感性和纹枯病的防效
丙硫菌唑对94株水稻纹枯病菌有较高的抑菌活性,其中丙硫菌唑对水稻纹枯病菌AHGD1的抑制效果最好,EC50值为 0.136 5 mg·L-1。丙硫菌唑对水稻纹枯病菌AHFT6的抑制效果较差 EC50值为 4.669 2 mg·L-1。这些菌株的平均EC50值为(1.062 9±0.795 9)mg·L-1。94株菌株的均为丙硫菌唑敏感菌株,可以釆用这些菌株的平均EC50值(1.062 9 ± 0.795 9)mg·L-1作为该地区水稻纹枯病菌对丙硫菌唑的敏感性基线。菌株之间的EC50值最大相差将近35倍,推测防效较差的稻区可能与其是否施用过此药剂或导致交互抗性的药剂种类有关。田间药效试验表明,4.8×105mg·L-1丙硫菌唑悬浮剂,每亩施用剂量为25、30和35 mL时,对水稻纹枯病均的防治效果分别达90.40%、96.29%和98.17%,且对水稻生长安全。施用剂量为25和30 mL的防治效果存在显著性差异,说明在合理用药的同时,高剂量的丙硫菌唑对水稻纹枯病的防治效果更显著,这与吴双[8]研究所得结论一致。刘保友等[12]研究表明,三唑类杀菌剂之间具有交互抗性。因此,在使用丙硫菌唑时,应注意与其他不同作用机制的药剂轮换或者复配使用,从而避免水稻纹枯病菌对其产生抗性,可延长丙硫菌唑使用年限。
3.2 丙硫菌唑对水稻纹枯病菌的作用机制
生理生化测定结果表明,丙硫菌唑导致病菌麦角甾醇含量降低,菌丝细胞渗透压、菌丝脂质过氧化程度升高,DNA含量和可溶性蛋白含量随降低。丙硫菌唑使POD、CAT、SOD和PAL 4个植物基础防御酶活性升高。丙硫菌唑可能是通过抑制麦角甾醇的生物合成,破坏细胞膜流动性,达到了杀菌效果,从而可能会影响部分能量代谢过程,导致DNA和蛋白质浓度的微小变化。而且,麦角甾醇是真菌细胞膜的重要组成部分,能够维持细胞膜的流动性、生物调控和三维结构。构成真菌细胞膜的甾醇是C-4去甲基麦角甾醇。虽然与其他三唑类药物一样,丙硫硝唑通过抑制了病菌合成麦角甾醇的能力,导致真菌细胞的破裂和死亡。通过对病菌MDA含量和细胞膜通透性测定也证明了病菌的细胞膜受到药剂破坏。因此,丙硫菌唑的治疗效果主要是通过抑制水稻纹枯病菌甾醇的合成,细胞膜受到破坏,致使病菌裂解死亡,丧失致病能力。施药后寄主防御酶在水稻植株体内的活性都显著提高,表明丙硫菌唑具有一定的诱导抗性能力,从而提高田间防治效果。
丙硫菌唑的作用机理是抑制真菌中甾醇的脱甲基化作用,即脱甲基化抑制剂(DMIs)来实现对病菌的抑制。丙硫菌唑内吸活性较好,能够兼顾实现对作物的保护与治疗作用,而且药效持续时间长,对作物十分安全并能够促进作物增产[13]。
[1] GROTH D E, BOND J A. Effects of cultivars and fungicides on rice sheath blight, yield, and quality[J]. Plant Dis, 2007, 91(12): 1647-1650.
[2] 孙克. 全球十大杀菌剂的市场与展望[J]. 农药, 2013, 52(7): 469-475.
[3] 谭清群, 何海永, 陈小均, 等. 贵州水稻纹枯病菌对噻呋酰胺和己唑醇的敏感性测定[J]. 四川农业大学学报, 2017, 35(2): 159-166.
[4] 张坤. 高效防控稻麦纹枯病的农药配方筛选及剂型研发[D]. 扬州: 扬州大学, 2019.
[5] 张强. 安徽玉米小斑病菌对几种杀菌剂的敏感性基线及对丙硫菌唑的抗药性风险研究[D]. 合肥: 安徽农业大学, 2017.
[6] 陈年春. 农药生物测定技术[M]. 北京: 北京农业大学出版社, 1991.
[7] 侯福林. 植物生理学实验教程[M]. 3版. 北京: 科学出版社, 2015.
[8] 吴双. 伏立康唑对植物病原真菌的作用及机理研究[D]. 哈尔滨: 东北农业大学, 2013.
[9] 董胜豪. 不同种源白皮松茎和针叶的电阻抗参数与生理参数相关性研究[D]. 保定: 河北农业大学, 2009.
[10] 韩平, 刘西莉, 刘鹏飞, 等. 高效液相色谱法研究啶菌噁唑对番茄灰霉病菌麦角甾醇生物合成的影响[J]. 分析化学, 2006, 34(10): 1467-1470.
[11] 蒋细良. 中生菌素对水稻主要防御酶的系统诱导[D]. 北京: 中国农业大学, 2005.
[12] 刘保友, 张伟, 栾炳辉, 等. 苹果轮纹病菌对苯醚甲环唑和氟硅唑的敏感性及其交互抗性[J]. 植物病理学报, 2013, 43(5): 541-548.
[13] 张爱萍, 李勇. 新型三唑硫酮类杀菌剂丙硫菌唑的研究进展[J]. 今日农药, 2011(6): 27-28.
Study on the bioactivity of prothionazole tocaused by rice sheath blight
ZHANG Sen, TAN Li, WANG Zhangxun, ZHANG Lixin, LI Miao, TAN Genjia
(School of Plant Protection, Anhui Agricultural University, Hefei 230036)
Prothioneazole is a broad-spectrum triazole fungicide at present. In order to clear out the bioactivity of prothionazole tocaused by rice sheath blight, the mechanism of action of prothioneazole was preliminarily confirmed by determining the contents of DNA, MDA, ergosterol and protein in the hyphae of, and the changes of defense enzyme activities in rice, the osmotic pressure of mycelial cells and mycelial lipid peroxidation were studied with the method of physiology, biochemistry and molecular biology. The control effects of prothionazole on rice sheath blight were studied by a field experiment and bioassay. The results showed that prothionazole had high antifungi activity against 94 strains of rice sheath blight, and the average EC50value (1.062 9 ± 0.795 9) mg·L-1of these strains could be used as the baseline of the sensitivity of rice sheath blight fungi to prothioxazole in this area. The changes in DNA, soluble protein and ergosterol contents in the hyphae oftreated with different concentrations of prothioconazole showed that prothioconazole would lead to the reduction of sterols content, the increase of the osmotic pressure of mycelial cells and degree of the mycelial lipid peroxidation, and the decrease of DNA and soluble protein contents. The activities of POD, CAT, SOD and PAL showed an increasing trend under the action of a series of insecticides, and they had certain inductive disease resistance. The results of field efficacy experiment showed that prothionazole suspension at the dosage of 25, 30 and 35 mL per mu in the concentration of 4.8×105mg·L-1had good control effect on rice sheath blight, reaching 90.40%, 96.29% and 98.17%, respectively, and the control effects were similar to those of the control agent, thiofuramide. The safety evaluation of prothionazole on rice showed that different concentrations of prothionazole had no significant effect on the normal rice growth.
prothionazole; rice sheath blight; bioassay; mechanism
S435.111.42; S482.2
A
1672-352X (2022)05-0700-07
10.13610/j.cnki.1672-352x.20221111.009
2022-11-14 10:56:07
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20221111.1112.018.html
2021-10-29
安徽省科技重大专项(201903b020008),省重点研发计划(1804a07020139)和国家重点研发计划(2016YFD0200806)共同资助。
张 森,硕士研究生。E-mail:1273391902@qq.com
檀根甲,博士,教授,博士生导师。E-mail:tgj63@163.com
